耐甲氧西林金黄色葡萄球菌血流感染死亡患者临床特征及危险因素分析
许雨乔,宋为娟,夏文颖,倪 芳,陆燕飞
金黄色葡萄球菌是血流感染常见的病原菌之一,占所有血流感染病原菌的20%~25%[1]。耐甲氧西林金黄色葡萄球菌(MRSA)因携带多种耐药基因和毒力基因,对常用抗菌药物不敏感,具有较高的发病率和死亡率,是金黄色葡萄球菌血流感染患者死亡的独立危险因素[2-3]。早期预测和及时有效的抗菌药物治疗能显著改善患者预后[4-5]。因此本研究回顾性分析了2015—2020 年南京医科大学第一附属医院MRSA 血流感染患者的临床特征及预后危险因素,为临床医师早期诊断治疗提供依据。
1 材料与方法
1.1 研究对象
收集2015 年1 月—2020 年12 月本医院门诊及住院146 例患者血液标本分离的MRSA 共146株(剔除同一患者分离的相同菌株),其中4 例患者因资料不全被排除,共142 例纳入研究。纳入标准:①血流感染的诊断参照相关诊断标准[6-7];②至少一次血液培养出MRSA。排除标准:病例资料不完整患者。根据患者治疗28 d 预后将MRSA 血流感染患者分为生存组和死亡组。本研究经医院伦理委员会通过。
1.2 方法
1.2.1 菌株分离鉴定及药敏试验
血培养采用FX400 全自动血培养仪(Becton Dickinson,美国)及配套的Bactec Plus/F 树脂需氧培养瓶和Bactec Lytic/10 含溶血素厌氧培养瓶。细菌鉴定和药敏试验均采用VITEK-2 Compact 全自动细菌鉴定仪(BioMérieux,法国)。药敏结果按照美国CLSI M100-S30 标准判读[8]。质控菌株为金黄色葡萄球菌ATCC 25913。
1.2.2 临床资料
收集患者临床资料,包括年龄、性别、就诊和出入院日期、入院诊断、入住科室、基础疾病、侵袭性操作、MRSA 感染部位及时间、抗菌药物使用、实验室检查及预后。实验室检查指标包括白细胞、中性粒细胞、红细胞、血清总蛋白、血清白蛋白、D-二聚体、C 反应蛋白(CRP)和降钙素原(PCT)。白细胞、中性粒细胞和红细胞采用全自动模块式血液体液分析仪XN-10[B1](Sysmex,日本)检测;PCT 采用IMMAGE800特定蛋白仪(Beckman,美国)检测;CRP 采用Cobas e602(Roche,瑞士)检测;血清总蛋白和白蛋白采用AU5800 全自动生化分析仪(Beckman,美国)检测,D-二聚体采用全自动血凝分析仪Sysmax CS-5100(Sysmex,日本)检测。结果判定标准参照《全国临床检验操作规程》[9]。
1.3 统计分析
采用SPSS 20.0 统计软件对数据进行分析,正态分布的计量资料采用独立样本t检验,以“均数±标准差”表示;不符合正态分布的计量资料采用Mann-WhitneyU检验,以中位数(四分位数)表示;计数资料以例数(%)表示,采用χ2检验。将单因素分析中有统计学意义的变量纳入多因素分析,采用logistic 二元回归模型对MRSA 血流感染的危险因素和预后影响因素进行多因素分析,P<0.05 为差异有统计学意义。受试者工作特征(ROC)曲线确定最佳诊断界值,分析诊断效能。
2 结果
2.1 药敏结果分析
MRSA 对青霉素、氨苄西林均耐药,对喹诺酮类抗菌药物耐药率在50%以上,对替加环素、利奈唑胺和万古霉素均敏感。

表1 MRSA 对常用抗菌药物敏感率及耐药率Table 1 Susceptibility of MRSA strains to antimicrobial agents (%)
2.2 预后危险因素的单因素分析
142 例MRSA 患者中男性110 例,女性31例,年龄16~92 岁,平均(60.1±17.5)岁,主要分离自监护病区和肾内科。患者多合并基础疾病,依次为高血压(50 例,35.2%)、恶性肿瘤(32例,22.5%)、心血管疾病(32 例,22.5%)、慢性肾脏病(22 例,15.5%)和腔隙性脑梗死(16 例,11.3%)等。恶性肿瘤以胃癌(11 例)和胰腺癌(6例)为主;心血管疾病主要为瓣膜性心脏病(9 例)和冠状动脉粥样硬化心脏病(7 例)。
患者治疗28 d 后生存99 例,死亡43 例,死亡率为30.3%。两组患者在基础疾病(高血压、腔隙性脑梗死、合并感染性休克)、医院事件(输血和入住ICU)、侵袭性操作(手术和气管插管)、合并呼吸系统感染和感染前经验使用抗菌药物均存在差异(P<0.05)。见表2。合并呼吸系统感染的患者中88.0%(22/25)为呼吸系统感染继发血流感染。
实验室检查指标中死亡组患者血清PCT 水平高于生存组(P<0.05),总蛋白低于生存组(P<0.05),白细胞、中性粒细胞、白蛋白、D-二聚体两组差异无统计学意义。
2.3 血清PCT 对预后诊断的价值
死亡组患者PCT 水平显著高于生存组,P<0.001(见表2)。ROC 曲线显示血清PCT 值预测MRSA 血流感染患者预后具有较高AUC值(0.723),诊断界值为1.08 μg/L,灵敏度73.3%,特异度66.2%。见图1。
2.4 预后危险因素的多因素logistic 回归分析
表3 结果显示合并感染性休克和合并呼吸系统感染是MRSA 血流感染患者死亡的独立危险因素(P<0.05)。
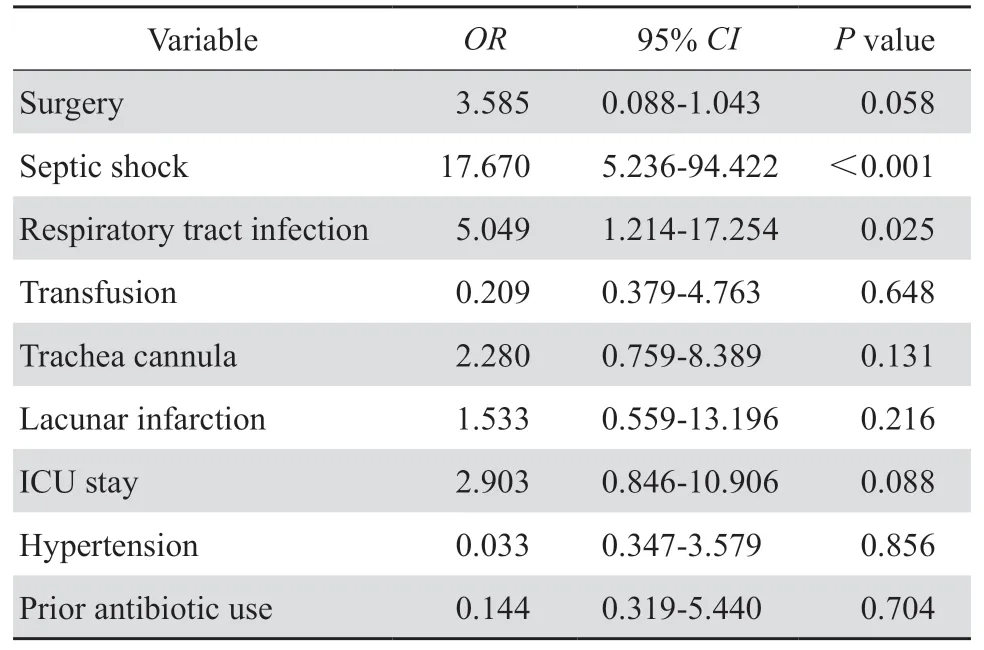
表3 MRSA 血流感染患者死亡危险因素多因素分析Table 3 Multivariate analysis of factors for death of patients with MRSA bloodstream infection
3 讨论
本研究从血液标本中分离MRSA 的患者以男性、老年检出率高,与其他文献报道一致[10],老年患者多合并其他基础疾病,对病原菌的抵抗力弱,临床医师应给予重视。MRSA 血流感染患者主要来自监护病区和肾内科,与患者基础疾病密切相关。因细菌耐药状况的地域差异性,本院药敏试验显示MRSA 对喹诺酮类抗菌药物耐药率在50%以上,高于全国水平[9],未发现对替加环素、利奈唑胺和万古霉素耐药菌株。
PCT 是临床反映患者炎性反应的生物标志物,在炎性早期即显著升高,且与患者感染严重程度密切相关[11]。已有研究表明PCT 可作为判断血流感染的观察指标[12],本研究结果证实PCT 值与MRSA 血流感染患者预后也呈正相关,MRSA 血流感染患者血清PCT 值高于1.08 μg/L 时,提示患者可能预后不佳。患者在炎症状态下白蛋白的合成降低,分解加速,从而引发低蛋白血症[13]。死亡组患者血清总蛋白和白蛋白含量均低于生存组,血清白蛋白降低导致蛋白与药物结合位点减少,游离药物浓度增加,从而影响药动学参数和临床疗效[14]。目前,替考拉宁和万古霉素作为临床治疗MRSA 感染的常用抗菌药物,低蛋白血症可导致患者治疗失败[15-16],因此对于严重MRSA 血流感染患者,临床医师应充分观察血清蛋白水平,合理调整抗菌药物剂量。
MRSA 血流感染能显著增加患者死亡率,本研究中MRSA 死亡率为30.3%,高于金黄色葡萄球菌血流感染死亡率(12.2%)[17]。患者死亡危险因素分析显示合并感染性休克和合并呼吸系统感染是MRSA 血流感染患者死亡的独立危险因素。MRSA 血流感染患者容易合并呼吸系统、软组织和腹腔等部位感染,其中以合并呼吸系统感染最为常见,也是MRSA 血流感染患者死亡的独立危险因素。金黄色葡萄球菌的表面蛋白使其易定植于鼻腔、胃肠道等部位,在宿主免疫防御系统被破坏时可引起感染。死亡组患者多存在气管插管等侵袭性操作,显著增加了患者呼吸道感染的风险,与其他研究报道一致[18]。有效预防呼吸道感染能显著降低患者死亡率。MRSA 进入血液系统后,可产生溶血素等毒力因子,抑制补体活性,损伤组织细胞,最终发展为感染性休克,是MRSA 血流感染患者死亡的独立危险因素,显著增加了患者死亡风险。抗菌药物虽可杀灭MRSA,其毒力因子所引发的临床问题难以解决,且抗菌药物的反复作用可促进MRSA 释放更多的毒力因子,加重脓毒血症。现有研究报道在抗菌药物的基础之上联合使用抗体类药物可在高效杀菌的同时中和并清除毒素,改善患者预后[19]。
综上所述,合并感染性休克和合并呼吸系统感染是患者预后的独立危险因素,早期预防可有效改善患者预后。血清PCT 值对预测MRSA 血流感染患者预后有一定临床应用价值。本研究为回顾性、单中心研究,样本数量偏少,可能存在偏倚,尚需大样本多中心的研究进一步证实。

