血液肿瘤患儿中心静脉导管相关血流感染的危险因素分析
王 丹,张 娜,邵静波,王妍捷,薛晓燕,蒋 慧
长期中心静脉导管(CVC)可以满足恶性血液肿瘤患者多疗程化疗、接受造血干细胞移植的需要,可以避免化疗药物对血管和组织的刺激及损伤,减少反复穿刺所带来的疼痛,已成为儿童血液肿瘤患者治疗的方式。但CVC 同时也增加了病原菌侵袭机会,患者发生导管相关血流感染(catheter-related bloodstream infections,CRBSI)风险增加。CRBSI 是医院获得性脓毒血症的主要原因之一,增加重症发生率及死亡率、延长住院时间[1-2],研究CVC 引起儿童CRBSI 的危险因素,分析病原菌特点和耐药情况,能够为预防CRBSI发生、合理使用抗菌药物提供临床指导,对降低医院感染率、减轻患者负担具有重要意义。
1 材料与方法
1.1 材料来源
1.1.1 临床资料 收集2015 年1 月1 日-2020 年12 月31 日上海市儿童医院血液科住院行CVC 的血液肿瘤患者486 例,其中完全植入式静脉输液港(PORT)58 例,经外周静脉置入中心静脉置管(PICC)428 例。分析患者的临床资料(年龄、性别、原发疾病、中性粒细胞绝对值)、置管相关数据(置管天数、置管次数、置管季节)和感染发生情况等资料。
1.1.2 仪器和试剂 采用法国生物梅里埃公司VITEK 全自动细菌鉴定系统进行菌株鉴定,药敏试验采用美国CLSI 2010 年版指南推荐的纸片扩散法(K-B 法)。
1.1.3 质控菌株 大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853 和金黄色葡萄球菌ATCC 25923。
1.2 方法
1.2.1 定义 根据美国感染病学会(IDSA)2009年更新的血管内导管相关感染的诊断和治疗临床指南,有实验室检查确诊血流感染(BSI)或出现脓毒血症,并符合下列情况之一即可诊断CRBSI:①穿刺部位或者导管走行部位皮肤有红肿疼痛、排脓或蜂窝织炎表现;②病原菌培养取导管尖端5 cm 送检,细菌数≥15 CFU/平板为阳性,以及至少一次外周血培养分离到相同致病菌;或导管侧定量血培养细菌数至少为外周侧同时抽取血培养的3 倍;或外周侧培养出同种细菌,导管侧血培养阳性比外周血早2 h[外周血培养时间差(differential time to positivity,DTP)][3]。如果同一类型的病原微生物在14 d 内发生重复感染,则被定义为复发,不作为新的CRBSI 发生。带管日是指导管从放置之日起至拔管或者研究结束的天数[4]。CVC 相关血流感染发生率=CVC 相关血流感染例次/CVC 插管总日数×1 000‰[5]。
1.2.2 导管入口护理 常规及发生CRBSI 的临床干预,定期每周或者在导管表面敷贴被污染、松动时使用75%酒精棉棒+氯己定进行局部皮肤消毒,更换导管敷贴[6]。发生CRBSI 处理:①拔管,根据临床严重程度、鉴定的病原体和对抗菌药物治疗的反应来决定是否拔除CVC,拔除导管尖端送微生物培养;②保留导管,停止使用导管、使用抗菌药物锁定疗法封闭导管,每天至少12 h,连续7~14 d;③全身抗感染治疗,根据药敏试验回报及时调整抗生素[7]。
1.2.3 统计学方法 采用SPSS 26.0 统计软件对所得数据进行分析,计量资料采用非参数Mann-WhitneyU检验比较组间差异,分类资料分析比较采用χ2检验,采用二分类logistic 回归分析方法分析CRBSI 发生的影响因素,绘制受试者工作特征(ROC)曲线分析预测带管日指标对CRBSI 发生的预测价值,检验水平为α=0.05,即P<0.05 时,差异有统计学意义。
2 结果
2.1 患者基本情况
本次研究共收集486 例行CVC 的血液病患儿,314 例(64.6%)患儿系急性淋巴细胞白血病,69例(14.2%)系急性髓系白血病,58 例(11.9%)系淋巴瘤,31 例(6.4%)系再生障碍性贫血或者骨髓增生异常综合征,14 例(2.9%)为其他疾病(实体肿瘤或免疫缺陷病行干细胞移植者)。486 例患者的总导管日为118 521 d,有49 例发生73 例次CRBSI 事件,其中15 例次CRBSI 通过DTP 确诊,余58 例次通过微生物定量培养确诊,CRBSI的发生率为0.6/1 000 导管日。CRBSI 组的年龄中位数为4.0 岁,带管日中位数257.0 d,非CRBSI组的年龄中位数为5.0 岁,带管日中位数为243.0 d。两组在不同带管日(P=0.034)、不同原发病(P<0.001)、不同置管类别(P<0.001)差异有统计学意义,而与年龄(P=0.292)、性别(P=0.873)及置管季节(P=0.096)无关。见表1。

表1 486 例中心静脉置管患者基本信息Table 1 Clinical characteristics of 486 children with central venous catheter
73 例次CRBSI 事件中有34 例次(46.6%)发生在夏季,多数患者(42 例次,57.5%)发生CRBSI 时的中性粒细胞绝对值(ANC)<0.2×1012/L,处于严重粒细胞缺乏状态。
2.2 CRBSI 危险因素回归分析
将单因素分析中所有P<0.05 的置管类型、带管日、原发病为自变量纳入回归模型,通过二元logistic 回归分析,置管类型和带管日差异有统计学意义(P<0.05)。置管类型的OR=2.439,表明在其他条件不变时,PORT 置管的CRBSI 风险 是PICC 置管的2.439 倍(OR=2.439,95%CI:1.039~5.728);带管日的OR=1.002,带管日每改变一个单位,CRBSI 风险增加1.002 倍(OR=1.002,95%CI:1.000~1.004),由此可见置管类型和带管日是CRBSI 发生的独立危险因素。见表2。

表2 儿童血液肿瘤患者CRBSI 相关危险因素回归分析Table 2 Regression analysis of risk factors for catheterrelated bloodstream infections in children with hematological malignancy
2.3 不同置管类型反复感染的比较
15 例患儿出现反复CRBSI(≥2 次),其中PORT 置管11 例(73.3%)。对PICC 和PORT 的CRBSI 反复发生例数进行χ2检验,结果显示两种置管类型的反复感染率差异具有显著统计学意义(P<0.001),PORT 的CRBSI 反复发生率(19.0%)高于PICC 的反复发生率(0.9%)。见表3。
所有发生CRBSI 患儿均采用全身静脉抗生素治疗并停止使用导管。5 例CRBSI 患儿因合并严重脓毒性休克直接拔除导管,4 例因反复出现多次CRBSI 提前拔除导管,1 例因抗感染治疗体温控制欠佳后拔除导管,以上10 例患儿导管拔除后行导管末端培养结果全部显示阴性。所有CRBSI 事件中有7 例次合并危重症转入PICU 治疗,以事件发生后30 d 为预后评估时间点,所有CRBSI 患者感染均得到控制并长期生存。
2.4 预测CRBSI 导管感染的ROC 曲线分析
ROC 曲线显示:带管日的ROC 曲线的曲线下面积为0.592(95%CI0.547~0.636,Z=1.785,P=0.074),说明带管日对CRBSI 有一定诊断价值(图1)。诊断临界值为356 d,其灵敏度为36.7%,特异度为92.9%,说明当带管日达到356 d 时,预测CRBSI 导管感染发生的正确率为36.7%(图2)。
2.5 49 例CRBSI 患者病原菌分布情况
49 例CRBSI 患者共分离出病原菌73 株,革兰阳性菌占69.9%(51/73),其中以耐甲氧西林凝固酶阴性葡萄球菌(MRCNS)为主(36/51,70.6%),其次为缓症链球菌(4/51,7.8%)、溶血链球菌(4/51,7.8%);革兰阴性菌占26.0%(19/73),以肺炎克雷伯菌为主(13/19,68.4%),其次为大肠埃希菌(4/19,21.1%)、铜绿假单胞菌(2/19,10.5%)。共分离3 株念球菌(2 株近平滑念球菌和1 株热带念球菌)。
2.6 主要病原菌的耐药性
药敏结果显示MRCNS 36 株,产超广谱β内酰胺酶肠杆菌(ESBL-E)10 株,耐碳青霉烯类肠杆菌目细菌(CRE)4 株。主要革兰阳性菌对万古霉素、利奈唑胺、替考拉宁均敏感。见表4。革兰阴性菌中肺炎克雷伯菌、大肠埃希菌对氨苄西林-舒巴坦、头孢噻肟、头孢他啶、头孢曲松存在不同程度耐药,铜绿假单胞菌对临床常用各类抗假单胞菌抗菌药物的耐药率均较低。见表5。
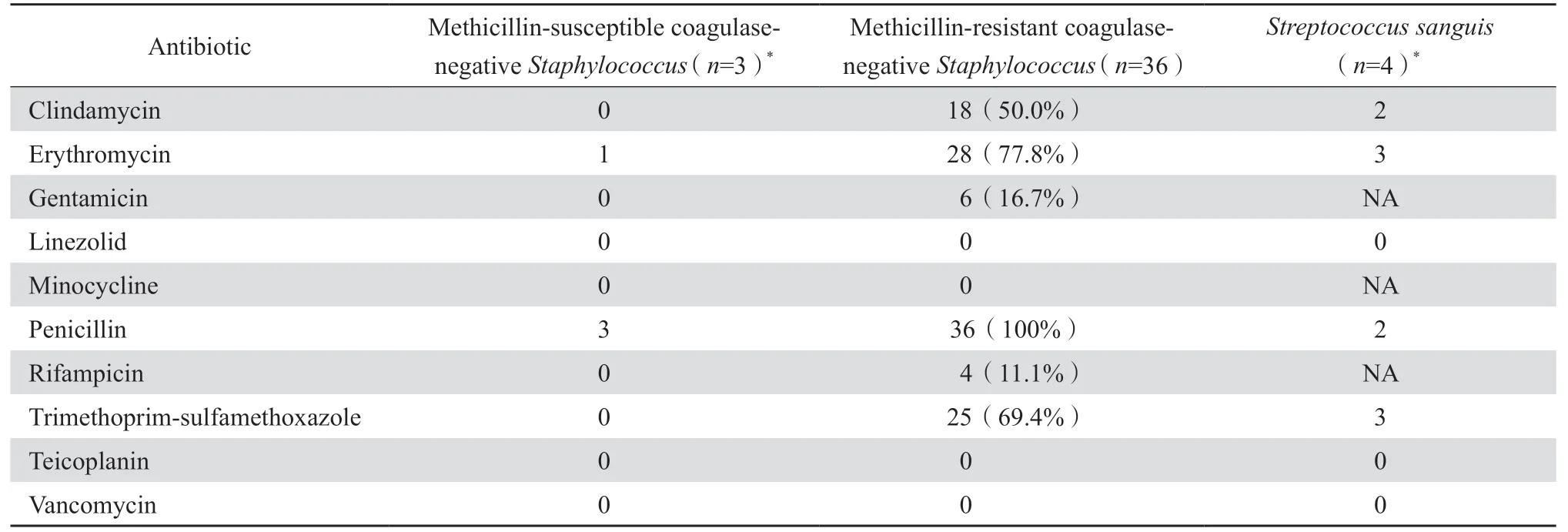
表4 主要革兰阳性菌对常用抗菌药物的耐药性Table 4 Antimicrobial resistance of gram-positive pathogens

表5 主要革兰阴性菌对常用抗菌药物的耐药性Table 5 Antimicrobial resistance of gram-negative pathogens
3 讨论
CRBSI 是医院感染最常见原因之一[8],既往国内有关小儿恶性血液肿瘤疾病CRBSI 影响因素及病原菌研究不多,本研究以恶性血液肿瘤患儿为研究对象,CRBSI 发生率为0.6/1 000 导管日,与国外几项关于成人CRBSI 研究的0.35~0.95/1 000导管日相近[9-10]。而新生儿,特别是早产儿,由于皮肤结构完整性差和免疫系统不成熟,更容易出现血流感染,已报道CRBSI 发生率达4.99/1 000导管日[11]。
本研究数据显示CRBSI 患儿多处于严重粒细胞缺乏的状态,且夏季多发,表明长期处于免疫抑制状态的患者容易发生CRBSI,而夏季多发则考虑与天气炎热导致导管周围皮肤瘙痒、皮肤过敏等情况造成的护理困难有关。有多项研究报道CRBSI 的发生与患者年龄、基础疾病、置管季节、置管位置、导管留置时间等多种因素相关[12-13]。一项纳入了3 项前瞻性研究的荟萃分析发现,PICC 与隧道式导管及PORT 相比CRBSI 发生率更低,但差异无统计学意义[14]。本研究经logistic回归分析发现带管日、置管类型是儿童血液肿瘤患者CRBSI 发生的独立危险因素。PORT 患儿CRBSI 发生率及反复发生率明显高于PICC 患儿,差异有统计学意义;急性髓系白血病患儿CRBSI发生率更高,可能与急性髓系白血病强化疗方案及持续长期严重粒细胞缺乏状态有关[15]。目前儿童CVC 的最佳保留时间尚不明确,本研究结果证实CRBSI 的发生与置管时间密切相关,置管时间越长,发生感染的风险越高,带管日达到356 d 对CRBSI 的发生有一定的预测意义。
目前CRBSI 导管微生物培养方案尚未达成共识,各中心实验室获取导管微生物手段存在差异,IDSA 推荐送检PORT 导管尖端外,同时送检储液槽可以提高病原学诊断的灵敏度和特异度[3]。本研究中所有送检导管尖端培养均呈阴性结果,结合临床分析考虑存在导管培养假阴性可能,此外假设:感染可能系导管穿刺时或者导管护理时皮肤定植菌进入穿刺口所致,与导管本身并无关联,或者取出导管时抗生素已成功清除导管内微生物。一项纳入了西班牙重症监护室384 例次CRBSI 的多中心临床研究也发现导管早期拔除组与保留组患者30 d 死亡率差异并无统计学意义[16]。美国肿瘤协会临床实践指南认为大多数血液肿瘤患者CRBSI 发生时可以首先采取保守治疗,通过全身性抗生素治疗及抗生素封闭导管达到完全康复的目的,但是当患儿出现难以控制的感染性发热、危及生命的脓毒血症等情况时仍建议尽早拔除CVC[17]。本研究中仅10 例患儿因CRBSI 发生提前拔除导管,所有CRBSI 患儿最终感染均得到控制并且长期生存。考虑到血液肿瘤患儿存在血管条件差、穿刺困难,血肿、血栓、神经损伤并发症风险高等情况,结合以上相关研究结果,在发生CRBSI 时应慎重考虑拔除CVC。
澳大利亚一项针对674 例血液透析患者CRBSI 的回顾性分析结果发现,55 例患者发生70例次CRBSI,病原菌主要为金黄色葡萄球菌(22 株,31.4%)、凝固酶阴性葡萄球菌(14 株,17.5%)和革兰阴性杆菌(28 株,35.0%)[18]。Vassallo 等[19]对法国戛纳内科中心肿瘤化疗患者研究也同样发现凝固酶阴性葡萄球菌是CRBSI 主要致病菌。而Ardura 等[20]一项纳入美国俄亥俄州儿童医院发生的159 例CRBSI 患者的回顾性研究则发现革兰阴性菌为最常见的病原。本研究中CRBSI 的主要病原菌为革兰阳性菌,表皮葡萄球菌占第一位,主要菌株对替考拉宁、利奈唑胺、万古霉素均敏感。革兰阴性菌中肺炎克雷伯菌和大肠埃希菌对碳青酶烯类药物总体敏感率仍较高,未检测到难治性耐药铜绿假单胞菌[21]。既往一些研究显示金黄色葡萄球菌是导致血流感染的常见革兰阳性菌,而本研究中却未检出金黄色葡萄球菌,此差异可能与不同地区患者免疫、疾病状态或医院感染有关。近年来对条件致病菌的认识不断加深,当依据临床症状怀疑CRBSI 且病原菌检出凝固酶阴性葡萄球菌时,可以通过静脉血与导管血报阳时间差距、导管培养定量等方式进行微生物确认,故凝固酶阴性葡萄球菌引起CRBSI 越来越受到重视。
综上分析,行CVC 儿童血液肿瘤患者发生CRBSI 的病原菌以革兰阳性菌多见,置管类别及带管日系独立危险因素,对置管患者应进行定期护理、尽量缩短导管留置时间,完成主要治疗后尽早拔管。

