超微量DNA模板扩增鉴定绵羊早期胚胎性别体系优化
陶维昆,黄 飞,刘 波,赵建清,方 翟,高庆华,3*
(1.新疆塔里木大学动物科学学院,新疆阿拉尔 843300;2.新疆塔里木大学生命科学学院,新疆阿拉尔 843300;3.新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300)
哺乳动物早期胚胎性别鉴定是实现性别控制的重要部分,运用这一手段可有选择性地确定动物后代性别,借助胚胎移植等技术,加快家畜繁殖和新品种选育进程,推动胚胎商品化和畜牧业的发展。(Sex Determining Region of the Y Chromosome)基因作为Y染色体上促进睾丸分化的主效基因,在人、猪、牛、马、羊等哺乳动物中意义特殊。Obuchi等、宋淑珍等在绵羊上血液淋巴细胞和肝脏组织上成功扩增基因进行了初步研究。吕文发等、张秀华等、马梦婷等、孙俊丽等相继在牛、山羊、绵羊和猪胚胎上运用基因进行性别鉴定并取得成效。白文林等利用基因鉴定8细胞牛胚胎性别并建立中国荷斯坦牛胚胎性别鉴定体系。SRY作为雄性单拷贝基因,具有高度保守的特性,联合内参基因(Glyceraldehyde-3-Phosphate Dehydrogenase)可以更简单直接有效地鉴定,可靠性更高,但超微量模板扩增基因鉴定胚胎性别仍存在扩增不稳定,易受干扰等问题。本实验通过完善优化超微量胚胎DNA鉴定绵羊胚胎性别方法体系,并借助测序技术对扩增产物测序比对,保证试验结果的可靠性和鉴定结果的准确性,以期提高检测结果的准确性与鉴定效率,建立稳定体系。
1 材料与方法
1.1 试剂和仪器 DL-700 DNA marker、琼脂糖均为TaKaRa公司产品;2×Ultra Taq PCR Mix DNA聚合酶、血液基因组DNA提取试剂盒为Transgen公司产品;超净工作台(SHC-CT-22,Boxun);体视显微镜(S9D,LEICA);低温高速冷冻离心机(3K30,Sigma);PCR仪(C1000 BIO,RAD);核酸测定仪(ND-One,Thermo);恒温水浴锅(HHS-21-4,上海博讯医疗生物仪器股份有限公司);恒温金属浴(MINI100-C,北京佳源科仪科技有限公司);稳压电泳仪(DYY-11,北京六一生物科技有限公司)。
1.2 实验材料 采集公羊和母羊各3只静脉血液,保存于抗凝管中带回实验室,提取血液基因组DNA。
绵羊胚胎来自于本实验室体外受精培养获得。卵巢采集自阿克苏屠宰场,37℃生理盐水中保存,3 h内运回实验室。显微镜下收集高质量卵母细胞,培养成熟,进行体外受精,早期胚胎培养(3个批次共160枚),挑选40枚桑椹期胚胎用于实验。
1.3 引物设计和合成 根据绵羊Y染色体性别决定区的基因723 bp序列和基因1284 bp序列(,GenBank accession No:Z30265.1;,GenBank accession No:NM_001190390.1),借助BLAST和PREMIER 5程序设计巢式引物(表1)。引物均由新贝(上海)生物科技有限公司合成。根据每管OD值加ddHO调节浓度,漩涡混匀,4℃冰箱放置2 h以上,使引物充分溶解。

表1 巢式引物序列
1.4 实验方法
1.4.1 绵羊血液DNA与胚胎基因组样品制备 核酸测定仪检测血液DNA浓度(公97.6 ng/μL,母103.5 ng/μL),按10、100、1 000、10 000倍梯度稀释,检测浓度(9.76、10.35 ng/μL),(0.976、1.03 ng/μL),(97.6、103 pg/μL),(9.76、10.3 pg/μL)用于试验。
体视显微镜下吸取单个桑椹胚,置于预先备好的双蒸无菌水中清洗2~3次。移入含20 μL 100℃双蒸无菌水(切割四分之一胚胎移入含8 μL 100℃双蒸无菌水,该管完成直接用于后续步骤试验)的0.2 mL EP管中待用,尽可能少带液体,控制在0.5 μL,进行后续步骤。液氮中冷冻20~30 min,金属浴煮沸10~15 min,置于冰上冷却,5 000 r/min离心3 min完成细胞DNA彻底释放,-20℃保存备用。
1.4.2 血液PCR反应体系、条件 以绵羊基因组DNA样品梯度稀释为模板,验证巢式内、外引物特异性,并优化扩增条件,反应体系如下。
PCR反应体系20 μL:DNA模板X μL(一轮1 μL,二轮3 μL),上、下游引物(10 μmol/L)各0.5 μL,2×Ultra Taq PCR Mix 10 μL,dd HO补 充 至20 μL。PCR反应扩增程序:95℃ 3 min预变性,94℃ 30 s变性,(一轮58℃,二轮62℃)20 s退火,72℃ 20 s延伸,(一轮25个,二轮35个)循环,72℃延伸5 min,4℃保存。PCR产物用2%琼脂糖凝胶在110 V条件下电泳20 min检测,染色后用凝胶成像仪拍照,记录结果。
1.4.3 单个胚胎超微量DNA梯度PCR反应体系条件绵羊单个胚胎基因组DNA样品为模板,验证内、外引物的特异性,优化扩增条件,反应体系如下。
PCR反应体系20 μL:DNA模板X μL(一轮2、1、0.8 μL,二轮3 μL),上、下游引物(10 μmol/L)各0.5 μL,2×Ultra Taq PCR Mix 10 μL,dd HO补充至20 μL。PCR反应扩增程序:95℃ 3 min预变性,94℃ 30 s变性,(一轮58℃,二轮62℃)20 s退火,72℃ 20 s延伸,(一轮30个,二轮35个)循环,72℃延伸5 min,4℃保存。PCR产物用2%琼脂糖凝胶在110 V条件下电泳20 min检测,染色后用凝胶成像仪拍照,记录结果。
1.4.4 桑椹胚超微量DNA巢式PCR反应体系条件 切取桑椹单个胚胎四分之一样品为模板,对巢式内、外引物的特异性进行验证,并优化扩增条件,反应体系如下。
PCR反应体系20 μL:DNA模板X μL(一轮模板量与dd HO共8 μL,该部分在胚胎切割制备样本时一步到位,二轮3 μL),上、下游引物(10 μmol/L)各0.5 μL,2×Ultra Taq PCR Mix 10 μL,dd HO补 充 至20 μL。PCR反应扩增程序:95℃ 3 min预变性,94℃30 s变性,(一轮58℃,二轮62℃)20 s退火,72℃20 s延伸,(一轮35个,二轮35个)循环,72℃延伸5 min,4℃保存。PCR产物用2%琼脂糖凝胶在110 V条件下电泳20 min检测,染色后用凝胶成像仪拍照,记录结果。
1.4.5 琼脂糖凝胶电泳分析 取5 μL PCR扩增产物与Loading Buffer混合,于2%的琼脂糖凝胶,电压110 V,电泳时间20 min,凝胶成像系统检测观察扩增结果。从上到下Marker(条带为700、600、500、400、300、200、100 bp)。出现363 bp基因产物和209 bp基因产物扩增条带为雄性胚胎,雌性胚胎无209 bp只有363 bp条带。
1.4.6 胚胎DNA PCR产物测序 胚胎巢式PCR扩增结果经琼脂糖电泳检测后,送往上海生工股份有限公司进行扩增产物测序。
2 结果与分析
2.1 血液基因组扩增结果 通过绵羊血液组织基因组DNA验证本实验设计的基因的巢式内、外引物,经过摸索确定两对引物的最优退火温度,获得特异性较好的扩增结果,其中,扩增片段大小与预期大小一致,内参引物扩增大小为363 bp,引物扩增大小为209 bp(图1)。
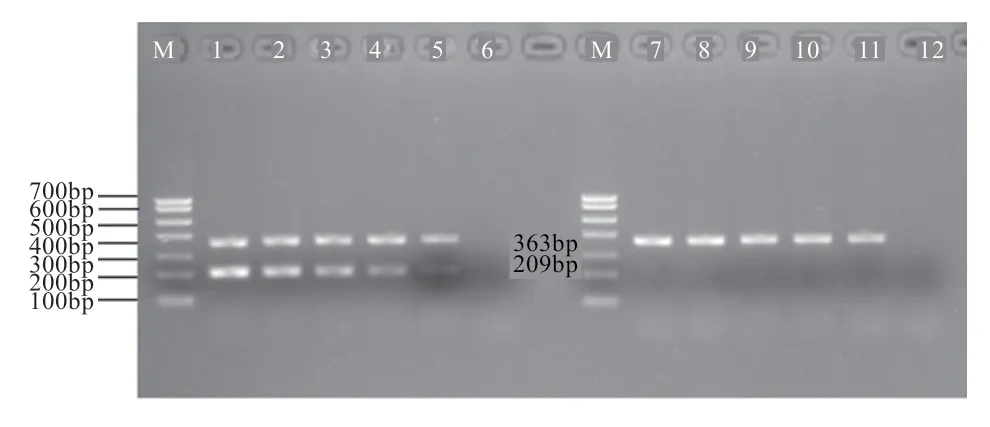
图1 绵羊血液DNA梯度稀释GAPDH、SRY基因扩增结果
2.2 绵羊桑椹胚超微量DNA梯度扩增结果 绵羊桑椹胚超微量DNA梯度扩增结果见图2,扩增片段大小与预期大小一致,内参引物扩增大小为363 bp,引物扩增大小为209 bp。

图2 绵羊胚胎超微量DNA梯度GAPDH、SRY基因扩增结果
2.3 绵羊桑椹胚超微量DNA扩增结果 对40枚胚胎样品通过胚胎切割进行巢式PCR扩增,雄性和雌性胚胎均扩增得到大小为363 bp内参引物片段,只有雄性胚胎扩增得到大小为209 bp引物片段(图3)。
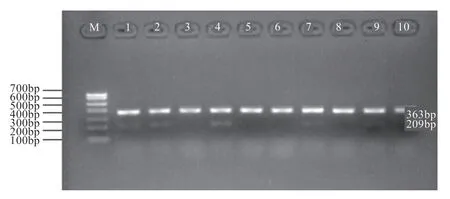
图3 绵羊胚胎GAPDH、SRY基因扩增部分结果
2.4 雄性胚胎PCR产物测序比对结果 挑选3枚雄性胚胎SRY产物进行测序,产物片段大小209 bp,一致性29.18%,于基因原序列位置一致,吻合率100%(图4)。
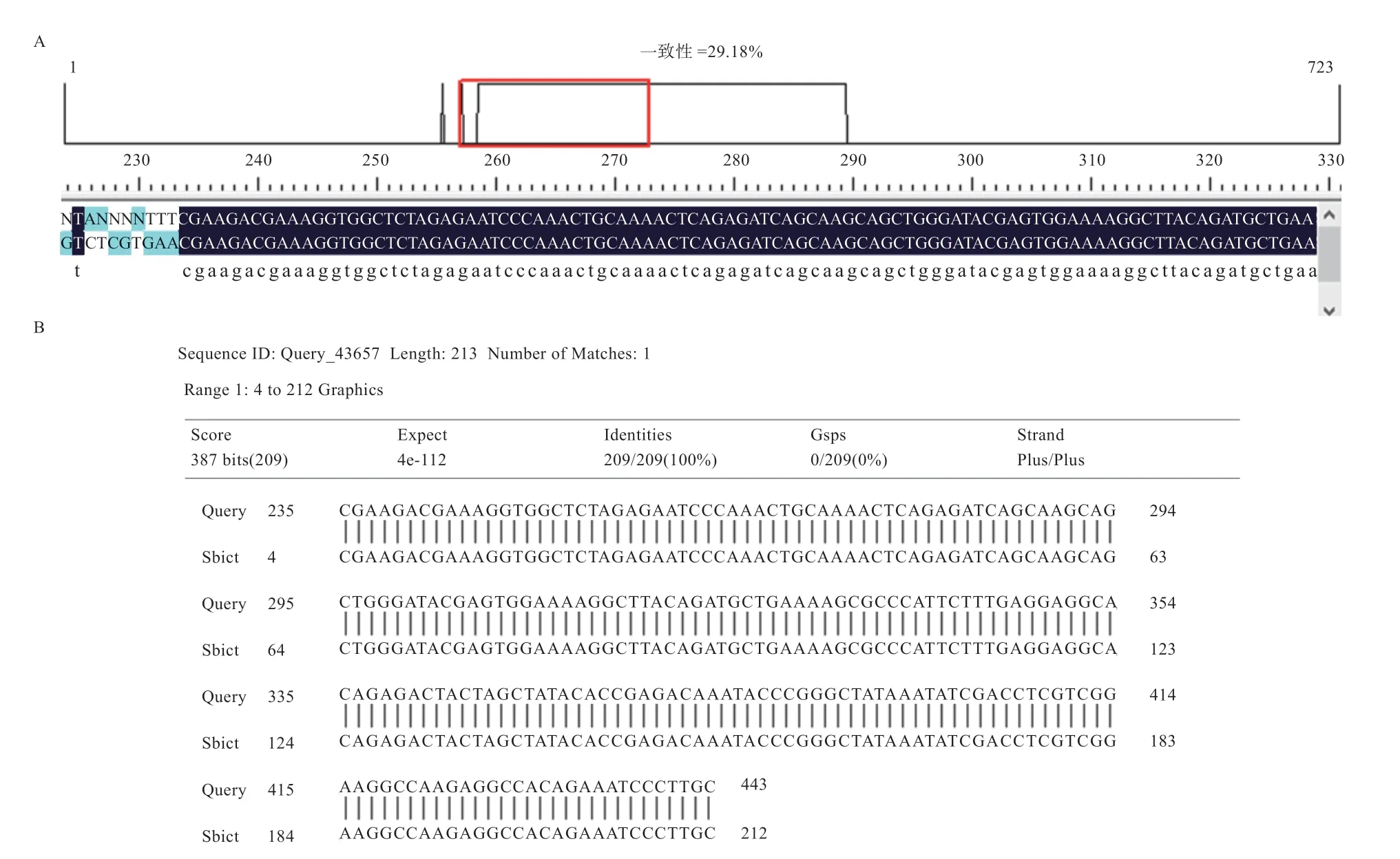
图4 胚胎PCR产物测序结果比对
3 讨 论
本实验以绵羊DNA为模板,进行基因引物PCR扩增,通过血液组DNA梯度稀释至3~4个细胞DNA当量(10 pg/μL),调整PCR体系条件,对PCR产物电泳检测,雄性胚胎扩增得到209 bp的基因特异性条带,雌性胚胎未出现该片段大小条带,雄性和雌性胚胎均扩增得到363 bp的内参基因条带,与试验预期结果一致。本实验进一步摸索在胚胎超微量DNA扩增所需反应体系、退火温度及反应循环数等条件要求,发现在20 μL体系,退火温度在62℃和64℃,30和35个循环下的鉴定结果理想可靠。对40枚绵羊胚胎进行超微量性别鉴定,扩增结果稳定可靠,雄性胚胎扩增得到(363 bp和209 bp)2条条带,雌性胚胎只有(363 bp)1条条带。与前人在囊胚期胚胎扩增基因的实验结果相比,本实验在上述条件下的结果稳定,效果良好,整个反应时间130 min内可完成,达到了优化的目的。
由于胚胎DNA模板量本身较少扩增易达到平台期,故使用样品中存在整套DNA,利用巢式PCR特异性、灵敏度,准确度高的特点,对基因经2轮PCR特异性扩增,该方法一方面增加模板量保证扩增效率,另一方面极大地降低非特异性片段错误扩增结果。此外,联合扩增基因可避免单个胚胎加样过程中胚胎丢失和雌性胚胎中不扩增或扩增失败而导致阴性结果的错误解释,保证试验过程和结果的准确。产物结果测序可进一步排除加样和点样过程中雌雄胚胎之间的扩增产物气溶胶交叉污染造成的假阳性结果,再一次验证鉴定结果准确性,同时也检验实验的稳定性和高度灵敏度。但对于2对引物PCR,2组引物间存在一定竞争性,在不影响引物特异性和灵敏度的同时降低引物间的相互影响,尽可能保证2组引物反应条件接近一致,这无疑增加了引物设计的要求和试验难度。
目前PCR是牛羊等家畜胚胎性别鉴定较为便捷快速的方法,但需要结合胚胎切割技术才能实现理想化状态,而胚胎切割会对胚胎造成一定程度损伤,从而影响受胎率,因此切割胚胎细胞数量越少对胚胎伤害越小,对移植的效果影响就越小。基于这点,Saberivand等、赵冰茹等通过妊娠母羊外周血细胞,扩增基因进行试验,检测得到仅在怀公羔的母羊上存在基因扩增产物。该方法虽能减少对胎儿的伤害,但不适合双胞胎妊娠检测,检测时间只能在胎儿与母体建立联系后,因此存在一定局限性,同时也提高了性别鉴定的要求。目前胚胎性别鉴定效果的检验主要还是进行胚胎移植,通过产仔验证鉴定效率和准确程度,这样所需时间周期较长,不利于胚胎的产品化生产,有待改善。因此尽可能提高检测灵敏度和稳定性,缩短鉴定时间,提高检测准确率及胚胎移植着床效率对检验鉴定效率等尤为重要。本实验借助胚胎切割技术对桑椹胚切割,获得超微量DNA模板进行检测,实验效果良好。目前家畜胚胎性别鉴定技术飞速发展,牛羊等反刍动物PCR性别鉴定体系不断优化,但由于技术和理论的限制,目前的性别鉴定方法相对比较单一。早期胚胎性别鉴定技术作为家畜胚胎移植技术的一项重要内容,与胚胎分割、胚胎冷冻等动物繁殖新技术结合可以显著提高优质家畜的繁育率和母犊率,加速繁育优良品种,提高经济效益,因此还有待进一步发展和改善。
4 结 论
本实验运用胚胎切割技术超微量DNA扩增基因,鉴定绵羊胚胎性别方法体系灵敏度可达到约10 pg(3~4个细胞),且该体系方法可稳定鉴定胚胎性别,效果良好。

