精浆外泌体的转运机制及生物学功能研究进展
秦佳丽,孙敬帅,曹婷婷,,李智丽,朱 琳,赵云翔,*
(1.佛山科学技术学院生命科学与工程学院,广东佛山 528000;2.广西扬翔股份有限公司,广西贵港 537000)
在睾丸形成的哺乳动物精子经过与周围液态微环境间的相互作用,发生形态和功能上的变化,最终发育为具备运动能力以及与卵细胞结合能力的成熟精子。雄性生殖道的液体环境中存在大量囊泡,这些囊泡对精子的发育和生理过程起到非常重要的调节作用,其中直径在30~100 nm的囊泡被称为外泌体(Exosomes,EXs)。EXs是由多种活细胞主动分泌至胞外的小囊泡,在哺乳动物的多种体液中广泛存在,其包含蛋白质、脂质、核酸等多种物质,可以介导物质运输并参与多种生物过程的调节,存在于精液中的EXs被称为精浆外泌体(Seminal Plasma Exosomes,spEXs)。spEXs将调节生育力的蛋白转运至精子表面,具有显著改善精子运动参数,抵抗精子损伤、影响精子受精过程的生物学功能。对于spEXs的研究有助于理解精子成熟和受精的生理过程,同时spEXs在提升精液品质、作为雄性生殖疾病与生殖性能标志物以及雄性生殖疾病的药物载体上具有良好的应用前景,但有关spEXs作用机制方面的研究还十分匮乏,因此本文围绕spEXs的转运机制以及对哺乳动物精子的调控作用展开阐述,旨在为spEXs在精子发育中的研究提供一定参考。
1 spEXs的发现和来源
1.1 EXs的发现 1983年,EXs首次发现于绵羊网织红细胞中。Johnstone等于1987年将这种通过细胞上清液超高速离心后得到的膜性小囊泡命名为EXs。随后人们在多个物种的不同细胞和体液中相继发现EXs。因为当时缺乏更为深入的了解,人们一度将EXs视为细胞代谢的废物。直到1996年,有报道称来源于人和小鼠B淋巴细胞的EXs内包含组织相容性复合体(Major Histocompatibility Complex,MHC)II类分子,可以通过呈递抗原诱导T细胞产生反应,从此EXs得到了更多关注和深入研究。Valadi等研究发现,肥大细胞产生的EXs可以将mRNA转移到其他肥大细胞并被翻译成蛋白质,他们将这种RNA称为EXs穿梭RNA。这意味着EXs可以通过传递多种信号分子调控生物表达和功能,随着EXs纯化分离技术的不断成熟和规范,EXs的相关研究开始呈爆发式增长。
首次发现spEXs是在人类的前列腺液中,因此这些由多层膜包被的小囊泡被称为前列腺小体,之后陆续在大鼠、公羊、公牛和公猪多个物种的附睾液或精液中也分离出类似的膜状囊泡。spEXs以高含量的胆固醇和鞘磷脂为特征,在传统电镜下观察为茶托状多层脂质小囊泡(图1),EXs中富含膜蛋白家族中的四次跨膜蛋白(如CD9、CD63、CD81),这些跨膜蛋白可以作为标志物协助识别EXs的细胞起源、细胞内含物质以及作用的靶细胞。
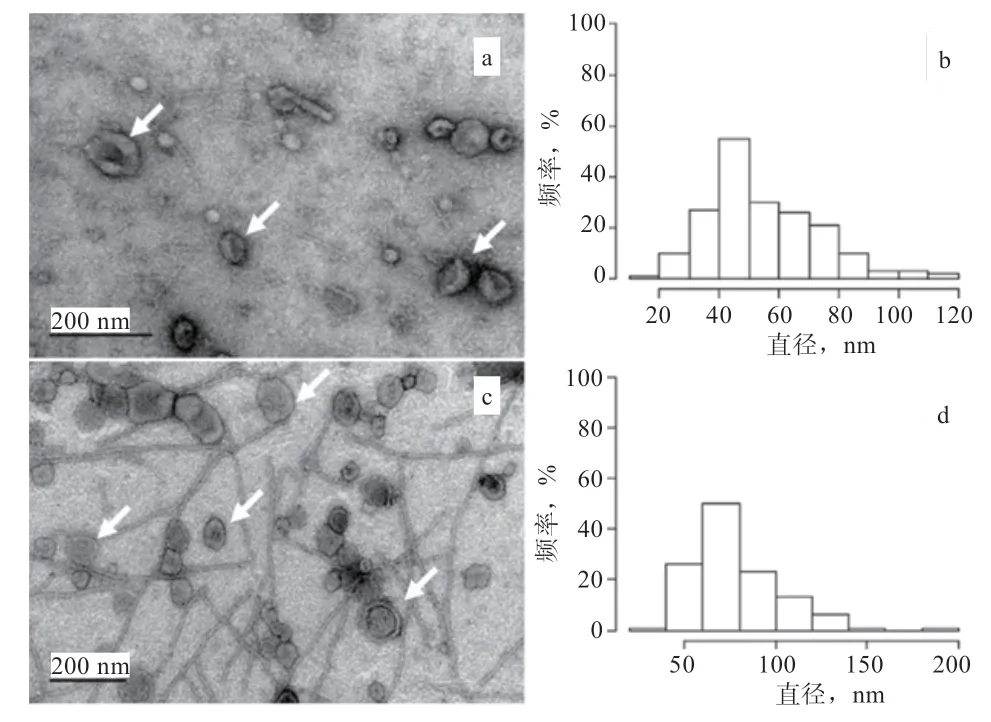
图1 电镜下spEXs及其粒径分布图[7]
1.2 不同来源的spEXs spEXs来源于睾丸、附睾、前列腺及其他副性腺生殖道分泌液。由于大多数睾丸液在随精子进入附睾时被附睾头部所吸收,未吸收睾丸液仅占精浆的2%~3%,而其他副性腺分泌液占精浆比例约1%,所以射出精液的EXs主要源于附睾液和前列腺液,根据来源分别称为附睾小体与前列腺小体(图2)。

图2 雄性生殖道中附睾小体和前列腺小体[17]
由于进入附睾后转录停止,精子在发育过程中高度依赖作为其周围环境的雄性生殖道分泌液,附睾小体内装载的分子物质可以与精子表面发生相互作用并完善精子的形态和功能,在精子成熟过程中起到不可或缺的作用。从解剖学角度可以将附睾分为起始段、头部、体部和尾部,各节段在功能上都表现出高度区域化、功能化的特征。研究表明附睾小体蛋白质和miRNA在附睾各段的表达水平呈现出明显的节段特异性,这一特征与附睾不同节段功能区域化的特征相吻合,揭示附睾小体与附睾功能间的紧密联系。
前列腺小体中的蛋白质主要以酶类和转运蛋白为主,相比于附睾小体,脂质中含有更高的胆固醇/磷脂比例。前列腺小体被证明与抗菌、免疫调节、精子获能、精子活力以及抗氧化保护等有关。此外,不同生理状态的前列腺小体呈现异质性,前列腺小体miRNA在作为前列腺相关疾病的生物标志物上已取得一定的研究成果。
2 spEXs的分泌、转运机制
2.1 形成与分泌 EXs的形成是细胞质膜连续内陷形成多囊体,最终向胞外释放出腔内小囊泡的过程,在这一过程中,蛋白质、核酸、脂质等物质被特定地富集并装载进EXs,最终被运送至靶细胞。这种由膜性小泡包裹的转运方式可以很大程度上保护转运物质不受外界复杂微环境的影响。
spEXs在不同节段的分泌方式不同。附睾上皮细胞以顶分泌的方式释放附睾小体,这种分泌方式是通过顶端小泡的破裂将作为内容物的EXs释放进附睾腔内,整个过程不涉及内质网和高尔基体的参与,与通过胞吐形成的分泌囊泡也有一定区别。前列腺小体则在形成后储存于前列腺的储存囊中,通过腺泡上皮细胞以胞吐的方式向胞外分泌。
2.2 转运机制 由于前列腺小体的膜特性,精子可以通过胞吞方式摄取前列腺小体的内含物。附睾小体介导的蛋白质转运机制也取得了一定的研究成果,一些缺乏末端信号肽结构的附睾蛋白可以通过糖基磷脂酰肌醇(Glycosylphosphatidylinositol,GPI)锚点与精子结合。GPI是一种与许多膜蛋白共价连接的磷脂,为蛋白质提供一种附着到脂质双层外层上的方式。许多来源于雄性生殖道上皮细胞且含有GPI锚定位点的蛋白被锚定在精子表面,例如小鼠的精子黏附蛋白1(Sperm Adhesion Molecule 1,SPAM1)和透明质酸酶、仓鼠的P26h蛋白及公牛体内同源基因的P25b蛋白等,而这些蛋白质均被报道与精卵识别或是精卵互作相关。
转运“货物”的接受区域主要位于顶体后部,再者是顶体,而在鞭毛区域几乎没有检测到转运的痕迹,这一结论在Zhou等的研究中得到佐证,其进一步发现这可能是由于附睾小体对蛋白质的转运分为2个连续的阶段:即前期蛋白质在顶体后部的积累以及后期蛋白质向顶体以及鞭毛中段区域的分散,其中前期涉及到的囊泡融合可能对于后期的分散会产生一定影响(图3)。
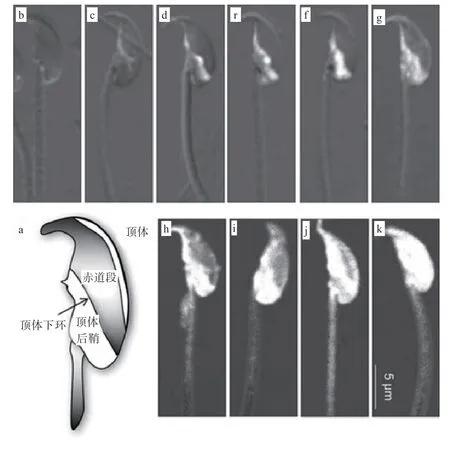
图3 附睾小体-精子的蛋白转运模式[21]
动力蛋白一族在精子顶体摄取“货物”过程中起重要的介导作用。当精子与附睾小体共培养时,动力蛋白1在顶体周围和顶体后区域之间发生明显的重新定位,这种重新定位可能是通过动力蛋白1与膜筏结合实现的,目的是定位膜上的酶从而更好地促进精子摄取附睾小体中的蛋白质。
转运过程通常还具备以下2个特点:第1个特点是靶向选择性。Andrea等研究发现,从附睾头部收集的附睾小体与附睾头部收集的精子共孵育时的转运效率远大于与附睾尾部收集精子的转运效率。这说明在雄性生殖道中的转运是有选择性、目的性地转运,其中可能受到一些信号分子的调节与控制。第2个特点为转运依赖一定的环境条件。研究表明,37℃的环境条件相比于22℃具有更高的转运效率,同时这个过程也依赖pH,pH为6.0~6.5的微酸性环境的转运效率比pH 7.5时高出2.5倍;锌离子浓度亦能影响蛋白质的转运,当其浓度控制在0.1~1.5mmol/L的范围内有利于转运的进行。考虑到在正常生理状态下附睾液的pH为6.5以及附睾组织中含有高浓度的锌,转运的体外最佳条件与生理环境间具有很大的近似性和相关性。
虽然关于spEXs的转运已取得较为丰富的研究成果,但关于特定物质在EXs中的富集以及EXs的靶向结合是受何种物质调控依旧不清晰,除蛋白质外其他物质的转运机制也需要进行深入研究。
3 spEXs的生物学功能
spEXs在精子发育过程中可以发挥多种生物学功能(表1),从而对精子不同阶段的生理状态和生理过程进行精细调控。
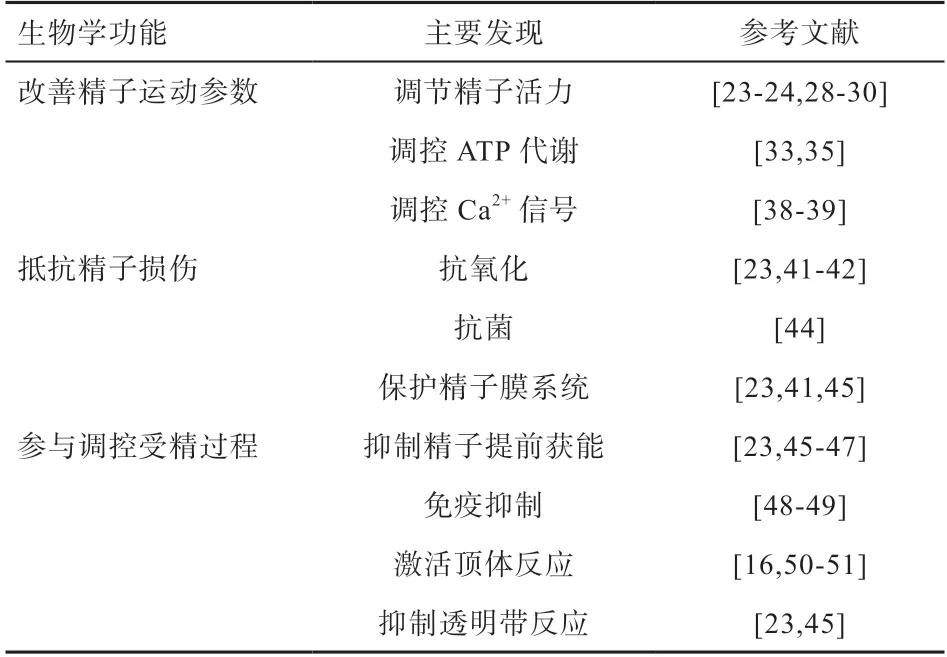
表1 spEXs的生物学功能
3.1 改善精子运动参数 雄性不育的大部分原因是精子质量不佳,精子运动参数是衡量精子质量的重要指标。精子活力是精子运动能力的宏观体现。Du等研究发现在精子培养液中添加4倍和16倍的spEXs可有效提高精子活力并延长精子活力保持时间,结合EXs转运机制的特点,spEXs可能是通过富集周围环境以及EXs自身包含的活力调节分子转运至精子中,从而影响精子活力。弱精子症是一种以精子活力低下为主要特征的男性生殖疾病,是导致男性不育的重要原因之一。弱精子症患者的spEXs与正常精液间存在显著差异,如Abu-Halima等对正常男性和弱精子症男性spEXs miRNA进行测序分析,结果显示在弱精子患者的spEXs中,miR-765和miR-1275的表达水平显著升高,miR-15a的表达水平则显著降低,这3种miRNA分别在不育、精索静脉曲张以及生精困难的研究中被报道过。弱精子症与正常spEXs的蛋白质组也呈现表达差异,林瑜通过测序发现TRPV6、ACE、PRSS8和PPAP2A等蛋白在弱精子症患者spEXs中显著下调,其中TRPV6可以从附睾小体转移至精子并被定位至精子顶体以及颈部区域。Murdica等对比正常男性与弱精子症患者spEXs蛋白质组,发现来自正常男性的spEXs比弱精子症男性具有更高的半胱氨酸丰富分泌蛋白1(Cysteine Rich Secretory Protein 1,CRISP 1)表达水平,随后其通过Western Blot验证了spEXs介导CRISP 1蛋白向精子的转移。基因敲除小鼠在附睾上皮分化和管腔酸化方面都显示出明显的缺陷,上皮细胞的缺陷会导致精子活力下降,而管腔酸化则是精子成熟和储存的关键。将正常男性的spEXs添加至弱精子症患者的spEXs中,精子在体外依旧可以接受EXs的转运并且显著提高了活力低下精子的活力,这一发现为弱精子症的治疗提供了新的思路。
高运动力的精子依赖于足够的ATP才能维持运动状态,精子中的ATP主要通过线粒体呼吸链以及糖酵解2种代谢方式提供。人、犬、马、牛4个物种的前列腺小体都可以表达糖酵解酶并生成依赖于ATP酶活性控制的细胞外ATP。胞外ATP则被证明可以刺激精子的超活化、提高超活化精子比例及体外受精的受精率。Guo等实验证明猪spEXs产生的细胞外ATP不仅显著提高了精子活力,还降低了细胞凋亡率,精子线粒体膜电位也显著提高;同时该研究还证明胞外ATP可以促进精子内部线粒体对于乳酸的利用,进一步提高胞内ATP浓度,降低了ADP/ATP比值。这说明spEXs产生的胞外ATP可以通过调节线粒体代谢以控制精子活力。
Ca内流对维持精子活力、顶体反应以及精子超活化至关重要。能够调节Ca内流的精子阳离子通道(CatSper)是精子中唯一表达的阳离子通道蛋白家族,缺乏CatSper的雄性小鼠和基因突变的男性由于缺少精子的过度激活而表现出不育。CatSper通道需要被孕酮等生理物质激活,有报道显示前列腺小体能够提供CatSper通道激活所需的Ca信号传导工具,在钙信号的调节中发挥至关重要的作用。将精液中的前列腺小体分离出来后,孕酮诱导CatSper通道激活的钙信号被严重破坏,这是因为由前列腺小体转运至精子的蛋白质在CatSper通道激活过程中扮演了重要角色。
3.2 抵抗精子损伤 精子在体外常因为外界环境刺激发生损伤,过量的活性氧(Reactive Oxygen Species,ROS)会介导氧化反应引起精子氧化应激,造成脂质过氧化,DNA片段化等损伤,最终影响精子的形态和功能。前列腺小体可以抑制ROS产生,Kumar等向公牛新鲜以及冻融精液中添加1 mg/mL的前列腺小体,ROS含量显著减少。研究发现采用不同倍数的spEXs对公猪精子进行处理均可以显著减缓精子发生氧化应激的趋势,提高精子的总抗氧化活性,这是因为前列腺小体可以通过将脂质转运至细胞质膜来抑制中性粒细胞的还原型辅酶II(Nicotinamide Adenine Dinucleotide Phosphate,NADPH)氧化酶活性,从而抑制ROS产生。同时,这可能与spEXs中高含量的胆固醇有关,spEXs与精子发生胆固醇交换,从而改变精子质膜胆固醇/磷脂比率,提高精子质膜稳定性,减少精子质膜的脂质过氧化。
细菌也可以对精子造成不同程度的损伤,这些负面效应主要通过细菌分泌的毒素、代谢物或直接附着在精子发生作用,严重者甚至导致不育。前列腺小体(1 mg/mL)与巨大芽孢杆菌在37℃条件下共培养后,巨大芽孢杆菌的生长被前列腺小体完全抑制。这归功于前列腺体中大量的嗜铬粒素能够通过细菌壁和膜形成通道,发挥抗菌作用。此外,前列腺小体还能够引起细菌的膜变形,导致细菌丢失生存的必须条件而死亡。
精子的膜系统可以维持精子的基本形态结构,保护精子中的物质不受外界环境的干扰,质膜和顶体膜受损会直接影响精子活力与存活。spEXs对精子质膜具有保护作用,体外添加前列腺小体可显著改善公牛的新鲜和冻融精液的顶体膜完整性,公猪精子质膜可通过添加spEXs得到改善,质膜有序性显著下降,有效延长了精子的保存时间。
3.3 参与调控受精过程 精子获能是受精的前提条件,这是一个伴随着胆固醇流失、蛋白质磷酸化、精子膜流动性增加以及Ca信号传递的复杂生理过程。前列腺小体被证明在获能过程中对蛋白质酪氨酸磷酸化有抑制作用并显著降低了精子的获能水平。spEXs则可以通过抑制蛋白质磷酸化、胆固醇外流以及膜流动性等多种方式抑制精子提前获能,Piehl等的spEXs体外添加实验证实了这一观点,该实验结果显示EXs阻止了14 ku的蛋白质的磷酸化,从而抑制其获能后的表达,还发现EXs同时抑制了获能过程中的胆固醇流失和膜流动性的增加。Du等对公猪精子进行spEXs处理后通过检测Ca浓度判断精子的获能情况,结果显示获能精子的占比在EXs作用下显著下降并呈现剂量依赖性。避免提前获能更有利于保存精子实力,使精子在到达受精位置前避免不必要的能量消耗,这些研究提示spEXs或许在精子长期保存中可以发挥作用。
当精子在雌性生殖道中迁移时,精子的抗原性会使其受到机体免疫系统的攻击。前列腺小体具有免疫抑制能力,Tarazona等研究发现前列腺体小体中高水平表达CD244受体的配体CD48,自然杀伤细胞(Natural Killer Cell)与前列腺小体的相互作用导致CD244表达降低,并抑制自然杀伤细胞激活。此外,前列腺小体可干扰补体系统,前列腺小体膜成分中表达的CD9、CD46、CD55、CD59和CD63可以抑制雌性生殖道中的膜攻击复合物(Membrane Attack Complex,MAC)的攻击,保护精子免受雌性生殖道的补体攻击,从而使更多的精子通过雌性生殖道,更好地完成受精。
顶体反应和透明带反应是精卵结合中发生的重要生理过程。研究发现在人和猪中前列腺小体与雌雄配子共孵育可以刺激顶体反应的发生,这一过程是通过调动雌性生殖道中的孕酮来实现的,前列腺可以向精子供给孕激素受体,增加精子对孕酮的敏感性。在雌雄配子共孵育获能期以及透明带反应时加入spEXs可以显著抑制透明带反应的发生。spEXs是通过抑制精子获能去势因子的表达(如透明带结合蛋白AWN)来抑制透明带反应发生。
4 结 语
spEXs以独特的分泌转运机制将分子物质运送至精子中,补充精子发育所需的大分子物质并调节多种信号通路,从而调节精子运动参数、协助抵抗精子损伤以及影响精子获能与精卵结合的过程。近年来,有关于spEXs的研究主要集中以下3个方向:①利用高通量测序技术探究不同样品在蛋白质组、RNA组的差异表达分子;②探究spEXs在生殖过程中发挥的生物学功能;③spEXs分离提取及表征方法的优化。对spEXs的认知目前还处于比较浅显的阶段,接下来需要把得到的差异分子与具体的生物学功能联系在一起,丰富spEXs发挥调控作用的具体分子机制,这将有助于更深入地理解精子成熟过程中各种生理变化,找到影响生殖力的关键因素。随着spEXs提取方法的不断优化和提取成本的降低,spEXs的研究进程会进一步加快,spEXs有望在改善雄性不育、提升精液质量、延长精液保存上带来巨大的经济价值。

