NF-κB、villin蛋白的表达与胃癌临床病理特征及患者预后的相关性
张海梅 张嘉刚 易敏 杨世荣 马苑宁
(青海省第五人民医院,青海 西宁 810000)
胃癌(gastric cancer,GC)是全球癌症相关死亡的主要原因之一。综合治疗策略大大提高了患者的治疗效果,但大多数胃癌患者的预后仍然较差[1]。相关研究[2]发现,恶性肿瘤大多由于长期炎症发展形成,Gagliani等人提出“炎症—肿瘤”假说,并作出相关研究。绒毛(villin)蛋白是一种钙调节的肌动蛋白结合蛋白,在正常成人组织中,在小肠黏膜,肾近端小管,肝内胆管,胰管,胆囊上皮等的上皮细胞中观察到绒毛蛋白的表达。实验[3]证明,绒毛蛋白被认为是最重要的肠道分化之一标记。本课题主要研究NF-κB、villin蛋白的表达与胃癌临床病理特征及患者预后的相关性。
1 材料与方法
1.1临床材料 从我院收集2015年1月至2018年12月接受胃癌根治性切除术患者的胃癌组织36例,及邻近正常癌旁组织36例(对应胃癌患者的正常组织)。同时选36例健康者为对照组进行社会学人口特征的对比,见表1。TNM分期根据美国癌症联合委员(AJCC)第8版分期系统进行分类[4],所有数据进行匿名分析,研究经我院伦理委员会批准,患者均知情同意。

表1 社会学人口特征比较
1.2主要试剂 兔抗人NF-κB单克隆抗体,购于美国Abcam公司;鼠抗人villin单克隆抗体,购于上海研生生化试剂有限公司;免疫组化试剂盒,购于上海研生生化试剂有限公司。无水乙醇、二甲苯、DAB染色液、苏木素复染液、PBS缓冲液、中性树胶等。
1.3方法
1.3.1免疫组织化学法 将石蜡包埋组织切片用于实验研究。组织切片放入二甲苯Ⅰ、Ⅱ、Ⅲ中进行脱蜡,之后放入无水乙醇、90%、80%、70%的酒精中进行水化,冲洗净后放入PBS缓冲液中浸洗3次,5 min/次,擦干后每片样品滴加200 μL的一抗,4℃冰箱孵育过夜。取出后37℃恒温复温,PBS缓冲液洗净,擦干后每片样品滴加200 μL的二抗Envisioon,37℃恒温孵育30 min,结束后,用PBS缓冲液洗净擦干,将新配的DAB溶液对样品进行染色,显色后洗净,再用苏木素复染液染色样品2 min,清水洗净再用过酸酒精酸化,放入清水中反蓝,样品依次放入70、80、90和无水乙醇中,各放置5 min,再放于二甲苯Ⅰ、Ⅱ中各5 min,37℃恒温箱中烘干,采用中性树胶封片。
1.3.2Western blotting检测 使用RIPA缓冲液(Solarbio,R0010,Shanghai,China)和抑制剂混合物(Sigma,P8340-5ML,St.Louis,MO,USA)提取细胞和组织的总蛋白质并测定通过BCA蛋白质测定法测定蛋白质浓度(SBJ-1001; Beyotime,SENBEIJIA Bio,NanJing,China)。加入上样缓冲液以调节浓度。变性后,向每个样品孔中加入20 μg。使用12%SDS /PAGE分离蛋白质样品,然后在电泳和跨膜后用PVDF膜转移相应的蛋白质,用脱脂乳密封2 h。将膜与抗β-actin(2146,1∶1000; Danvers,MA)一起孵育初级抗体。β-actin用作上样对照。使用ECL化学发光着色剂(Haigene,M2301,Harbin,China)使条带可视化。
1.4患者随访 对所有患者手术后进行上门或者电话随访,时间间隔为:每两个月随访1次。对患者的术后主要症状、身体检查、CT、PET-CT、及实验室常规化验检查进行了解和统计。此次试验将随访截止时间设定至2019年8月,无失访患者,随访率为100%。

2 结 果
2.1胃癌患者的临床病理参数 胃癌患者的临床病理参数见表2。

表2 胃癌患者的临床病理参数
2.2免疫组化表达情况 NF-κB、villin蛋白表达在组织中染为棕褐色,NF-κB在胃癌组织中的表达显著高于癌旁组织(P<0.05);villin蛋白在胃癌组织中的表达显著高于癌旁组织(P<0.05)。见图1。

图1 NF-κB、villin蛋白表达的比较
2.3Western blotting表达 NF-κB在胃癌组织中的表达显著高于癌旁组织(P<0.05); villin蛋白在胃癌组织中的表达显著高于癌旁组织(P<0.05)。见图2。

图2 WB检测NF-κB、villin蛋白表达的比较
2.4NF-κB、villin蛋白的表达与临床病理的关系 结果显示,NF-κB在胃癌组织上的表达与性别、年龄、WHO分型无关;与浸润深度、有无肿瘤转移、临床病理分期相关。随着浸润深度逐渐加深,从T1-T4,NF-κB表达从0%增加至20.0%、50.0%,与临床病理呈正相关;肿瘤存在远处转移的NF-κB表达(3/4,75.0%)比未转移(16/32,50.0%)逐渐升高,与临床病理呈正相关;临床分期从Ⅰ-Ⅳ逐渐升高,NF-κB的表达从14.3%、25.0%、30.8%、50.0%逐渐增加,与临床病理呈正相关。villin蛋白的表达与性别、年龄、WHO分型、浸润深度(P=0.38)、远处转移、临床分期无关。见表3。
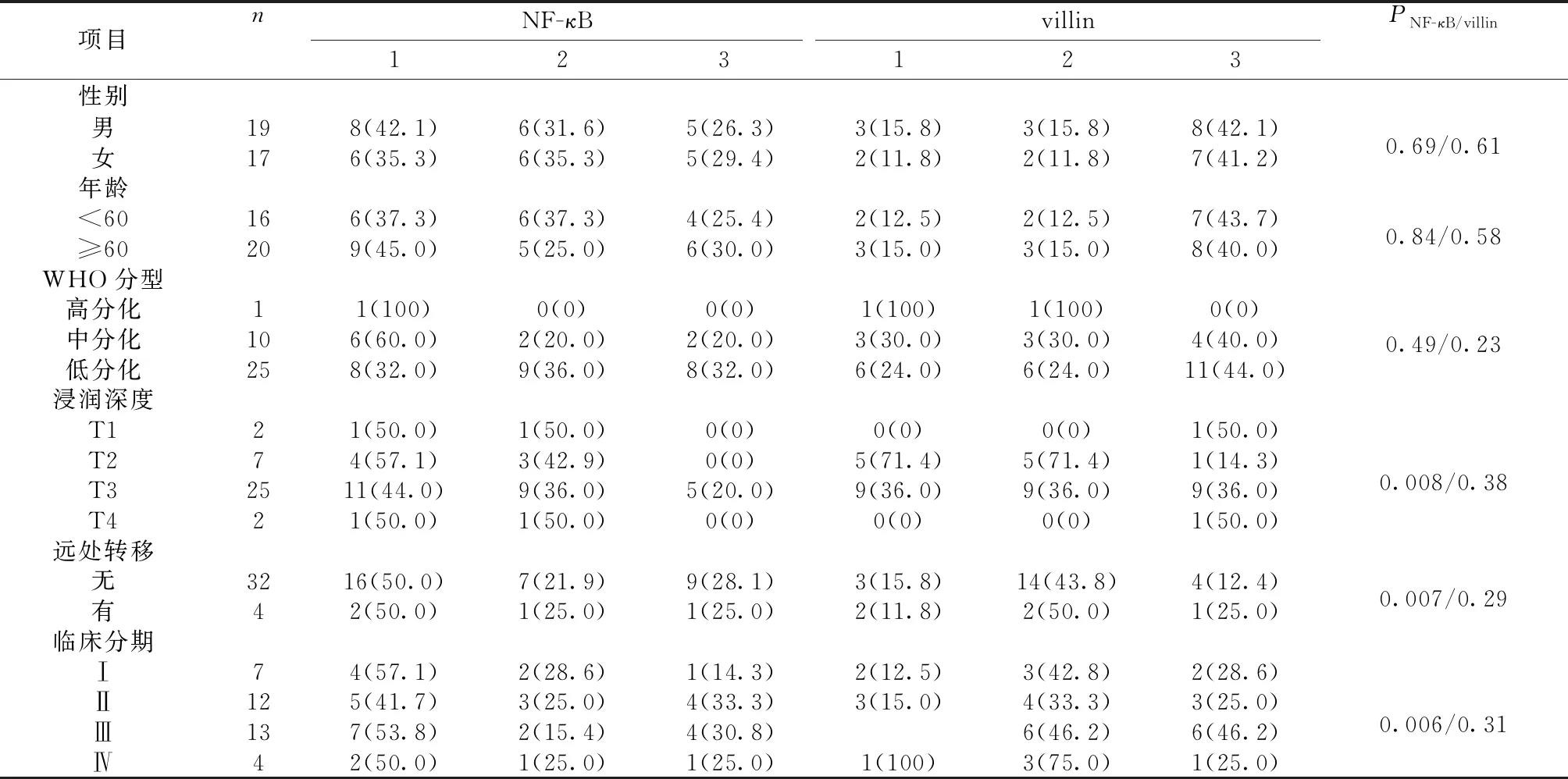
表3 胃癌组织中NF-κB、villin蛋白的表达与临床病理的关系
2.5胃癌组织中NF-κB、villin蛋白的表达与患者预后的关系 Kaplan-Meier 生存曲线显示,NF-κB阴性和弱阳性(-/1+)表达存活时间最长,阳性表达(2+)存活时间其次,强阳性表达(3+)存活时间最短,随着NF-κB表达的阳性率增加,生存曲线越低,患者存活时间越短,表明NF-κB表达越高,患者预后情况越差。Villin蛋白的阴性和弱阳性(-/1+)表达存活时间最长,阳性表达(2+)存活时间其次,强阳性表达(3+)存活时间最短,随着NF-κB表达的阳性率增加,生存曲线越低,患者存活时间越短,表明villin蛋白表达越高,患者预后情况越差。

图3 NF-κB、villin蛋白的表达与患者预后的比较
2.6相关性分析 单因素分析发现,N分期、NF-κB和villin蛋白的表达水平可能是患者预后不良的危险因素;多因素分析发现,N分期、NF-κB和villin蛋白的表达水平也是患者预后不良的独立危险因素。见表4。

表4 胃癌患者预后危险因素的的单因素及多因素分析
3 讨 论
胃癌是全球死亡的三大原因之一,约占人类消化系统癌症死亡总数的12%。在我国胃癌严重影响患者的生活质量,具有较高的发病率和死亡率。胃癌主要由幽门螺杆菌感染引起[5],其他胃癌病例中的原因被认为是遗传和地理因素。胃癌可以转移到身体的其他部位,包括肝脏,骨骼和淋巴结在内,这使得诊断为晚期肿瘤的患者难以治愈,且总体生存率低。
Villin蛋白是一种钙调节的肌动蛋白结合蛋白,可调节肌动蛋白丝的结构和组装。这与上皮细胞的微绒毛和末端网中的肌动蛋白细丝有关,它的表达倾向于与分化的极化细胞的发育相关,这些细胞包含刷状边缘和微绒毛内含物,并且可以由长期酸暴露诱导作为肠细胞的末端分化标记,Villin需要有足够的数量才能产生成熟的刷状边缘[6]。在正常成人组织中,在小大肠黏膜、肾近端小管、肝内胆管、胰管及胆囊上皮等的上皮细胞中观察到绒毛蛋白的表达[7]。有相关研究[8]报道了绒毛蛋白在肠腺的增殖干细胞中表达,就其病理学方面,在食管和慢性萎缩性胃炎中观察到的肠上皮化生中诱导绒毛蛋白表达。 此外,还经常发现绒毛蛋白在人类腺癌中表达,尤其是肠源性腺癌。绒毛蛋白被认为是最重要的肠道分化之一标记[9]。本实验结果显示,villin蛋白在癌组织中的阳性表达率和蛋白表达显著高于癌旁组织,但表达与性别、年龄、WHO分型、浸润深度、远处转移、临床分期无关;生存曲线表示,villin蛋白表达的高低对患者预后情况有重要意义。
核因子-κB (NF-κB)是各种炎症反应中的关键转录因子,是疾病中炎性细胞产生的因子,例如痛风性关节炎[10]。NF-κB最常见的形式是异二聚体p65/p50,作为与IκBα的复合物存在于胞质溶胶中以保持为无活性状态[11]。炎性刺激可以触发IκB激酶(IKK)复合物的激活,反之激活的IKK诱导IκB磷酸化,然后泛素化并且随后发生蛋白酶体介导的降解,IκB降解促进磷酸化p65的释放和核转位[12-13]。在细胞核中,p65与多种炎症基因的启动子区域结合,用于转录调控[14]。本实验结果显示,NF-κB在癌组织中的阳性表达率和蛋白表达显著高于癌旁组织,NF-κB在胃癌组织上的表达与性别、年龄、WHO分型无关;与浸润深度、有无肿瘤转移、临床病理分期相关。随着浸润深度逐渐加深,从T1-T4,NF-κB表达从0%增加至20.0%、50.0%,肿瘤存在远处转移的NF-κB表达(3/4,75.0%)比未转移(16/32,50.0%)逐渐升高,临床分期从Ⅰ-Ⅳ逐渐升高,NF-κB的表达从14.3%、25.0%、30.8%、50.0%逐渐增加,表明NF-κB表达与临床病理相关指标呈正相关。生存分析结果显示:NF-κB表达的高低对患者预后情况有重要意义。
综上所述,NF-κB、villin蛋白的表达参与胃癌的发生发展过程,NF-κB的表达与临床分期(Ⅰ、Ⅱ、Ⅲ、Ⅳ)、肿瘤浸润深度及其有无转移有关,NF-κB、villin蛋白的高表达也表明了患者预后情况不良。

