辽宁地区沙门菌整合子与耐药相关性研究
张铭琰 耿英芝 于淼 张眉眉
(辽宁省疾病预防控制中心,沈阳 110005)
沙门菌是公共卫生学中具有重要研究意义的肠道细菌,一直是国家食品安全重点监测的目标菌之一。近年来,随着抗菌药物的大量使用,沙门菌的耐药率问题日益严重,国家虽出台《遏制细菌耐药国家行动计划(2016—2020)》等一系列措施,但沙门菌的耐药程度仍远远高于副溶血性弧菌、蜡样芽胞杆菌等其他食源性致病菌,给因沙门菌感染引起的疾病治疗带来挑战。整合子是由1989年被Stock等[1]发现的一类可移动元件,是人类发现的继质粒、转座子之后的另一种可以使耐药基因水平传播的机制。整合子中含有3个主要结构,5’端酪氨酸整合酶,可以捕获外源耐药基因盒并使其整合到整合子上;中间可变区,可以携带一个或多个耐药基因盒;3’端保守区。整合子定位于染色体上,可以使携带的耐药基因稳定遗传,使细菌耐药性垂直传播;整合子若定位于质粒、转座子上,可以使耐药基因跨种属,使细菌耐药性水平传播[2]。整合子共分6类,以I、II、III类整合子研究居多[3]。鉴于整合子具有随机捕获外源性耐药基因的特点,能够使细菌耐药基因的水平传播,导致细菌耐药性升高,对药物敏感率下降,从而成为研究耐药相关性的重要依据。本研究通过对来源于食品以及病患的149株沙门菌进行整合子类别筛选和基因测序,分析来自食品与腹泻患者体内的沙门菌整合子及其基因盒的分布情况,探究耐药性与整合子之间的相关性。
1 材料与方法
1.1 仪器与试剂
缓冲蛋白胨水BPW(BD);四硫磺酸钠黄绿増菌液TTB(北京陆桥);亚硒酸盐胱氨酸SC(北京陆桥);沙门菌属显色培养基(科玛嘉);SBG増菌液(青岛海博);阳离子调节肉汤-CAMHB(Thermo);2×PCR preMix(Promega);Gel-Red(Promega);全自动生化鉴定仪VITEK 2(Bio-Merieux);药敏96孔板(Thermo);PCR仪(Bio-RAD);全自动凝胶成像仪(Bio-RAD)。
1.2 实验方法
1.2.1 分离培养
菌种分别来自食品和腹泻患者粪便。食品分离培养方法参照食品中沙门菌的分离鉴定方法GB/T 4789.4-2016;腹泻患者样本分离方法:挑取一定量样本接种于SBG増菌液,36℃培养24 h后接种于沙门显色培养基,可疑菌落进行生化鉴定。
1.2.2 整合子分型
煮沸法提取沙门菌基因组与质粒DNA。根据参考文献[4-5],设计I、II、III类整合子以及基因盒可变区域引物,详细序列见表1。

表1 整合子相关基因序列Tab.1 Sequences of integron related gene
分别加入12.5 μL preMix酶预混液,8.5 μL无RNA酶水,上下游引物各1 μL,2 μL样品DNA模板制成25 μL体系。进行PCR反应。整合子PCR条件:94℃预变性5 min;94℃变性30 s,58℃退火30s,72℃延伸30 s,30个循环,终延伸72℃ 10 min。I类整合子可变区PCR条件:94℃预变性5 min;94℃变性1 min,56℃退货45 s,68℃延伸6 min,30个循环;终延伸72℃ 10 min。II类整合子可变区PCR条件:94℃预变性5 min;94℃变性30 s,退火55℃30 s,延伸72℃ 90 s,30个循环,终延伸10 min。
1.2.3 药敏试验
挑取少量菌体制成1.5×108CFU/mL浓度的菌悬液,取100 μL用10mL CAMHB肉汤稀释,稀释后接种96孔药敏板(15种抗菌药物),37℃温育18h后,读取最小抑菌浓度MIC值。大肠埃希菌ATCC25922作为革兰阴性菌药敏板质控菌株。15种抗菌药物包括常见的临床上用于治疗沙门菌的常用药物见表2。
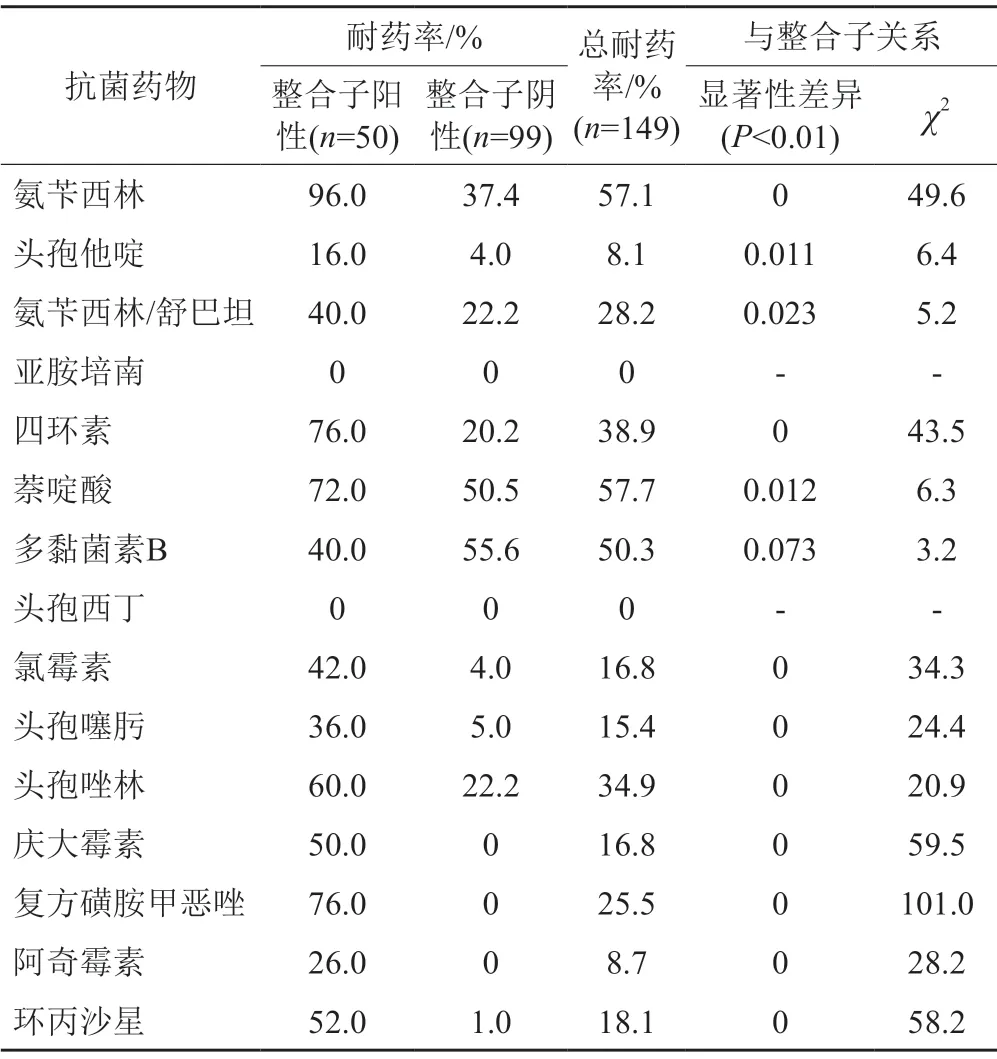
表2 149株沙门菌耐药情况Tab.2 Drug resistance of 149 Salmonella strains
1.2.4 统计方法
采用SPSS 21.0软件。计数资料以百分率(%)表示,两组之间比较采用χ2检验。检验水准α=0.01,若P<0.01,说明两组数据具有显著差异。
1.2.5 基因测序
将Var可变区阳性PCR产物送至北京天一辉远生物公司测序。将所得基因测序序列在CARD(the comprehensive antibiotic research database)数据库(https:// arpcard.mcmaster.ca)进行BLAST序列分析。
2 结果
2.1 沙门菌分离
按上述方法共分离149株沙门菌,其中食源性沙门菌80株,病源性沙门菌69株。
2.2 整合子分型
以煮沸法提取的沙门菌DNA为模板,对3种整合子基因进行PCR扩增,I类整合子阳性率33.6%(50/149),未检出II、III类整合子。将I类整合子阳性的50株沙门菌进一步检测,对其可变区var基因进行PCR扩增。图1为Var基因部分扩增图谱,其中泳道1、5、6在1500bp左右有扩增,2泳道在1700bp左右有扩增,4泳道在1800bp左右有扩增,7泳道为150bp左右的空基因盒,3、8两个泳道整合子中未携带基因盒。结果发现共有28株菌检测出PCR产物,PCR产物分4类,扩增片段从150~1800bp。其中有3株PCR产物为150bp左右的空基因盒(整合子未捕获任何基因),其余25株均有1000bp以上PCR产物。综合凝胶图谱发现其中22株PCR扩增产物在约1500bp处,2株在1700bp处,1株在1800bp处,部分凝胶图谱如图1所示。
2.3 耐药比对结果
将149株沙门菌按照是否携带整合子进行分类,分别计算其耐药率,比对整合子的携带对细菌耐药率的影响,见表2。
表2数据分析,除亚胺培南和头孢西丁耐药率为0以外,其余12种抗菌药物均有不同程度耐药。5种耐药率高于30%,分别为第一、二代β-内酰胺类抗菌药物—氨苄西林、氨苄西林/舒巴坦、头孢唑林;其余3种分别为第一代喹诺酮类抗菌药物—萘啶酸,四环素和多黏菌素B。第三代β-内酰胺类抗菌药物头孢他啶和头孢噻肟耐药率亦高达8.1%和15.4%。耐3类及以上抗菌药物的为多重耐药菌株,多重耐药菌株共75株,多重耐药率高达50.3%。根据整合子携带不同,将沙门菌分成两类。整合子阳性与阴性菌的多重耐药率详见表3。将两组数据进行χ2检验,P=0说明沙门菌的多重耐药性与其携带整合子情况相关。

表3 整合子与多重耐药率的关系Tab.3 The relationship between integron and multidrug resistance
2.4 基因测序
由于对整合子可变区扩增中,相同碱基数PCR产物比较集中,故从25个PCR产物中挑选10份进行测序,其中1500bp左右PCR产物8份,1700和1800bp左右产物各一份,所得核酸序列结果进入CARD抗菌药物抗性基因数据库进行BLAST比对。1500bp产物携带基因盒为dfrA17-aadA5;1700bp携带基因盒为dfrA12-aadA2;1800bp携带基因盒为linG,图2为1800bp所测得的基因序列图谱片段。
3 讨论
149株沙门菌中未发现第II类、第III类整合子,检出第I类整合子的菌株50株,I类整合子阳性率为33.6%。与其他食源性致病菌相比,沙门菌整合子检出率低于大肠埃希菌而高于副溶血性弧菌、金黄色葡萄球菌和志贺菌等其他食源性致病菌,不同细菌耐药性的高低与整合子检出率趋于一致[6-7]。
在沙门菌的耐药性实验中,发现其对多达12种的抗菌药物存在耐药性,其中总耐药率高于50%的有3种,分别是第一代β-内酰胺类抗菌药物氨苄西林、第一代喹诺酮类抗菌药物萘啶酸和多黏菌素B,沙门菌对这3种抗菌药物表现强耐药性。沙门菌仅对头霉素类抗菌药物头孢西丁以及碳青霉烯类抗菌药物亚胺培南保持着高敏感率。对12种抗菌药物整合子携带情况与沙门菌耐药性分析得出,整合子阳性菌耐药率均高于整合子阴性菌1~4倍,这表明整合子的携带率与耐药率存在正相关。12种抗菌药物中有9种具有显著差异(P<0.01),包括β-内酰胺类抗菌药物氨苄西林、头孢噻肟、头孢唑林,磺胺类抗菌药物—磺胺甲恶唑/甲氧苄啶,喹诺酮类抗菌药物盐酸环丙沙星,氨基糖苷类抗菌药物庆大霉素,大环内酯类抗菌药物阿奇霉素以及四环素和氯霉素。整合子阳性的多重耐药率为100%,远高于整合子阴性多重耐药率25.3%,这进一步表明整合子对于沙门菌的多重耐药性亦起着关键作用。另外,整合子阳性的菌株在PCR扩增时,并未检出可变区,可能由于携带基因盒片段过长、内部基因盒结构复杂,无法使用传统PCR方法检测、少数整合子缺少3'保守区等因素相关[8]。
沙门菌整合子中携带的耐药基因盒大多数为磺胺类耐药基因二氢叶酸还原酶基因dfr和氨基糖苷类耐药基因核苷转移酶基因aad,且两种基因同时出现。由实验数据可知,不携带此类基因盒的菌株对复方磺胺和庆大霉素的耐药率均为0,而携带dfr和aad基因的菌株的耐药率分别高达76%和50%,耐药表型和耐药基因结果相一致。在自然环境演变过程中,整合子携带率通常为3.6%,且捕获外来基因盒的频率仅为10-5~10-6[9-10],本实验中发现沙门菌的I类整合子携带率高达33.6%,而整合子中耐药基因盒的携带率为50%,这可能是由于抗菌药物长期大量使用诱导产生耐药菌株,增大了选择压力,使整合子的发生率以及捕获外来耐药基因盒的能力均大大提高,并且在外界环境压力下,整合子稳定传播,从而造成整合子及耐药基因盒的携带率明显偏高。
此外实验中还检出了罕见的林可胺类耐药基因盒linG,该基因盒在沙门菌整合子中鲜有报道。林可胺类抗菌药物耐药基因linG是于2006年首次发现并命名[11],该类抗菌药物主要作用于治疗由革兰阳性菌带来的人及动物的感染性疾病,对沙门菌这种革兰阴性肠道菌并不适用。而且在NCBI序列BLAST比对中,也仅在大肠埃希菌质粒中检出过该基因盒。对于此次在沙门菌中检出的林可胺类耐药基因盒linG可能是通过可移动元件由其他细菌水平传递给沙门菌。尽管这种抗性基因对受体菌本身生存并无影响,但仍可以作为媒介传递给其他菌,造成耐药性的传播,因此沙门菌中检出林可胺类耐药基因盒linG应该引起人们的重视。
总之,整合子的调控与表达受到多方面因素的影响,特别是沙门菌这种多年持续高耐药率,可引起人畜共患病的致病菌更应予以足够重视,加强抗菌药物的用药有重要意义。就目前监测的来源于食品和病患的沙门菌耐药性情况看,本地区沙门菌的I类整合子携带率较高,对多种抗菌药物均具有明显的耐药性,整合子的携带率与耐药性存在高度相关性。整合子的阳性携带率与沙门菌的多重耐药亦密切相关。整合子所携带的耐药基因主要为dfr和aad,耐药表型和耐药基因结果相一致。此外,罕见的林可胺类耐药基因盒linG首次在沙门菌中被发现,尽管目前该基因盒对沙门菌抗菌药物的耐药性影响不大,但鉴于整合子作为可移动元件传递耐药基因,亦需引起人们的重视。

