PEG-6000模拟干旱胁迫对弥勒苣苔生长的影响*
孙亚瑞,张峰程,许彬,何俊,孟静,3
(1.云南农业大学 园林园艺学院,云南 昆明 650201; 2.中国科学院昆明植物研究所,云南 昆明 650201;3.云南省极小种群野生植物综合保护重点实验室,云南 昆明 650201)
植物在自然环境里生长,容易受到不同因素的影响,特别是非生物因素。其中,干旱胁迫会影响植物的地理分布,限制植物产量,影响植物的观赏价值,制约植物生态效益[1-3]。聚乙二醇(PEG-6000)是一种乙醇聚合物,具有较强的吸水性,可使植物细胞脱水,从而达到模拟干旱胁迫的目的[4]。许多高等植物在遭受干旱胁迫时,常通过调节其自身代谢机制、保护酶类来应对干旱[5]。例如:通过气孔调控来加强保水能力,通过促进根系生长以增加吸水能力,通过糖和脯氨酸等物质的积累来提高渗透调节能力,通过活性氧清除酶以及抗氧化剂来降低干旱损害等[6]。这些调节机制仅能忍受轻度和中度干旱,无法应对长时间的重度干旱。而一些通过独特耐极端干旱的机制来适应干旱的复苏植物可以在极端缺水的条件生存,复水后可恢复正常的生长发育[7-9]。
弥勒苣苔(OreocharismileensisMich.Möller & A.Weber)为苦苣苔科(Gesneriaceae)马铃苣苔属(OreocharisBenth.)多年生耐荫草本,无地上茎,叶片基生,有柄,呈圆卵形,花冠黄色唇形,可作为室内观赏花卉,具有较高的观赏价值和开发潜力[10-11]。1906年法国传教士在云南弥勒县首次采集到该种,时隔百年后,该种的野生群在云南石林县再次被发现[12]。弥勒苣苔多生长在石灰岩地区,野生群仅在云南(弥勒、石林)、广西(百色)、贵州(兴义)分布,数目少,为极小种群,被列为珍稀濒危植物[12-15]。因弥勒苣苔生长环境恶劣,能够在极端干旱条件下生存,一旦恢复水分就可以迅速恢复正常的生长状态,表明其为复苏植物。Li等[16]研究了弥勒苣苔对极端干旱的响应,发现它具有一种通过调节膜脂组成来应对干旱的新的耐旱模式。目前,对于弥勒苣苔在干旱胁迫下形态和生理生化变化的研究还鲜有报道。因此,以2 a生弥勒苣苔植株为试验材料,通过不同浓度的聚乙二醇(PEG-6000)模拟干旱胁迫,观测其形态特征变化并测定生理指标,探讨干旱胁迫对其生长的影响,为其引种栽培及保护提供理论依据。
1 材料与方法
1.1 试验材料
选择2 a生生长良好、无病虫害的弥勒苣苔植株,栽植于规格16 cm×16 cm×12 cm的塑料盆中。栽培基质采用草炭∶珍珠岩=1∶1。放置于温室里统一管养。
1.2 试验内容与方法
采用不同浓度的PEG-6000溶液模拟干旱胁迫,共设置4个处理:0(CK)、5%(T1)、10%(T2)、15%(T3)。采用随机区组设计,每个处理6盆,重复3次,共72盆。试验前浇透水,3 d后用塑料袋包住栽植参试苗木的塑料盆底部,浇灌PEG-6000溶液,于干旱胁迫处理0 、4、8 d时分别观测参试苗木形态指标及测定相关生理指标。
弥勒苣苔形态指标的观测:每隔4 d记录一次植株的生长表现(生长旺盛与否)、叶片状况(色泽的变化、萎蔫与否)。采用3级分级标准综合评定参试苗木的受害程度:-,无伤害;+,植株生长受到影响,出现叶片边缘卷曲;++,植株停止生长,叶片失水全部卷曲[17]。
生理指标测定:每隔4 d,于8:30统一取样,分别从植株基部叶片开始取样[18],每个处理设3个重复,所取叶片用锡箔纸包住,液氮速冻放入密封袋中,保存在-80 ℃的超低温冰箱中,以待相对电导率(%)、叶绿素含量(mg/g)、丙二醛含量(nmol/g)、过氧化物酶〔U/(g·min)〕以及超氧化物歧化酶(U/g)等指标的测定。每个样品测定重复3次。
相对电导率采用电导仪法测定;叶绿素含量和丙二醛(MDA)含量分别用分光光度计法、硫代巴比妥酸(TBA)法测定;过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性的测定分别采用愈创木酚法和氮蓝四唑(NBT)光化还原法[19]。
1.3 数据分析
试验数据用Excel 2010软件统计分析,DPS 7.05进行方差及显著性分析。
2 结果分析
2.1 干旱胁迫对弥勒苣苔形态特征的影响
不同浓度PEG-6000溶液处理后,T1、T2、T3处理随时间的推移,叶片均表现出不同程度的萎蔫(表1)。第4 d,T2和T3处理叶片开始表现萎蔫,T1处理表现正常;第8 d时,T1、T2和T3处理叶片均表现萎蔫,T3处理的植株停止生长,叶片失水全部卷曲,受害最重。

表1 干旱胁迫下弥勒苣苔叶片形态变化Tab.1 The observation of leaf morphology of O.mileensis under drought stress
2.2 干旱胁迫下弥勒苣苔相对电导率的变化
由图1可知,随着胁迫时间增加,CK处理弥勒苣苔叶片的相对电导率呈现先上升后下降的趋势,于第4 d达到最大值。T1和T2、T3处理叶片的相对电导率均在第8 d达到最大值,与第0 d相比分别增加了24.61%、33.68%和26.57%。干旱胁迫第4 d,CK处理叶片的相对电导率与T2处理相比差异显著(P<0.05),CK处理与T1和T3处理比较差异不显著(P>0.05);干旱胁迫第8 d,T2、T3处理叶片的相对电导率与CK相比差异显著(P<0.05)。
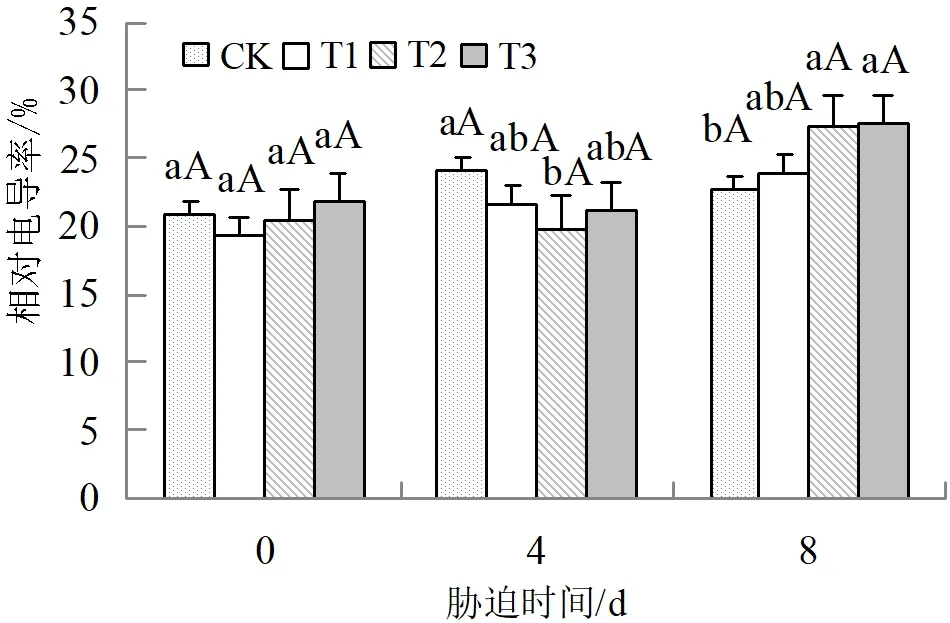
图1 干旱胁迫下弥勒苣苔相对电导率的变化趋势注:图中数据为平均值,不同小写字母表示同一时间处理间差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),下同。Fig.1 The changes of relative conductivity of O.mileensis under drought stress
2.3 干旱胁迫对弥勒苣苔叶绿素含量的影响
由图2可知,经不同浓度的PEG-6000处理后,T2和T3处理随着胁迫时间增加,弥勒苣苔叶片叶绿素含量呈上升趋势。干旱胁迫第8 d,T2、T3处理叶绿素含量分别比CK增加20.86%和17.02%,T1处理较CK减少了6.88%; T2处理与CK间差异不显著(P>0.05)。

图2 干旱胁迫下弥勒苣苔叶绿素含量的变化趋势Fig.2 The changes of chlorophyll content in O.mileensis under drought stress
2.4 干旱胁迫对弥勒苣苔丙二醛含量的影响
由图3可知,采用低浓度到高浓度的PEG-6000处理后,弥勒苣苔叶片的MDA含量呈现平稳的上升趋势。在胁迫第8 d时,T3处理叶片的MDA含量较CK、T1和T2分别增加了23.56%、26.27%、28.80%,存在极显著差异(P<0.01),CK、T1、T2处理之间差异不显著(P>0.05)。

图3 干旱胁迫下弥勒苣苔丙二醛含量的变化趋Fig.3 The changes of MDA content in O.mileensis under drought stress
2.5 干旱胁迫对弥勒苣苔过氧化物酶活性的影响
由图4可以看出,各处理叶片POD活性随胁迫时间的延长和胁迫时间的增加,均呈现先上升后下降的趋势,于干旱胁迫第4 d达峰值,其中T2处理POD活性最高为615.50 U/(g·min),较同一时间的CK显著增加了14.92%(P<0.05)。各处理在第8 d时,POD活性均降低,较第4 d分别减少了43.46%、65.30%、58.43%、61.85%,处理间差异不显著(P>0.05)。

图4 干旱胁迫下弥勒苣苔过氧化物酶活性的变化趋势Fig.4 The changes of POD activity in O.mileensis under drought stress
2.6 干旱胁迫对弥勒苣苔超氧化物歧化酶活性的影响
由图5可知,各处理弥勒苣苔叶片SOD活性随干旱胁迫时间的延长和胁迫程度增加,均呈现持续上升趋势。胁迫第8 d时,各处理SOD活性达到峰值,其中T3处理SOD活性最高;T1、T2、T3处理与CK处理SOD活性相比分别增加了49.19%、110.66%、141.76%,差异极显著(P<0.01)。

图5 干旱胁迫对弥勒苣苔超氧化物歧化酶活性的变化趋势Fig.5 The changes of SOD activity in O.mileensis under drought stress
3 讨论与结论
干旱胁迫下,植物的形态特征可直接反映植物受损害的程度,株高、茎粗、叶片形态、叶片数和叶面积等植物地上部会因干旱胁迫造成不同程度的影响[20]。通常植物会通过放慢生长速度或缩小叶面积来缓解水分亏缺造成的危害。本研究表明,PEG-6000浓度为5%对弥勒苣苔叶片生长无显著影响,而随着干旱胁迫的加剧,叶片出现不同程度的卷曲,与Li等[16]对弥勒苣苔、赵日成[17]对长瓣马铃苣苔(Oreocharisauricula)的研究结果相一致,表明弥勒苣苔可以通过叶片卷曲来适应干旱环境。
植物在遭受干旱胁迫时,植株体内会产生大量的活性氧,对细胞膜系统造成伤害,相对电导率可用于判断细胞膜损伤程度。产生过量活性氧自由基也会引起细胞膜脂过氧化,MDA是细胞膜质过氧化的产物之一,它的大量累积是活性氧作用的表现。因此,MDA可用于表示细胞膜脂过氧化程度[19,21-22]。众多研究者认为相对电导率与MDA含量呈正相关。本研究表明,弥勒苣苔叶片随着干旱胁迫时间的延长,相对电导率和MDA含量呈上升趋势,各处理间差异不显著(P>0.05),与张璐等[23]对文冠果(Xanthocerassorbifolium)在干旱胁迫下耐盐性的研究结果一致。在胁迫4 d时,T1、T2、T3处理植株的MDA含量和相对电导率较CK差异不显著(P>0.05),推测在胁迫初期,弥勒苣苔植株有较强的抗旱性,未对细胞内环境造成严重伤害,与刘凯月等[24]对荆芥(Nepetacataria)的研究结果一致。在胁迫8 d时,T3处理叶片的MDA含量极显著高于CK(P<0.01),其相对电导率却与CK差异不显著(P>0.05),推测在胁迫后期弥勒苣苔植株受害较轻,这与张丹丹等[25]对大花旋蒴苣苔(Boeaclarkeana)的研究结果一致,表明弥勒苣苔具有一定的耐旱性。
光合作用是植物生长发育的基础,叶绿素是参与光合作用的一个重要因素,其含量能直接反映植物适应、利用环境因子以及制造有机物的能力[26]。本研究表明,弥勒苣苔叶片中叶绿素含量整体呈上升趋势,与罗孟容等[27]对栀子(Gardeniajasminoides)研究结果一致。而孔艳菊等[28]对黄栌(Cotinuscoggygria)研究中表明干旱胁迫下,植物体内叶绿素的合成和降解系统易受破坏,从而导致叶绿素含量降低。产生差异的原因可能是弥勒苣苔在干旱胁迫下具有抗旱性,能够减轻干旱对叶绿素合成与降解系统的伤害。
POD是一种广泛存在于植物细胞内的氧化还原酶,可清除羟基自由基和H2O2,也在抗旱性中发挥重要作用[29]。本研究表明,弥勒苣苔叶片POD活性在干旱胁迫4 d时上升很快,推测弥勒苣苔为了适应所处的胁迫环境,激发体内保护机制,与高兴国等[30]对光叶珙桐(Davidiainvolucratavar.vilmoriniana)的研究结果一致。但在干旱胁迫第8 d时POD活性开始下降,推测干旱胁迫强度达到一定程度,超氧阴离子大量积累破坏酶结构,导致酶活性降低[31]。
植物受到干旱胁迫时,细胞内产生和清除活性氧的平衡系统就会受到破坏,导致活性氧积累。SOD是一种清除活性氧自由基(O2-)的酶,可以猝灭O2-的毒性,维持活性氧代谢平衡、保护膜结构,使植物在一定程度上可以抵御水分胁迫[32]。本研究表明,各处理随着时间的增加,干旱胁迫第4 d,SOD活性呈缓慢上升趋势,与阮凌暄等[33]对铁皮石斛(Dendrobiumofficinale)的研究结果不一致,推测在干旱初期弥勒苣苔叶片能够正常生长,体内产生的O2-较少。在胁迫第8 d时,SOD活性达到最大值,T2、T3与CK、T1处理表现出极显著差异(P<0.01),与董晶晶等[34]对牛膝菊(Galinsogaparviflora)的研究结果一致,推测当干旱胁迫达到一定的积累,弥勒苣苔体内可产生大量的酶进行自我保护。
综上所述,在干旱胁迫后期,弥勒苣苔叶片出现不同程度的卷曲,来抵御干旱;相对电导率、MDA含量呈显著上升趋势,增加了弥勒苣苔叶片膜脂过氧化程度;在整个胁迫实验过程中,POD活性呈先上升后下降的趋势;SOD活性前期呈缓慢上升趋势,后期各处理迅速升高,推测弥勒苣苔可以通过增强酶活性来保护其膜系统。

