二氢杨梅素对实验性结肠炎小鼠调节性B细胞的影响
李小丽,陈慧玲,王小春,韩悌云,3*,张德奎*
(1.兰州大学第二医院 消化内科 甘肃 兰州 730000; 2.甘肃省人民医院 消化内科, 甘肃 兰州 730000;3.兰州大学第二医院 消化疾病重点实验室, 甘肃 兰州 730000)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性、复发性、难治性自身免疫性肠道疾病[1-2],约50%的UC患者疾病反复发作,严重影响生活质量[3]。目前UC的治疗是临床上面临的难题,因此寻找一种有效的治疗药物迫在眉睫。 二氢杨梅素(dihydromyricetin,DHM)是从显齿蛇葡萄中分离出来的一种天然黄烷醇化合物,据报道具有抗感染、抗肿瘤、抗酒精的作用[4]。
免疫系统紊乱是近年来UC的研究热点,传统观点认为UC疾病进展中免疫细胞介导的免疫应答导致促炎因子的产生和结肠组织的破坏,其中B细胞发挥重要作用[5-6]。然而,近年来研究发现B细胞在自身免疫疾病中具有调节作用,并将这种特殊的B细胞定义为调节性B细胞(regulatory B cell,Breg)[7]。Breg主要通过产生抗炎因子白介素10(interleukin 10,IL-10)及转化因子β(transforming growth factor,TGF-β)在溃疡性结肠炎、慢性炎性和癌等疾病中发挥调节作用,但是在结肠炎中的相关研究甚少,考虑到Breg细胞功能障碍在UC中的重要性,需要进一步研究Breg参与疾病进程的机制[3, 8-9]。本研究主要探讨DHM对实验性结肠炎小鼠Breg的影响及可能机制,为结肠炎的治疗提供一定的参考。
1 材料与方法
1.1 材料
SPF级雌性BALB/c小鼠24只,6~8周龄,体质量(20±2)g(中国农业科学院兰州兽研所),饲养于兰州大学第二医院SPF级动物实验室(伦理批号:D2019-104)。二氢杨梅素(成都曼斯特生物科技有限公司);RT-qPCR引物(兰州天启基因生物科技有限公司);美沙拉嗪(Mesalazine)(0.5 g/袋,上海爱的发制药有限公司);葡聚糖硫酸钠(Dextran Sulfate Sodium Salt, DSS,Yeasen Biotech有限公司,分子质量:3.6~5.0 ku);4%组织固定液(北京索莱宝科技有限公司);CCK8(Biosharp公司);APC抗鼠CD5抗体、FITC抗鼠CD1d抗体和PerCP/Cyanine5.5抗鼠CD19抗体(Biolegend公司);Evo M-MLV反转录试剂盒Ⅱ及SYBR Grennm Pro Taq HS预混型qPCR试剂盒(艾瑞科生物科技有限公司)。
1.2 方法
1.2.1 小鼠的分组及处理:将小鼠随机分为正常组(normal)、DSS组、DSS+DHM组、DSS+mesalazine组(造模采用4% DSS连续饮用7 d)。7 d后,每天分别给予灌胃水(0.2 mL/d)、DHM(40 mg/kg·d)和美沙拉嗪(520 mg/kg·d)。
1.2.2 小鼠疾病活动性指数(disease activity index,DAI)评分:每日观察小鼠粪便性状及黏稠度。根据以下标准给粪便中的出血评分(0:无; 2:可见的粪便中有血迹; 4:直肠出血)。 粪便稠度评分确定如下(0:正常; 1:柔软但仍形成; 2:非常柔软; 3:半腹泻; 4:腹泻)[10-11]。
1.2.3 HE染色及大体标本的观察:取小鼠全结肠量取长度后,置于4%组织固定液固定,常规石蜡包埋后进行HE染色,高倍镜下(×200)选择多个视野进行观察。HE染色切片采用盲法评估,根据炎性反应和隐窝损伤进行病理学评估(表1)[11]。

表1 病理学评分Table 1 Pathology score
1.2.4 脾脏单细胞悬液及流式染色:将新鲜脾脏置于冰上研磨后,1 000×g离心10 min,弃上清重悬,取10 μL细胞悬液使用血细胞计数板计数。将每个组制备好的脾脏单细胞悬液分为空白管、CD19单染管、CD5单染管、CD1d单染管、CD19 CD5 CD1d三染样本管及CD19 CD5 CD1d同型对照管。每个管中各取4×107个细胞悬液,根据分组加入对应抗体,避光孵育30 min,各加入900 μL磷酸盐缓冲液(PBS),行流式细胞仪(Canto, BD Biosciences)检测。
1.2.5 实时荧光定量PCR(RT-qPCR) 检测脾细胞中细胞因子的mRNA:用Trizol试剂(Ambion)提取脾脏细胞总RNA。RNA在oligo dT引物的存在下,用反转录试剂盒反转录为cDNA。使用SYBR Grennm Pro Taq HS预混型qPCR试剂盒在Roche LightCycle 96系统上进行定量PCR。循环参数为:95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s,40个循环;95 ℃ 5 s、60 ℃ 60 s、95 ℃ 1 s、最后60 ℃ 30 s。结果用2-△△Ct计算。PCR引物见表2。

表2 RT-qPCR引物序列Table 2 Primer sequence for RT-qPCR
1.2.6 CCK8检测脾脏细胞的增殖:将脾脏单细胞悬液以5×103个/100 μL分别接种于96孔板,加入不同浓度梯度的DHM(0、2.5、5、10、20、40、80、160、 320和640 μmol/L)于37 ℃培养箱(配摇床)分别作用24和48 h,每孔加入20 μLCCK8溶液,37 ℃细胞培养箱孵育2~4 h后酶标仪检测450 nm吸光度值。
1.3 统计学分析
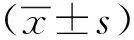
2 结果
2.1 小鼠一般情况评估
与对照组比较,给予DSS后第4天,小鼠开始出现明显的精神状态欠佳,毛发稀疏成簇,肛门处可见明显肉眼血便,体质量出现明显下降(图1A),DAI评分明显升高(图1B);与DSS组比较,DSS+DHM与DSS+mesalazine组小鼠出现明显体质量增加(图1A),DAI评分降低(P<0.05)(图1B)。

A.daily weight change of mice; B.disease activity index图1 各组小鼠体质量变化及DAI评分Fig 1 Change of body weight and DAI scores of mice in each
2.2 各组小鼠结肠大体形态及光镜下病理学的比较
在大体形态上,DSS组小鼠结肠可见明显的水肿和肠道出血,结肠黏液血便不易剥离。结肠长度比较DSS A.colon gross morphology image; B.comparison of colon length among groups; C.HE staining; D.pathological score;*P<0.05 compared with normal; #P<0.05 compared with DSS图2 各组小鼠结肠及HE染色Fig 2 Colon and HE staining in each group of 与对照组比较, DSS组CD19+B细胞比例明显降低,与DSS组比较,DSS+DHM组和DSS+mesalazine组明显升高(P<0.05)(图3A,B);与对照组比较, DSS组Breg细胞比例明显降低,与DSS组比较,DSS+DHM组和DSS+mesalazine组明显升高(P< 0.05)(图3C,D)。 A, C.flow cytometry analysis of CD19+B cells and Breg; B,D.quantitative analysis, *P<0.05 compared with normal; #P<0.05 compared with DSS group图3 各组脾脏CD19+B cells和Breg细胞的比例Fig 3 Ratio of CD19+B cells and Breg in the spleen in each 与对照组比较,DSS组抗炎因子IL-10及TGF-β mRNA水平明显降低,炎性因子IL-6及IFN-γmRNA水平明显升高(P<0.05);与DSS组比较,DSS+DHM组和DSS+mesalazine组抗炎因子水平明显升高,炎性因子水平明显降低(P<0.05) (图4A~D)。 A.IL-10;B.TGF-β;C.IL-6;D.IFN-γ;*P<0.05 compared with normal group; #P<0.05 compared with DSS group图4 RT-PCR检测脾脏细胞中细胞因子的mRNA水平Fig 4 The cytokines mRNA level of splenocytes were detected by 体外不同浓度DHM干预脾脏细胞,随着DHM浓度的阶梯式升高,DHM对脾脏细胞具有明显促增殖作用(如图5A, B)(P<0.05)。与对照组比较,DHM在体外能显著促进Breg细胞增殖(P<0.05)(图5B,C)。 A,B.CCK8 were used to detect the proliferation of splenocytes at different concentrations of DHM at 24 and 48 hours, *P<0.05 compared with 0 μmol/L group; C.flow cytometry was used to detect the effect of DHM on the proliferation of Breg in vitro; D.quantiative analysis,*P<0.05 compared with NC group图5 体外实验验证DHM对脾脏细胞及Breg细胞的作用Fig 5 Effect of DHM on spleen and Breg cells was verified in UC与免疫系统紊乱密切相关,肠道免疫系统在环境因素和肠道菌群的参与下被激活,在持续的抗原刺激和(或)免疫失调的情况下,炎性反应级联放大,炎性介质导致组织损伤,从而致使UC的发生。目前UC的治疗存在药物低反应、治疗效果差、副作用大、禁忌证、经济负担重等多种因素使UC成为一个需要终身护理的疾病,严重影响国民健康,加重经济负担[12-13]。二氢杨梅素是一种传统中药,具有抗感染、抗氧化、降血脂、解酒保肝的作用。本课题组前期研究证实,DHM在小鼠实验性结肠炎中主要通过恢复免疫细胞Treg/Th17之间的平衡,调节肠道微环境,同时降低结肠组织中金属蛋白酶表达,减少细胞外基质的降解,从而发挥治疗作用。本研究通过DSS制备小鼠实验性结肠炎模型,经DHM治疗后发现,DHM能够明显改善小鼠结肠炎的症状、结肠组织学损伤及DAI评分,且治疗组炎性因子水平降低,与前期研究相符[14]。 然而在UC疾病病程中,不仅包括T细胞介导的免疫应答, B细胞也参与了UC的发生发展。目前,除传统B细胞外,一种独特的B细胞亚群定义为Breg,具有调节炎性和自身免疫的功能,其特征是产生调节性细胞因子IL-10和TGF-β[9, 15]。CD19+CD5+CD1d+B细胞是B细胞群中能够分泌IL-10发挥作用的主要亚群,是Breg细胞的特征之一。虽然Bregs只占所有免疫细胞的极小部分,但它们在调节免疫反应方面具有重要的作用[9, 12]。本研究通过DHM治疗DSS结肠炎小鼠,检测脾脏单细胞悬液中CD19+B及Breg(CD19+CD5+CD1d+B)的比例变化,发现DSS组小鼠脾脏Breg比例明显降低,经DHM治疗后,Breg比例明显增多,抗炎因子IL-10和TGF-β mRNA水平明显升高,首次在体内实验中证实DHM治疗结肠炎小鼠可能是通过调节Breg细胞数目及其分泌的抗炎细胞因子实现的。同样,在体外实验中,使用不同浓度DHM干预小鼠脾脏细胞,发现DHM能明显促进脾脏细胞的增殖,应用流式细胞术检测DHM干预脾脏细胞24 h后Breg细胞比例变化,发现与对照组相比,DHM明显增加了Breg细胞的比例,体内外实验证实DHM在实验性结肠炎小鼠中发挥治疗作用是通过促进Breg增殖及分泌抗炎因子IL-10和TGF-β有关,但是其上下游的机制尚不明确,需要进一步的研究。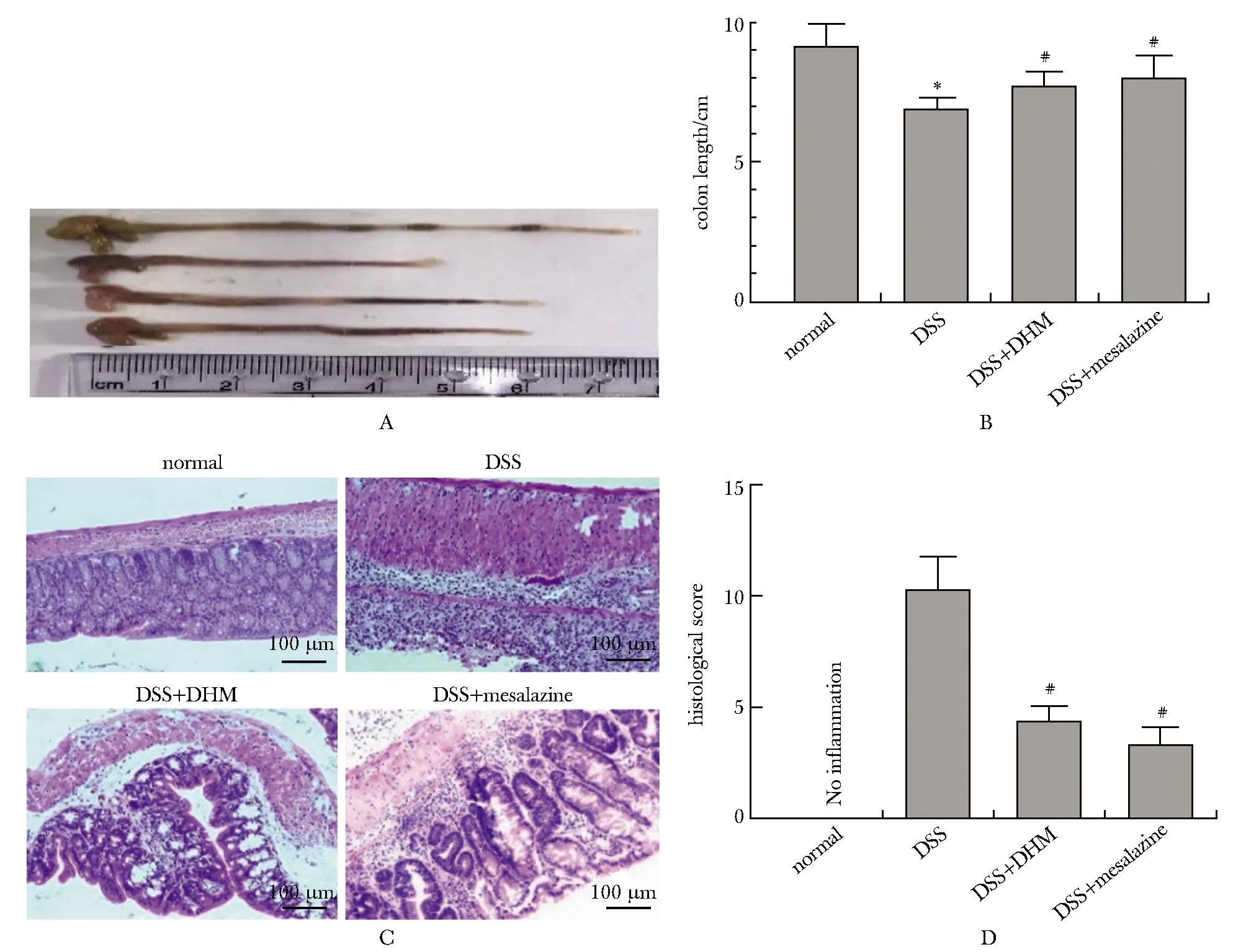
2.3 小鼠脾脏单细胞悬液中CD19+B淋巴细胞和Breg(CD19+CD5+CD1d+)比例的比较

2.4 各组小鼠细胞因子(IL-10、TGF-β、IL-6和IFN-γ)mRNA的水平比较

2.5 DHM对小鼠脾脏细胞的促增殖作用

3 讨论

