miR-30b促进弥漫性大B细胞淋巴瘤细胞凋亡
许巧玲,应江山,崔 冉,张 宁
(上海市闵行区肿瘤医院(复旦大学附属肿瘤医院闵行分院)肿瘤内科,上海 200240)
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)多发生在中老年人群,其侵袭能力较强、细胞繁殖速度较快[1]。患者常见的临床表现为身体多处产生无痛性的肿块、体质量下降、盗汗等[2]。弥漫性大B细胞淋巴瘤可产生于机体的各部位,是由惰性的淋巴瘤转化而形成,是一种具有高度异质性疾病,其发病诱因可能是BCL6、BCL2以及MYC的重排,最终导致生发中心细胞或B细胞起源的恶性具有克隆性质的转化和扩散。对于弥漫性大B细胞淋巴瘤的治疗常规采用化学治疗的方法,但此种治疗方法会使病情在一段时间之内反复发作,且预后较差,给患者带来较大的生活困扰,因此对于弥漫性大B细胞淋巴瘤的治疗需要寻找新的方法。有研究指出,失调的miRNA的表达参与多种疾病的产生与发展,尤其是恶性肿瘤[3]。根据多位研究者研究显示,miR-30b与肿瘤发生发展密切相关,且其在多种肿瘤中也呈现为低表达,但其在弥漫性大B细胞淋巴瘤中的作用机制目前尚无定论[4-5]。脆性组氨酸三联体(fragile histidine triad gene,FHIT)是一种抑癌基因,对于调控细胞周期也有一定的作用,FHIT在白血病的研究较多,FHIT表达与白血病疾病进展呈现负相关[6],目前,关于miR-30b、FHIT及DLBCL的相关性研究较少,因此,本文通过转染miR-30b到DLBCL细胞中,探究miR-30b与FHIT对弥漫性大B细胞淋巴瘤细胞的作用机制。
1 材料与方法
1.1 材料
1.1.1 标本及细胞:DLBCL细胞系(上海熹垣生物科技有限公司),选取上海市闵行区肿瘤医院(2017年2月至2019年6月)DLBCL患者的肿瘤石蜡标本与同期淋巴结正常组织石蜡标本共42例作为研究对象,其中DLBCL组21例、对照组21例。DLBCL患者男、女各占50%,平均年龄(54.5±7.4)岁,淋巴结正常组织男12例、女8例,平均年龄(55.3±6.9)岁。DLBCL患者均已确诊且两组患者及家属均知情并已详细了解本次实验内容。已通过上海市闵行区肿瘤医院伦理委员会审批(批号:201805-003)。
1.1.2 试剂:胎牛血清(广州济恒医药有限公司);FHIT试剂盒(上虞艾科仪器设备有限公司);乙醇(济南坤丰化工有限公司);PCR引物序列(上海联迈生物工程有限公司);胰蛋白酶(杭州浦泰生物科技有限公司);RPMI 1640培养液(青岛雅各化学试剂销售有限公司)。
1.2 方法
1.2.1 细胞的培养及分组处理:运用RPMI 1640培养液(含胎牛血清),于37 ℃,5% CO2条件下培养,取对数期细胞进行试验。miR-30b的转染:将细胞接种于无血清培养液的6孔板中培养。直至细胞增殖至45%~55%汇合时,按说明书操作,用Lipofectamine2000TM转染50 nmol/L相应的miR-30b mimics、miR-30b-NC,充分混合,转染9 h后,继续培养3 d后即可进行实验。实验分为3组WW组(DLBCL无转染组)、WZ组(DLBCL转染NC组)、ZR组(DLBCL转染miR-30b 组)。
1.2.2 RT-qPCR检测miR-30b的表达:用胰蛋白酶消化后提取细胞悬液,冲洗,放于无菌试管中,采用Trizol试剂提取RNA,反转录为mRNA后进行扩增,以β-ation为内参,PCR反应条件:95 ℃ 10 s,60 ℃ 30 s,94 ℃ 5 min,72 ℃ 3 min,72 ℃ 5 min,总计55个循环(表1)。

表1 引物序列Table 1 Primer sequence
1.2.3 Western blot检测FHIT的表达:细胞中加入 600 μL裂解液进行裂解并提取蛋白,并对蛋白的浓度进行测量,分装后,保存在-20 ℃的环境中。将提取出的蛋白溶液和缓冲溶液进行混均,按照4∶1的比例进行,然后将其煮沸、变性。把电泳后的50 μg蛋白样品转移到PVDF膜上,加脱脂奶粉封闭1 h。加入一抗后PBS漂洗3次,每次间隔10 min,最后加入二抗对溶液稀释,常温封闭1 h。取出PVDF膜,用上述方法漂洗,DAB显色后照相。
1.2.4 比色法检测caspase-3活性: 将细胞接种在96孔板中培养。向各孔中加入50 μL 2×Rwaction缓冲液,后加入50 μL细胞裂解液,混匀后在各测定孔中加入底物工作液5 μL,在各空白孔中加入1×Rwaction缓冲液5 μL,混匀,避光放于37 ℃水浴1.5 h,结束后运用酶标仪检测吸光度值(A值)。
1.2.5 流式细胞仪检测DLBCL细胞凋亡:收集DLBCL细胞(2×105个/孔)接种于6孔板中,胰蛋白酶消化细胞,完全培养基终止;PBS清洗,进行细胞计数,1 250 r/min,离心6 min,弃上清, 混入500 μL结合缓冲液重悬。加入 5 μL annexin V-FITC混匀、 10 μL PI混匀,室温避光孵育5~15 min,随即进行流式细胞仪检测。
1.2.6 Transwell小室法检测细胞侵袭:将DLBCL细胞按照5×103个/孔种植于96孔板中,8孔×5板/组。将50 mg/L的基质胶稀释后加入小室上层,37 ℃下呈凝胶状态,细胞1×105个/mL,上室中加入细胞悬液,下室中加入少量胎牛血清培养基,37.5 ℃,培养2 d,取出培养基,拭去残留细胞,现配结晶紫,每孔500 μL,将小室放入,25 ℃染色30 min,PBS清洗1次,稍晾干。显微镜观察每个样本连续选5个清晰视野进行数量统计,然后计算平均数。
1.3 统计学分析

2 结果
2.1 RT-PCR检测miR-30b的表达结果
DLBCL组miR-30b表达水平显著低于对照组(P<0.05),由此可看出miR-30在弥漫性大B淋巴细胞瘤组织中为低表达。ZR组中miR-30b的表达水平高于WW组、WZ组(P<0.05),表明转染成功(图1)。
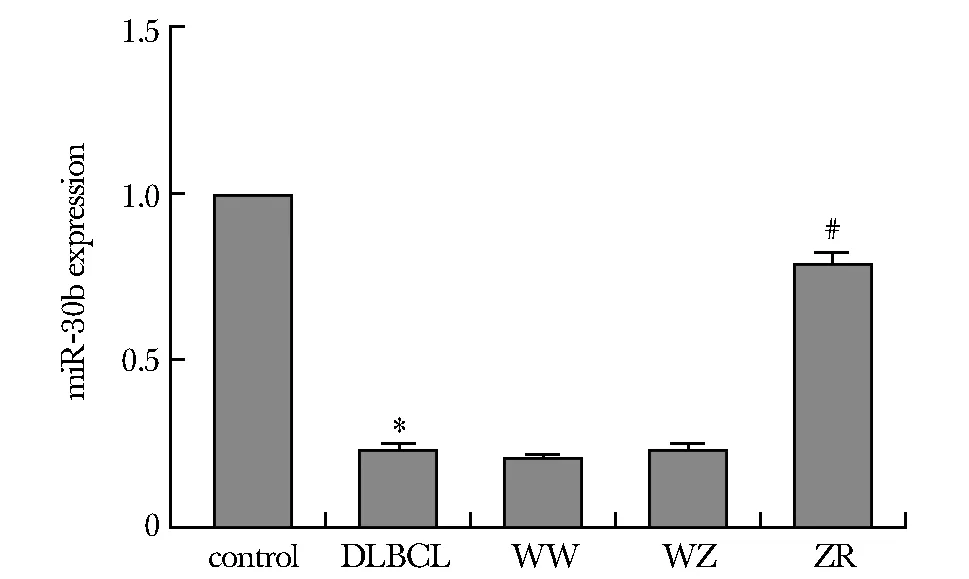
*P<0.05 compared with control group;#P<0.05 compared with WW and WZ group图1 miR-30b在组织与细胞中的表达Fig 1 Expression of miR-30b in tissues and cells
2.2 Western blot检测FHIT的表达
DLBCL组FHIT表达水平显著低于对照组(P<0.05)。ZR组中FHIT蛋白表达水平高于WW组、WZ组(P<0.05)(图2)。
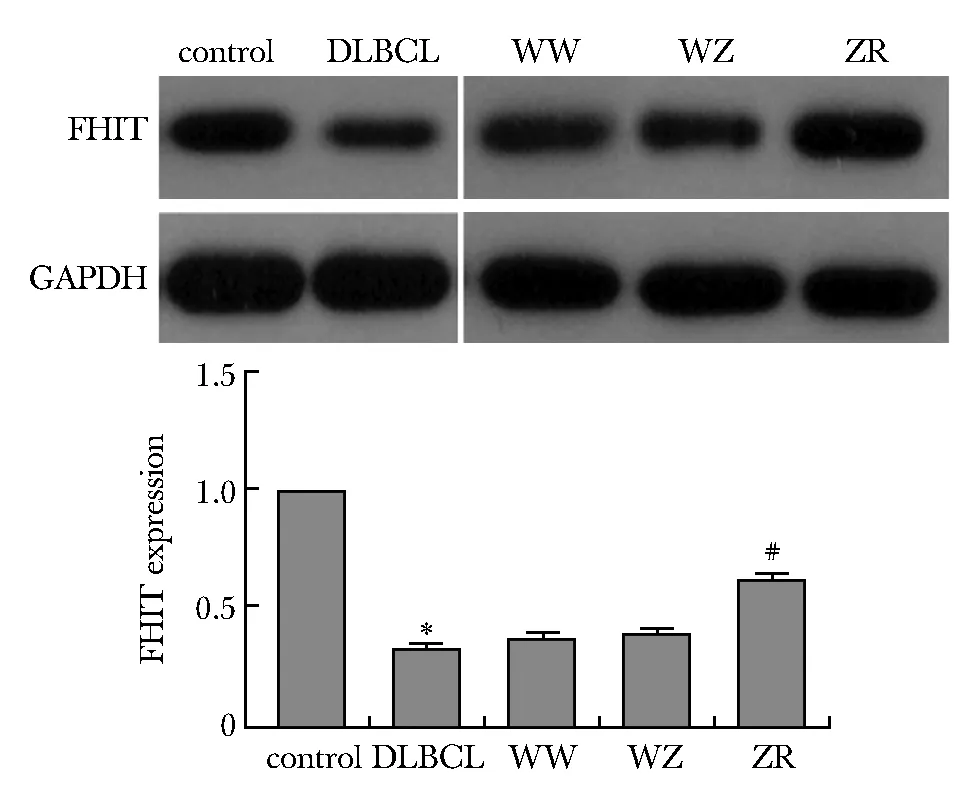
*P<0.05 compared with control group;#P<0.05 compared with WW and WZ group图2 FHIT在组织与细胞中的表达Fig 2 Expression of FHIT in tissues and cells
2.3 Caspase-3活性的检测结果
在WW组DLBCL细胞中caspase3活性与WZ组相似,ZR组DLBCL细胞中caspase3活性较WW组、WZ组明显增高(P<0.05)(图3)。
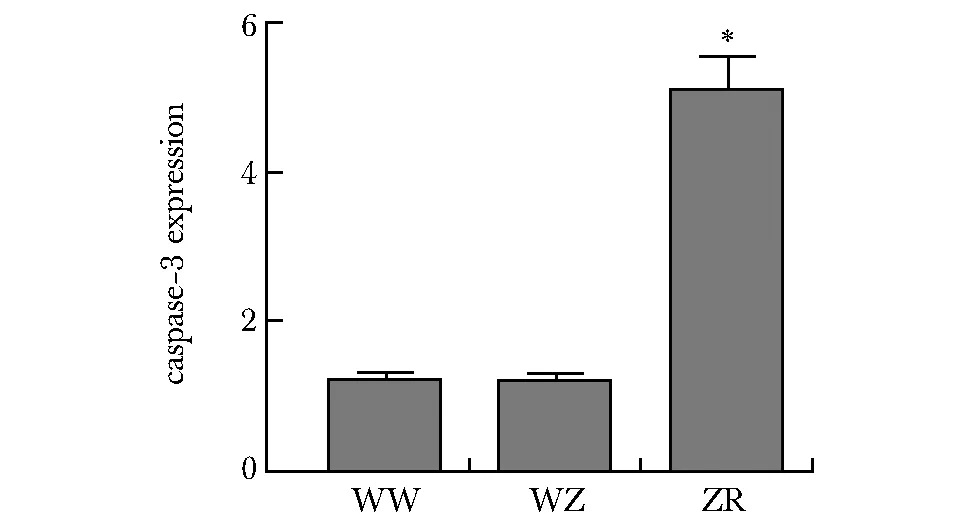
*P<0.05 compared with WW and WZ group图3 各组DLBCL细胞中caspase-3活性比较Fig 3 Comparison of caspase-3 activity in DLBCL cells in each group
2.4 DLBCL细胞凋亡情况的检测结果
24、48和72 h时WW组、WZ组DLBCL细胞凋亡率接近,ZR组细胞凋亡率高于WW组、WZ组(P<0.05),且随着时间的延长各组细胞凋亡率随之增高(表2,图4)。

图4 培养72 h各组DLBCL细胞凋亡情况Fig 4 Apoptosis of DLBCL cells in each group after 72 hours of culture
表2 各组细胞不同时间凋亡率比较Table 2 Comparison of the apoptosis rate of cells in each group at different time
2.5 Transwell小室法检测细胞侵袭结果
WW组与WZ组DLBCL细胞侵袭数量分别为(157±15)个、(156±15)个,ZR组DLBCL细胞侵袭数量(85±9)明显低于WW组、WZ组(P<0.05)(图5)。

图5 各组DLBCL细胞侵袭情况Fig 5 Invasion of DLBCL cells in each group
3 讨论
DLBCL是一种血液系统的侵袭性淋巴瘤[7],目前该病多采用免疫靶向以及化学治疗,但患者预后达不到理想效果。miRNA在细胞的生物过程中起着调控的作用,且与多种肿瘤细胞的发生与发展有着密切的关系,发挥着抑癌或致癌的作用[8]。miR-30b运用转录调节功能调控蛋白的表达,使下游靶基因受其调控发挥效应,从而调控细胞的生物学行为[9]。miR-30b在肺癌细胞中的表达较低,通过转染miR-30b后其表达升高,且转染后弥漫性大B淋巴瘤细胞的侵袭能力有效降低,促使其凋亡[10]。本实验结果与上述结果相似,显示miR-30b在DLBCL中低于正常组织,并随着时间的延长ZR组癌细胞的凋亡数量逐渐增加,说明mir-30b过表达可抑制DLBCL细胞侵袭,从而促进其凋亡。
FHIT是一种转录基因,其灭活性质可能是由于癌症作用于FHIT中的p53基因,致癌因子通过调控p53基因从而导致FHIT外显子缺失,同时增加了FHIT的降解,并造成FHIT基因碱基的活性出现关闭现象[11]。FHIT蛋白抑制肿瘤细胞的产生与发展是通过调节并控制肿瘤细胞的周期以及加速肿瘤细胞凋亡从而达到抑制目的。本文研究发现FHIT在DLBCL中低于正常组织,在ZR组中升高。研究表明,在肺癌、胃癌、乳腺等肿瘤组织中存在FHIT的表达失衡。 宫颈癌中FHIT的水平低于正常宫颈组织,可能与致癌因子使FHIT在宫颈癌中发生了缺失有关[12]。低表达的miR-182-5p通过促进FHIT的表达从而抑制喉鳞癌细胞的发展[13]。本文研究结果与其上述研究结果相似,说明mir-30b抑制DLBCL细胞生物活性可能与调控FHIT蛋白有显著关系。
Caspase-3是细胞凋亡中的一个环节,绝大部分引发细胞凋亡的因素都是经过caspase-3介导的,其作用机制是调控细胞凋亡抑制物并使相关修复因子加速裂解进而达到促进细胞凋亡的作用[14]。Caspase-3在DLBCL中低表达,且与DLBCL临床预后有显著关系[25]。本研究结果显示,DLBCL细胞转染miR-30b 后其caspase3活性较其他两组明显增高,说明,过表达miR-30b可提高弥漫性大B细胞淋巴瘤转染细胞中caspase-3的活性,对肿瘤细胞凋亡有正促进作用。
综上所述,经过转染miR-30b后弥漫性大B细胞淋巴瘤细胞的凋亡增加、侵袭数量减少,其作用机制可能与过表达miR-30b促进FHIT蛋白表达及caspase-3活性有关。

