基于 COI 基因的入侵物种旧金山卤虫遗传多样性与遗传分化研究
付春正 王晖 Alireza Asem 郭慧芳 钱彬彬 刘文茹 沈春阳


摘要:伴随着中国水产养殖业的快速发展,原产美国的旧金山卤虫(Artemiafranciscana)被引入至我国渤海湾地区。为研究旧金山卤虫被引入中国后其基因组遗传多样性改变情况,本研究利用COI线粒体分子标记,评估旧金山卤虫在非原生栖息地,即唐山曹妃甸南堡镇(渤海湾,河北省)定殖的旧金山卤虫的遗传多样性现状。研究分析发现:相比于美国原产地区的旧金山卤虫种群(大盐湖种群和旧金山湾种群),旧金山卤虫南堡种群表现出较为丰富的遗传多样性。而且,旧金山卤虫南堡种群与美国原产地区种群(大盐湖种群和旧金山湾种群)存在显著的遗传分化,表明旧金山卤虫南堡种群并非是从美国大盐湖虫种群和旧金山湾种群直接引入。
关键词:旧金山卤虫;COI基因;遗传多样性;群体遗传结构
外来物种入侵是指生物物种由原产地通过人为或非人为的方式迁移到新的生态环境的过程[1]。外来物种的入侵不仅会影响当地自然环境的生物多样性,还会影响当地的生物群落结构[2]。虽然只有约1%的外来物种会在新的生态环境中成功定殖,但这些成功定殖的外来物种将会给当地的生态环境带来深远的影响和巨大的经济损失[3]。外来物种适应新环境的能力主要取决于该物种的遗传多样性,在入侵新的生态环境过程中,外来物种很可能由于入侵种群个体数量较少引发遗传漂变,进而造成外来物种种群遗传多样性降低,甚至可能会造成外来物种的入侵失败[4-5]。因此,外来物种的遗传多样性是其能否在新的环境中成功入侵和扩张的一个重要因素[4]。
卤虫(BrineShrimp)又名丰年虫,是一种小型甲壳动物,隶属于节肢动物门(Arthropoda),甲壳纲(Crustacea),鳃足亚纲(Branchiopoda),无甲目(Anostraca),卤虫科(Artemiidae),卤虫属(Artemia)[6]。卤虫具有独特的渗透调节机制,可以在高盐(7.0~340g/L)和复杂离子成分等极端环境条件下生存,因此主要栖息于高盐生境中,如内陆盐湖、沿海盐场、盐池和泻湖等,在世界各大陆的盐湖、盐田、海洋等高盐水域均具有广泛的分布[7]。卤虫广泛应用于水产养殖业,是幼鱼、幼虾的理想开口饲料[6,8]。二十一世纪初,伴随着水产养殖业的迅速发展,我国年需卤虫卵超过2000t(粗品),而当时我国年产卤虫卵仅为1200~1500t(粗品)[9]。自1950年起,美国主要卤虫产区(大盐湖和旧金山湾)的卤虫,开始被出口到世界各地的渔业孵化场用于幼鱼、幼虾的养殖。旧金山卤虫(Artemiafranciscana)具有较高的繁殖率和较强的适应性,被许多国家及地区引入以满足水产养殖业的需求,除美洲大陆外,亚欧大陆的诸多区域也有旧金山卤虫的分布[10-12]。
为满足我国水产养殖业的发展需求,旧金山卤虫于1991年首次被引种至我国渤海湾地区,包括:轻工业部制盐研究所实验场、塘沽盐场、汉沽盐场和南堡盐场,使当地卤虫产量提高了30%~100%[13]。历时20余年,旧金山卤虫已遍及我国东部多个沿海地区,其不仅存在于渤海湾地区,在黄海地区及东海地区也有发现旧金山卤虫分布[14]。前人的研究多只利用形态学特征、同工酶遗传标记、微卫星分子标记等研究不同卤虫品种、品系的群体多样性及遗传分化,目前尚未有研究报道利用线粒体细胞色素C氧化酶Ⅰ(COI:CytochromeCoxidasesubunitⅠ)基因研究入侵至中国渤海湾地区的旧金山卤虫种群的遗传多样性及遗传分化。本研究通过对河北省唐山市曹妃甸区南堡镇银海食盐有限公司盐田的旧金山卤虫种群的线粒体COI基因序列进行测序,分析该种群的遗传多样性及遗传结构,并与美国的旧金山卤虫大盐湖种群(TheGreatSaltLake)和旧金山湾种群(SanFranciscoBay)的COI基因序列数据进行比较分析,从而了解入侵至中国渤海湾地区的旧金山卤虫在新环境下的种群遗传分化及适应性变化,为进一步将旧金山卤虫引入至我国其它地区提供理论依据。
1材料与方法
1.1样本来源与基因组DNA提取
本研究使用的旧金山卤虫样本,计20个,采集于河北省唐山市曹妃甸区南堡镇银海食盐有限公司(39°06′N,118°36′E)(以下简称旧金山卤虫南堡种群)(图1)。按照Chelex-100(Bio-Rad,USA)基因组DNA提取方法提取卤虫基因组DNA[15-16]。
1.2COI基因序列扩增及测序
扩增线粒体COI基因引物为1/2COI_Fol、F:5-ATTCTACGAATCACAAGGATATTGG–3、R:5-TACACTTCAGGATGGCCAAAAAATCA–3,引物由北京擎科生物科技有限公司合成[17]。PCR的反應体系为20μL,包括2×EasyTaqPCRSuperMix10μL,ddH2O8μL,正反向引物各0.5μL,DNA模板1μL。PCR反应程序为:95℃预变性3min;94℃变性45s,55℃退火60s,72℃延伸60s,35个循环;72℃终延伸5min,4℃保存。PCR产物经1%的琼脂糖凝胶电泳检测后,送至北京擎科生物科技有限公司进行测序。
1.3数据分析
测序获得的COI基因序列利用MEGAv7026采用默认参数进行序列比对,计算序列碱基组成、变异位点、简约信息位点、自裔位点等参数[18]。利用核苷酸BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)验证测序样本为旧金山卤虫。利用Networkprogramv5.0.0.3中的median-joining算法进行单倍型网络分析,检测样本的遗传分化,从而确定旧金山卤虫南堡种群与美国大盐湖种群及旧金山湾种群的遗传分化关系[19]。旧金山卤虫大盐湖种群及旧金山湾种群的线粒体COI基因序列下载自NCBI核苷酸数据库(https://www.ncbi.nlm.nih.gov/nuccore,表1)[20]。利用软件Arlequinv3.5计算每个群体的多态位点数(S)、单倍型数(h)、单倍型多样性(Hd)、单倍型比(Hr)、核苷酸(基因)多样性(Pi)、平均核苷酸差异数(k)、期望杂合度、群体遗传分化指数(FST)和分子方差分析AMOVA[21]。
2结果與分析
2.1COI基因序列特征
本研究共测序获得20条COI基因序列,利用核苷酸BLAST比对,确定本研究采集的20个卤虫样本均为旧金山卤虫。旧金山卤虫南堡种群样本的COI基因序列具有9个变异位点,包括简约信息位点7个、自裔位点2个。而旧金山卤虫大盐湖种群样本的COI基因序列具有11个变异位点,包括简约信息位点7个、自裔位点4个;旧金山卤虫旧金山湾种群样本的COI基因序列含有7个变异位点,包括简约信息位点6个、自裔位点1个。
2.2种群遗传多样性
旧金山卤虫南堡种群、大盐湖种群及旧金山湾种群的遗传多样性信息见表2。相比于旧金山卤虫大盐湖种群和旧金山湾种群,旧金山卤虫南堡种群具有较高的单倍型多样性和核苷酸多样性,这表明,相比于美国本土的旧金山卤虫种群,入侵并定殖于中国唐山市南堡地区的旧金山卤虫种群具有更丰富的遗传多样性。
2.3种群遗传结构
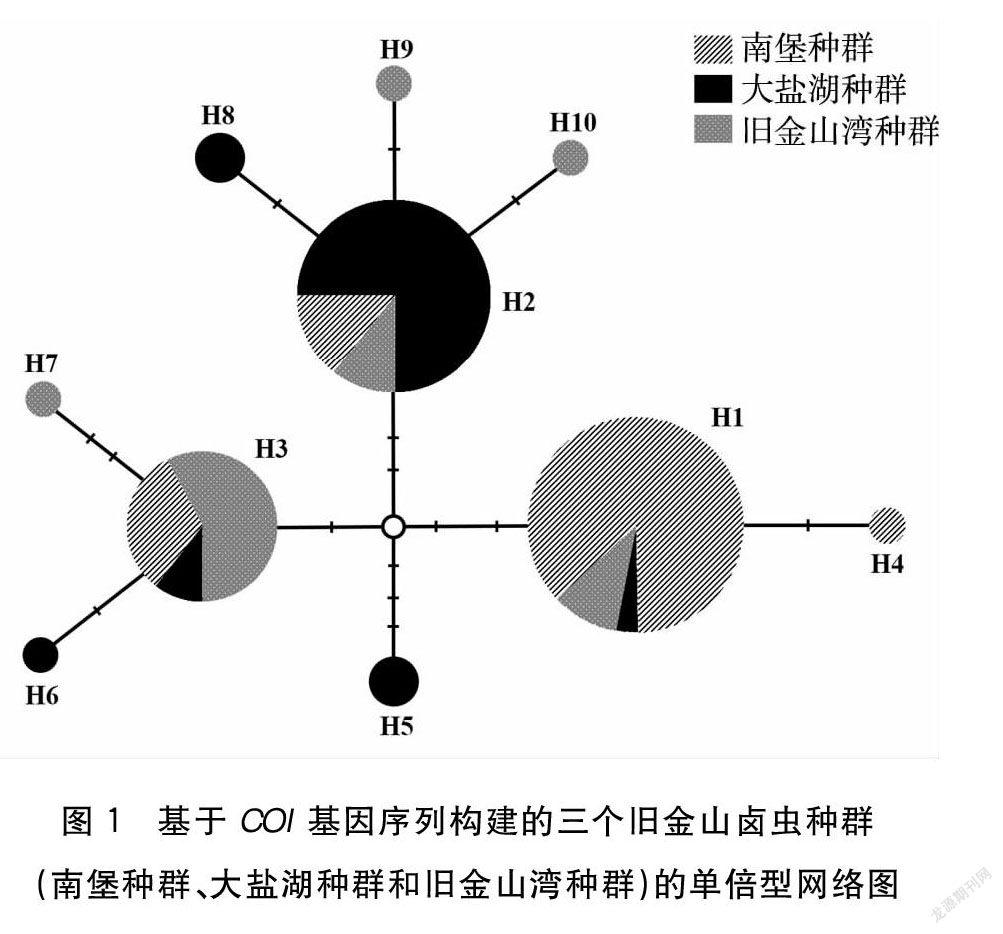
基于旧金山卤虫南堡种群、大盐湖种群及旧金山湾种群共计86个样本的COI基因序列共检测到10种单倍型,其中H1、H2和H3为主要单倍型,分别占总数的34.88%(30个样本)、3256%(28个样本)和22.10%(19个样本),见图1、表3。旧金山卤虫南堡种群样本分布在6个单倍型中,主要单倍型为H3型(55.00%),见图1、表4。H3型分别由57.89%的南堡种群样本、10.52%的大盐湖种群样本和31.59%的旧金山湾种群样本组成(见图1、表5)。旧金山卤虫大盐湖种群样本分布在6个单倍型中,主要单倍型为H2型(72.40%)。H2型分别由75.00%的大盐湖种群样本、10.72%的南堡种群样本和1428%的旧金山湾种群样本组成(见图1、表4、表5)。旧金山湾种群分布在4个单倍型中,主要单倍型为H1型(70.27%)。H1型分别由8666%的旧金山湾种群样本、10.00%南堡种群样本和3.34%大盐湖种群样本组成(见图1、表4、表5)。
旧金山卤虫南堡种群、大盐湖种群及旧金山湾种群三个种群两两之间均存在显著的遗传分化(P=0.0001),南堡种群和大盐湖种群的遗传分化指数值(FST)最低,为0.29;大盐湖种群和旧金山湾种群的遗传分化指数值(FST)最高,为0.56(见表6)。三个旧金山卤虫种群的分子方差分析(AMOVA)表明,旧金山卤虫的遗传变异主要来源于种群内部个体之间,占总变异的55.01%,种群之间的遗传变异占44.99%(见表7)。
3讨论与结论
3.1旧金山卤虫南堡种群的遗传多样性
外来物种在被引入至新环境后,通常由于奠基者效应或者种群定殖过程中的群体遗传瓶颈效应等因素,会导致引入种群的遗传多样性较低[15,22]。如越南永州地区引入的旧金山卤虫种群,相比于种源地旧金山湾的旧金山卤虫种群,其表现出更低的种内遗传变异和更少的单倍型多样性[23]。然而相比于美国大盐湖地区的旧金山卤虫种群,亚洲地区引入的旧金山卤虫种群表现出相对较高的遗传多样性[24]。地中海卤虫的引入种群中也发现了相似的结果[25-26]。本研究也发现,相比旧金山卤虫种源地种群(大盐湖种群和旧金山湾种群),引入并定殖于中国渤海湾地区的南堡种群表现出较为丰富的遗传多样性。在新环境中引入并定殖的种群可能是由于自身具有较强的适应能力和生理可塑性,在不同选择压力的作用下,引入种群的遗传分化模式受到一定影响,进而表现出了相对较高的遗传多样性[3,4,24,26-27]。
3.2旧金山卤虫南堡种群的引种来源
线粒体基因组DNA具有进化速率快、母系遗传和缺乏重组的特征,因此线粒体基因组分子标记对于分析在新环境中定殖的外来物种的来源和系统分化具有重要的作用[28-29]。利用线粒体COI基因作为分子标记进行的系统地理分析表明:地中海区域的入侵旧金山卤虫种群来源于美国的大盐湖种群和旧金山湾种群,而亚洲引入的旧金山卤虫种群的定殖过程经历了多次种源引入,即首先由美国的种源地群体引入,而后又经历了欧洲群体的二次引入[24,26,28]。本研究中,旧金山卤虫南堡种群、大盐湖种群及旧金山湾种群共检测到10种单倍型,其中H1、H2和H3为主要单倍型,分别以旧金山湾种群(86.66%)、大盐湖种群(75%)和南堡种群(57.89%)为主。这一结果表明旧金山卤虫南堡种群并非来源于大盐湖种群和旧金山湾种群。旧金山卤虫南堡种群与大盐湖种群及旧金山湾种群具有显著的群体遗传分化指数FST值也表明:旧金山卤虫南堡种群并非来源于大盐湖种群和旧金山湾种群。旧金山卤虫南堡种群可能从其他旧金山卤虫入侵地区间接引入的,如东亚的湄公河三角洲(越南)和渤海湾(中国)地区,这些地区旧金山卤虫已经完全商品化并可在水产养殖市场上购买获得[15,26,30]。
本研究通过利用河北省唐山市曹妃甸区南堡镇银海食盐有限公司盐田的旧金山卤虫种群的线粒体COI基因进行测序,分析该种群的遗传多样性及遗传结构,并与美国的大盐湖种群和旧金山湾种群的线粒体COI基因测序数据进行比较分析,发现相比于美国本土的旧金山卤虫种群,入侵并定殖于中国唐山市南堡地区的旧金山卤虫种群具有更丰富的遗传多样性。而且旧金山卤虫南堡种群与美国大盐湖种群和旧金山湾种群存在显著的遗传分化,表明旧金山卤虫南堡种群并非是从美国大盐湖种群和旧金山湾种群直接引入的。与陆地、海洋及淡水环境相比,高盐生境系统的物种种类和数量通常有限,这使得高盐生境内的生物多样性更加脆弱,而外来物种的引入将对高盐生境内的生物多样性带来更大的威胁。旧金山卤虫作为渤海湾区域高盐生境的外来物种,对于渤海湾的高盐环境有较好的适应,表现出较为丰富的遗传多样性,因此后续研究可将旧金山卤虫作为高盐生境中入侵生物的模式生物,研究外来物种对高盐生境的生物效应,尤其是研究旧金山卤虫的引入对于高盐生境内其它生物遗传变异模式的影响。
参考文獻:
[1]付保荣,崔晓男,褚阔,等.辽宁省外来物种入侵防控对策与建议[J].环境保护与循环经济,2021,41(1):44-49.
[2]OLDENJD,POFFNLR,DOUGLASMR,etal.Ecologicalandevolutionaryconsequencesofbiotichomogenization[J].TrendsinEcology&Evolution,2004,19(1):18-24.
[3]PIMENTELD,ZUNIGAR,MORRISOND.Updateontheenvironmentalandeconomiccostsassociatedwithalien-invasivespeciesintheUnitedStates[J].EcologicalEconomics,2005,52(3):273-288.
[4]DLUGOSCHKM,PARKERIM.Foundingeventsinspeciesinvasions:geneticvariation,adaptiveevolution,andtheroleofmultipleintroductions[J].MolecularEcology,2008,17(1):431-449.
[5]LAVERGNES,MOLOFSKYJ.Increasedgeneticvariationandevolutionarypotentialdrivethesuccessofaninvasivegrass[J].ProceedingsoftheNationalAcademyofSciences,2007,104(10):3883-3888.
[6]毕久勤.开发盐田新资源—盐田卤虫[J].海湖盐与化工,1992,21(2):22-24.
[7]VANSTAPPENG.Zoogeography[M].Dordrecht:Springer,2002:171-224.
[8]SORGELOOSP,DHERTP,CANDREVAP.Useofthebrineshrimp,Artemiaspp.,inmarinefishlarviculture[J].Aquaculture,2001,200(1-2):147-159.
[9]沈海燕.卤虫资源的开发利用[J].特种经济动植物,2002,5(8):14.
[10]AMATF,HONTORIAF,NAVARROJC,etal.BiodiversitylossinthegenusArtemiainthewesternMediterraneanregion[J].Limnetica,2007,26(2):387-404.
[11]AMATF,HONTORIAF,RUIZO,etal.TheAmericanbrineshrimpasanexoticinvasivespeciesinthewesternMediterranean[J].BiologicalInvasions,2005,7(1):37-47.
[12]HORVATHZ,LEJEUSNEC,AMATF,etal.EasternspreadoftheinvasiveArtemiafranciscanaintheMediterraneanBasin,withthefirstrecordfromtheBalkanPeninsula[J].Hydrobiologia,2018,822(1):229-235.
[13]张波,郭金昌,商占恒,等.旧金山湾卤虫(Artemiafranciscana)在中国渤海湾地区的引种[J].海盐湖与化工,1993,22(3):7-9.
[14]ZHENGB,SUNS-C.ReviewofthebiogeographyofArtemiaLeach,1819(Crustacea:Anostraca)inChina[J].InternationalJournalofArtemiaBiology,2013,3(1):20-50.
[15]ASEMA,EIMANIFARA,LIWD,etal.Phylogeographyandpopulationgeneticstructureofanexoticinvasivebrineshrimp,ArtemiaLeach,1819(Crustacea:Anostraca),inAustralia[J].AustralianJournalofZoology,2018,66(5-6):307-316.
[16]ASEMA,EIMANIFARA,SUNSC.GeneticvariationandevolutionaryoriginsofparthenogeneticArtemia(Crustacea:Anostraca)withdifferentploidies[J].ZoologicaScripta,2016,45(4):421-436.
[17]MUOZJ,G MEZA,GREENAJ,etal.PhylogeographyandlocalendemismofthenativeMediterraneanbrineshrimpArtemiasalina(Branchiopoda:Anostraca)[J].MolecularEcology,2008,17(13):3160-3177.
[18]KUMARS,STECHERG,TAMURAK.MEGA7:Molecularevolutionarygeneticsanalysisversion7.0forbiggerdatasets[J].MolecularBiologyandEvolution,2016,33(7):1870-1874.
[19]BANDELTHJ,FORSTERP,ROHLA.Median-joiningnetworksforinferringintraspecificphylogenies[J].MolecularBiologyandEvolution,1999,16(1):37-48.
[20]MUOZJ,AMATF,GREENAJ,etal.BirdmigratoryflywaysinfluencethephylogeographyoftheinvasivebrineshrimpArtemiafranciscanainitsnativeAmericanrange[J].PeerJ,2013,1(2):e200.
[21]EXCOFFIERL,LISCHERHEL.Arlequinsuitever3.5:anewseriesofprogramstoperformpopulationgeneticsanalysesunderLinuxandWindows[J].MolecularEcologyResources,2010,10(3):564-567.
[22]GOLANID,AZZURROE,CORSINI-FOKAM,etal.Geneticbottlenecksandsuccessfulbiologicalinvasions:thecaseofarecentLessepsianmigrant[J].BiologyLetters,2007,3(5):541-545.
[23]KAPPASI,ABATZOPOULOSTJ,VANHOAN,etal.GeneticandreproductivedifferentiationofArtemiafranciscanainanewenvironment[J].MarineBiology,2004,146(1):103-117.
[24]EIMANIFARA,VANSTAPPENG,MARDENB,etal.ArtemiabiodiversityinAsiawiththefocusonthephylogeographyoftheintroducedAmericanspeciesArtemiafranciscanaKellogg,1906[J].MolecularPhylogeneticsandEvolution,2014,79(1):392-403.
[25]HONTORIAF,RED NS,MACCARIM,etal.ArevisionofArtemiabiodiversityinMacaronesia[J].AquaticBiosystems,2012,8(1):25.
[26]MUOZJ,G MEZA,FIGUEROLAJ,etal.ColonizationanddispersalpatternsoftheinvasiveAmericanbrineshrimpArtemiafranciscana(Branchiopoda:Anostraca)intheMediterraneanregion[J].Hydrobiologia,2014,726(1):25-41.
[27]VIKASPA,SAJESHKUMARNK,THOMASPC,etal.AquaculturerelatedinvasionoftheexoticArtemiafranciscanaanddisplacementoftheautochthonousArtemiapopulationsfromthehypersalinehabitatsofIndia[J].Hydrobiologia,2012,684(1):129-142.
[28] ASHTONGV,STEVENSM,HARTMC,etal.MitochondrialDNArevealsmultipleNorthernHemisphereintroductionsofCaprellamutica(Crustacea,Amphipoda)[J].MolecularEcology,2008,17(5):1293-1303.
[29]BOOREJL.Animalmitochondrialgenomes[J].NucleicAcidsRes,1999,27(8):1767-1780.
[30]VANSTAPPENG,YUHY,WANGXM,etal.OccurrenceofallochthonousArtemiaspeciesintheBohaiBayarea,PRChina,asconfirmedbyRFLPanalysisandlaboratoryculturetests[J].FundamentalandAppliedLimnology,2007,170(1):21-28.
StudyongeneticDiversityandgeneticdifferentiationofinvasiveArtemiafranciscanabasedonCOIgene
FUChunZheng1,WANGHui1,AlirezaASEM2,GUOHuiFang3,QIANBinBin4,LIUWenRu4,SHENChunyang3
(1.InstituteofSericulture,ChengdeMedicalUniversity,Chengde067000,China;2.CollegeofFisheriesandLifesciences,HainanTropicalOceanUniversity,Sanya572000,China;3.SchoolofBasicMedicalSciences,ChengdeMedicalUniversity,Chengde067000,China;4.JinmingmiddleschoolofTangshan,Tangshan063000,China)
Abstract:WiththerapiddevelopmentofaquacultureinChina,Artemiafranciscana,whichoriginatedintheUnitedStates,hasbeenintroducedtotheBohaiBayareaofChina.InordertostudythechangesofgenomicgeneticdiversityofArtemiafranciscanasinceitwasintroducedintoChina,COImitochondrialmolecularmarkerwasusedtoevaluatethegeneticdiversityofArtemiafranciscanacolonizedinNanbaoTown,Caofeidian,Tangshan(BohaiBay,HebeiProvince).ItwasfoundthatcomparedwithArtemiafranciscanapopulationinGreatSaltLakeandSanFranciscoBay,ArtemiafranciscanainNanpushowedrichgeneticdiversity.Moreover,therewassignificantgeneticdifferentiationbetweenArtemiafranciscanainNanpuandAmericannativepopulation(GreatSaltLakeandSanFranciscoBaypopulation),indicatingthatArtemiafranciscanainNanpuwasindirectlyintroducedfromAmericanGreatSaltLakeSanFranciscoBay.
Keywords:Artemiafranciscana;COIgene;Geneticdiversity;Populationgeneticstructure
(收稿日期:2021-11-27)

