黑骨藤中强心苷类成分研究进展
张 驰,杨燕玲,陈 垒,刘 涛
(1. 赣南医学院药学院;2. 江西赣南海欣药业股份有限公司,江西 赣州 341000)
黑骨藤(Periploca forrestiiSchltr.)为萝藦科,杠柳属植物,别名又称为黑骨藤、飞仙藤、青蛇胆、黑骨头、达风藤(云南)、西南杠柳(俗称)等。植株有小毒,叶含强心甙,全株可供药用。依据传统中医药理论,黑骨藤具有祛风除湿、舒筋活络的功效,临床可用于治疗风湿性关节炎、跌打损伤、胃痛、消化不良、闭经、疟疾等症[1-2]。黑骨藤作为草藤科类最为有效的风湿治疗药物, 在民间被称为“万藤之王”[3]。
现代药理学研究表明,黑骨藤具有多种生物活性,包括抗炎、促进伤口愈合、抗肿瘤、强心作用等[4-6]。植物化学研究发现,黑骨藤中化学成分结构多样,其中强心苷是其主要成分之一,也被认为是黑骨藤发挥多种生物学功能的重要物质基础[7]。作为黑骨藤中一类重要的天然产物,强心苷一直备受关注,被学者们广泛研究。目前,黑骨藤在临床已得到广泛应用,然而其确切的活性物质基础或活性物质群仍未得到明确归属,作用机制也有待进一步研究。
本文对黑骨藤的传统用法、药物分析方法及毒理作用研究进展进行综述,并聚焦于其中的强心苷类成分,重点介绍其化学成分和药理活性,从植物化学和药理作用的角度揭示其传统用法的现代生物学内涵,为黑骨藤的后续研究与开发提供思路。
1 植物特征与分布
黑骨藤(Periploca forrestiiSchltr.)为萝藦科(Asclepiadaceae),杠柳属(Periploca)植物。藤状灌木,长达10 m,具乳汁,多分枝,全株无毛。叶革质,披针形,长3.5~7.5 cm,宽5~10 mm,顶端渐尖,基部楔形;中脉两面略凸起,侧脉纤细,密生,几平行,两面扁平,在叶缘前连结成1条边脉;叶柄长1~2 mm。聚伞花序腋生,比叶为短,着花1~3 朵;花序梗和花梗柔细;花小,黄绿色;花萼裂片卵圆形或近圆形,长1.5 mm,无毛;花冠近辐状,花冠筒短,裂片长圆形,长2.5 mm,两面无毛,中间不加厚,不反折;副花冠丝状,被微毛;花粉器匙形,四合花粉藏在载粉器内;雄蕊着生于花冠基部,花丝背部与副花冠裂片合生,花药彼此粘生,包围并粘在柱头上;子房无毛,心皮离生,胚珠多个,柱头圆锥状,基部具五棱。蓇葖双生,长圆柱形,长达11 cm,直径5 mm;种子长圆形,扁平,顶端具白色绢质种毛;种毛长3 cm。花期3~4 月,果期6~7 月。黑骨藤生于海拔2 000 m以下山地疏林向阳处或荫湿的杂木林下或灌木丛中,主要分布于西藏、青海、四川、贵州、云南和广西等地[1]。
2 传统用法
黑骨藤始载于《滇南本草》,如今在《中国植物志》和《中华本草》以及一些地方药用植物志等均有收录。于秋冬季采收,洗净,切片或切段后晒干,根或全株可作药用。根据中药药性理论,其味辛、苦,性热,有小毒,入冷经。具有祛风除湿,舒筋活络的功效,因此常用于类风湿性关节炎、跌打损伤、骨折、胃痛、牙痛、消化不良、闭经、疟疾等疾病的治疗。临床使用中,内服(3~6 g 煎汤或泡酒)和外用(适量药材捣烂外敷)均可。例如,黑骨藤15 g 和大青藤根9 g 泡酒服,可用于风湿关节痛的治疗,同时温酒擦拭患处。黑骨藤9 g 温酒煎服可用于治疗跌打损伤后筋骨疼痛。黑骨藤6 g、红糖5 g 水煎服可用于治疗牙痛。以黑骨藤、大风藤和追风伞按30∶20∶17 比例配伍而成的复方制剂“黑骨藤追风活络胶囊”,具有祛风除湿,通络止痛的功效,治疗风寒湿痹、肩臂腰腿疼痛,对于肝炎、溃疡病患者禁服,一日用量不宜超过10 g。过量会出现抽搐,甚至死亡[2]。
3 强心苷类成分
通过调研国内外文献,截至目前,从黑骨藤中一共分离和鉴定了28 种强心苷类成分。其中化合物(5、8、9、10、12、15、18、28)是通过质谱裂解规律鉴定得到。结构差异主要表现为C-3、5、7、8、14 位羟基个数和位置不同以及C-3 位糖的类型和个数不同。具 体 化 学 结 构 和 相 应 参 考 文 献[5,8-12]见 表1和图1。
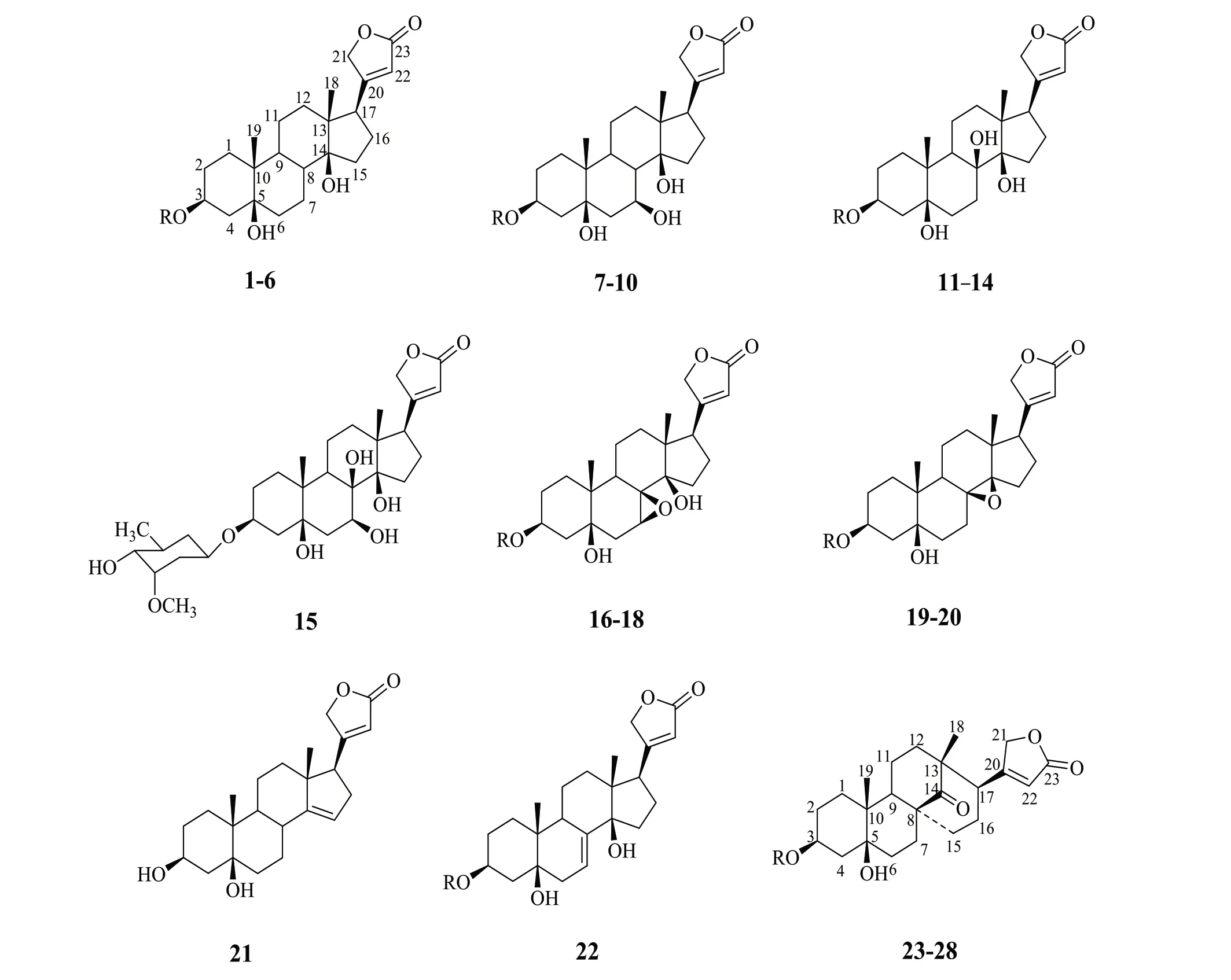
图1 黑骨藤中分离得到的强心苷类化合物
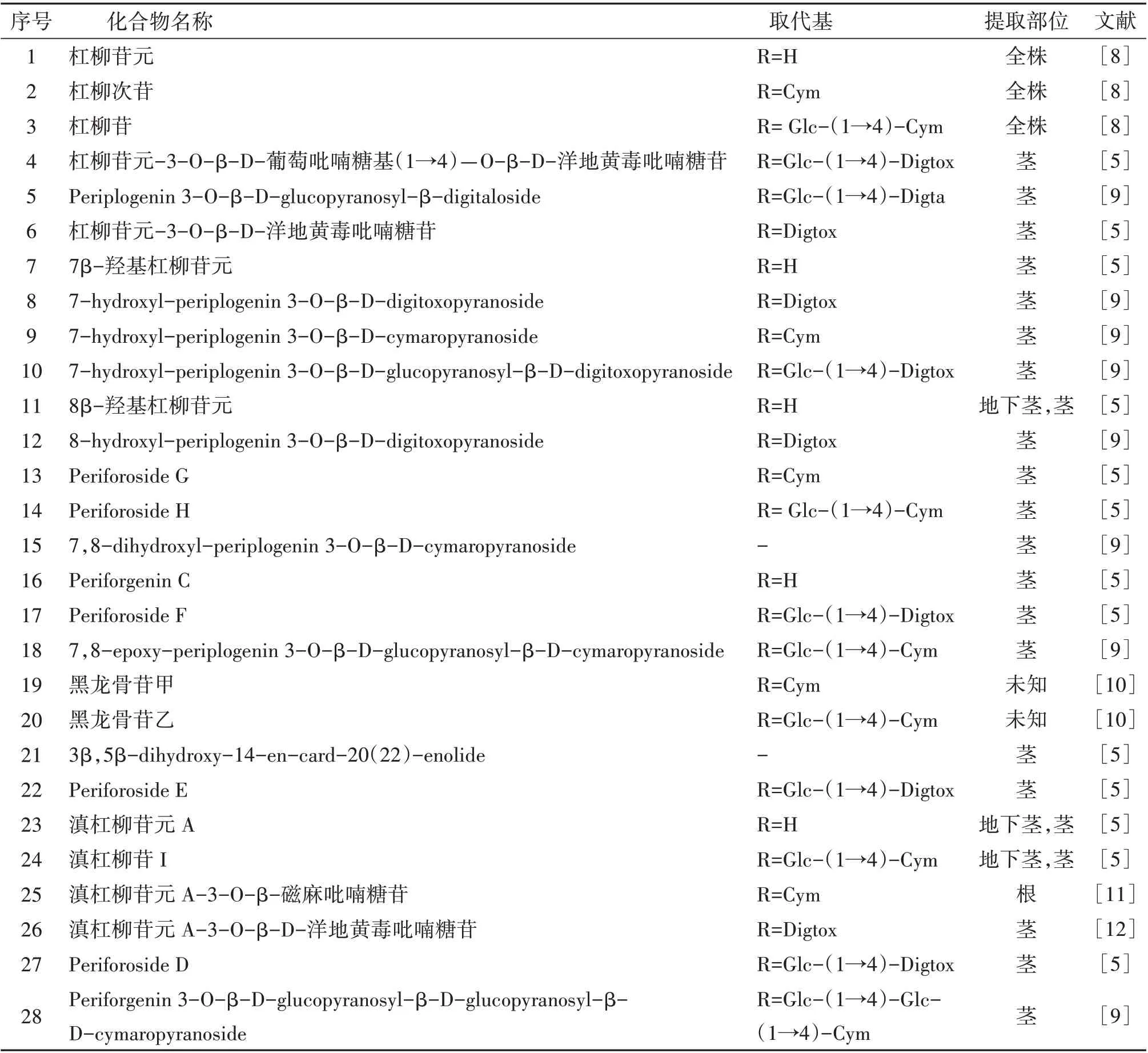
表1 黑骨藤中分离鉴定的强心苷类化合物
4 药理作用
4.1 抗炎在临床实践中,黑骨藤常用于治疗类风湿性关节炎,这与中医“祛风除湿”的理论一致。例如,黑骨藤追风活络颗粒是一个以黑骨藤为主要成分的抗风湿中药复方制剂,被(中国)国家食品药品监督管理局批准作为治疗关节炎的OTC 药。KANG Z 等[13]通过生物信息学探讨了该复方制剂治疗类风湿性关节炎的作用机制,并在胶原蛋白诱导的关节炎(Collagen-induced arthritis, CIA)小鼠和U937细胞上进行了验证。结果显示,该复方制剂主要通过阻断IL-12 信号通路活化,抑制炎性细胞浸润和关节肿胀,从而发挥对关节炎的治疗作用。
大量研究均表明,黑骨藤具有显著的抗炎作用,然而其抗炎活性成分目前未有统一的结论。刘明等[14]考查了黑骨藤水、正丁醇、氯仿、醋酸乙酯、石油醚等不同萃取部位的抗炎镇痛作用。结果显示,灌胃给药后,黑骨藤各提取部位对醋酸诱导的小鼠扭体反应均表现出抑制作用,其中黑骨藤正丁醇提取部位高剂量组(3 g·kg-1)效果最好,其疼痛抑制率为80.2%,同时正丁醇部位对小鼠肉芽湿质量和干质量也表现出抑制作用。以上结果证明了正丁醇部位是黑骨藤抗炎镇痛的有效部位,而正丁醇对强心苷类成分萃取效果较好,因此我们推测黑骨藤的抗炎镇痛作用可能与其中的强心苷类成分有关。
BAO C M 等[15]对 黑 骨 藤 根 部 进 行 回 流 提 取(70%乙醇),提取液石油醚脱脂后利用正丁醇进行萃取获得强心苷富集部位。干浸膏以50 mg·kg-1剂量进行小鼠灌胃给药,研究强心苷富集部位对胶原蛋白诱导的关节炎(CIA)的治疗作用。他们发现强心苷部位能抑制NF-κB p65磷酸化和阻断AP-1/c-Fos转录活性,降低炎症因子如IgG2a、TNF-α的表达,并且在CIA 小鼠和破骨细胞分化因子(Receptor activator for nuclear factor-κB ligand,RANKL)诱导形成的破骨细胞中,下调Toll 样受体4(Toll-like receptor 4, TLR4)、信号传导与转录激活因子3(Signal transducer and activator of transcription 3, STAT3)和MMP-9 的表达。同时,研究发现,杠柳苷(黑骨藤中的代表性强心苷成分)能以剂量依赖的方式(0.5~10 μg·mL-1)抑 制RANKL 诱 导 的 破 骨 细 胞 形 成。LIU Y Q 等[16]也通过大鼠灌胃给药治疗,评价了黑骨藤强心苷提取部位对佐剂诱导的大鼠关节炎(Adjuvant-induced arthritis, AIA)的治疗作用。同样地,强心苷部位(50 mg·kg-1)能改善关节病理变化,降低AIA 大鼠脾细胞IL-6 和TGF-β1水平,抑制关节滑膜STAT3 和IKK-α 蛋白磷酸化。同时,他们也证明,黑骨藤中主要强心苷类成分杠柳苷(Periplocin)能抑制脂多糖(Lipopolysaccharide,LPS)诱导的AIA大鼠脾细胞和滑膜细胞中关键促炎细胞因子的生成。LIU T 等[17]也证实黑骨藤强心苷富集部位口服给 药 后(125 mg·kg-1,250 mg·kg-1和500 mg·kg-1)能抑制CIA大鼠关节肿胀,改善踝关节病理损伤,降低血清类风湿因子(Rheumatoid factor,RF)、TNF-α、IL-6、IL-1β、PGE2、NO 和MDA 水平,以及上调血清SOD活性。其抗炎作用机制与NF-κB和MAPK信号通路抑制有关。
CHEN L 等[18]研究证实,黑骨藤乙醇提取物灌胃给药后(200~400 mg·kg-1)能改善胶原蛋白诱导的关节肿胀和炎性浸润,降低血清中IL-1β、TNF-α 和IL-6水平,并揭示其抗炎作用机制与Src/NF-κB信号通路抑制有关。同时,通过HPLC-QTOF-MS/MS 液质联用技术从总提物中一共鉴定了38个化合物,其中强心苷或苷元14 个[6]。众所周知,强心苷是Na/K-ATPase 的常见配体。研究发现,Na/K-ATPase 除了离子泵活性外,还具有受体功能,能与Src 相互作用,形成一个复合受体,诱导酪氨酸蛋白磷酸化和下游信号通路活化,引起多种生物学效应,包括细胞增殖、迁移和炎症反应等[19]。因此,他们也推测黑骨藤治疗关节炎的分子作用机制可能与强心苷类成分和Na/K-ATPase 的相互作用有关,通过与Na/K-ATPase 结合,抑制Src 活化,从而阻断NF-κB p65磷酸化以及核转位,抑制COX-2 表达和TNF-α、IL-6和PGE-2等炎性介质的释放[18]。
4.2 伤口愈合中医理论认为,黑骨藤具有“舒筋活络”的作用, 民间也广泛用于跌打损伤。如黑骨藤伸筋透骨喷雾剂是以黑骨藤为君药,由13种天然药用植物组成的中药复方制剂,可用于治疗急性软组织损伤。曹晴晴等[20]通过临床试验评价该喷雾剂对急性软组织损伤的疗效和安全性。将80 例急性软组织损伤患者随机分为黑骨藤伸筋透骨喷雾组(治疗组)和对照组。治疗组用黑骨藤伸筋透骨喷雾剂擦拭伤口,每次10~20 滴(约2~3 mL),一日3次;对照组采用正骨水,每次10~20 滴(约2~3 mL),一日3 次。治疗10 天后,治疗组在疼痛、肿胀、关节功能改善方面优于对照组,有效率为96.67%,证实了该喷雾剂具有治疗急性软组织损伤的疗效且无毒副作用。
伤口愈合由4 个连续又相互交错的时期组成,其中增殖期是伤口修复的关键阶段。该时期成纤维细胞、角质细胞和内皮细胞大量增殖、血管新生,和胶原蛋白一起形成肉芽组织[21]。LI J S 等[22]通过L929 小鼠成纤维细胞评价了黑骨藤的促伤口愈合作用。与对照组相比,50 μg·mL-1的黑骨藤茎部乙醇提取液孵育24 h 后,能够显著促进成纤维细胞增殖,其增殖作用高达168%。同时促进L929 细胞分泌胶原蛋白和迁移。通过大孔吸附树脂,分离筛选得到65%乙醇洗脱部位为活性部位,并利用HPLCQTOF-MS/MS 液质联用技术鉴定其主要成分为强心苷类。为了阐明活性部位促创口愈合的作用机制,将活性部位制成浓度为0.1%(g/g)的水凝胶。治疗10~12 天后,大鼠皮肤伤口面积由13.3%缩小至5.3%,与重组牛碱性成纤维细胞生长因子(rbFGF)阳性对照组(4.0%)相当,并且远小于正常对照组(22.1%)。同时研究发现,活性部位能够促进成纤维细胞增殖和迁移,刺激胶原蛋白分泌,促使肉芽组织快速形成。其作用机制与Src介导的MEK/ERK和PI3K/Akt信号通路活化有关[22]。
接下来,对65%乙醇活性部位中的杠柳苷进行了系统地体内和体外促伤口愈合活性评估和作用机制阐明。10 μM 的杠柳苷作用48 h 后,能促进L929 细胞增殖、迁移和分泌胶原蛋白,此过程依赖于Src/ERK 和PI3K/Akt通路的激活。与体外结果一致,在大鼠全层皮肤切除伤口模型中,杠柳苷也表现出显著的促伤口愈合作用,20 μg·mL-1的杠柳苷(每天给药1 次,每次200 μL)治疗9 天后,相比对照组(34%),其伤口面积缩小至7%。HE 组织病理分析也显示,给药后能显著促进伤口再上皮化和肉芽组织形成。已知Na/K-ATPase 和Src 可以通过两对结构域相互作用组合成一个复合受体,介导下游信号的转导。为了验证Na/K-ATPase 在杠柳苷介导的伤口愈合中的调控作用,选择性地对Na/K-ATPase α1亚基进行敲减。结果发现,在敲减Na/K-ATPase α1亚基后,杠柳苷无法有效激活Src/ERK 和PI3K/Akt信号通路,促增殖作用也显著减弱。因此我们推测,杠柳苷促伤口愈合作用是由Na/K-ATPase 介导的Src/ERK和PI3K/Akt通路活化所介导。此外,杠柳苷能降低单核细胞炎症浸润,降低创面组织中IL-1β、TNF-α 水平,表现出一定的抗炎作用。由于剧烈的炎症反应不利于创面愈合,所以其抗炎活性也可能对伤口愈合起到一定的作用[23]。WANG X Y 等[24]检测了杠柳苷对内皮细胞的增殖作用,MTT和BrdU掺入实验均显示,杠柳苷能够促进内皮细胞增殖,进而有利于血管新生。而血管新生对于伤口肉芽组织形成是一个至关重要的步骤。
4.3 抗肿瘤现代药理研究发现,黑骨藤尤其是其中的强心苷类成分具有显著的抗肿瘤作用。LI Y等[5]从黑骨藤茎中分离出一系列强心苷成分,活性筛选结果显示,这些强心苷类成分对5 种不同的人癌 细 胞 株(HCT-8,大 肠 癌;BEL-7402,肝 癌;BGC823,胃癌;A549,肺癌;A2780,卵巢癌)具有显著的细胞毒性,IC50值范围为0.06~6.52 μM。阿霉素作为阳性对照,对于不同的细胞株,其IC50值为0.13~0.66 μM。其中Periforoside E 对5种人癌细胞系的活性最为显著,其IC50值仅为0.06~0.29 μM。
通过对化合物的结构特征和抗肿瘤活性进行比较,初步总结其构效关系。首先,糖苷元的活性比C-3 位糖链的强心苷低约10~100 倍,表明C-3 位的亲水基团对细胞毒活性至关重要。其次,以烯烃>环氧>8-羟基>7-羟基顺序取代C-7 和C-8 后,其细胞毒活性依次下降。第三,C/D 环结构和C-14 羟基在细胞毒活性中起重要作用。同时,他们也推测强心苷类成分抗肿瘤机制与Na/K-ATP酶结合有关,通过相互作用促发一系列分子生物学事件和蛋白激酶活化,如Src、EGFR和p42/44丝裂原活化蛋白激酶活化,线粒体活性氧(Reactive Oxygen Species,ROS)增加,最终通过细胞凋亡或自噬相关机制诱导肿瘤细胞死亡[5]。XIE J X 等[19]已对该假设进行了广泛论证,并认为强心苷可能作为一种新型抗肿瘤药物,通过靶向调节Na/K-ATP酶及其相关信号通路对肿瘤进行杀伤。
此外,杠柳苷孵育24~48 h后, 对胃癌细胞表现出剂量依赖性的抑制作用,并能通过ERK1/2-EGR1通路诱导其凋亡[25]。50~200 ng·mL-1的杠柳苷单独使用或与TRAIL 合用均能诱导ESCC 细胞凋亡。其机制可能是下调FoxP3,促进DR4/DR5 的表达,使ESCC 细胞对TRAIL 更加敏感,发挥协同作用[26]。杠柳苷元(Periplogenin)在体外对HaCaT 细胞具有选择性的细胞毒作用(IC50=1.56 μg·mL-1),在体内具有抗银屑病的作用。其作用机制与ROS 介导的HaCaT 细 胞 渐 进 性 坏 死(Necrobiotic cell death)有关[27]。
4.4 强心作用强心苷是Na/K-ATPase 的常见配体,在心肌细胞收缩中起重要作用。但迄今为止关于黑骨藤中强心苷对Na/K-ATPase 及心肌细胞收缩的影响研究仍较少。近来,一项研究评估了黑骨藤正丁醇部位对大剂量阿霉素所致大鼠急性心力衰竭的保护作用及其机制。结果表明,黑骨藤醇提物正丁醇部位对阿霉素所致急性心衰具有显著的预防作用,可能是由于黑骨藤醇提物正丁醇部位中强心苷类成分含量过低,其对心肌细胞Na/K-ATPase 酶无明显影响[28]。另一项研究[29]揭示了黑骨藤根的乙醇提取物的乙酸乙酯部分对离体青蛙心脏的强心作用。分别用1.74 mg·mL-1和3.48 mg·mL-1剂量的乙酸乙酯部分灌注离体青蛙心脏,与正常对照组相比,使用醋酸乙酯部分治疗后心肌平均收缩力明显下降,但对心率无明显影响。随着细胞外Ca2+浓度的增加,乙酸乙酯部分对离体青蛙心脏收缩的抑制作用也逐渐增强。乙酸乙酯部分能抑制离体青蛙心脏的收缩活性,并有一定的负性肌力作用,但不影响心脏组织中Na/K-ATPase 的活性。其机制可能与Ca2+-Mg2+-ATPase 活性的增加、AChE 活性的抑制、细胞膜钙通道的阻断以及M 受体的激活和β 受体的阻断有关[29]。
5 药物分析
5.1 定性分析CHEN L 等[6]建立了一个HPLCQTOF-MS/MS 液质联用方法,对黑骨藤总提物进行了化学表征和鉴定。通过标准品和文献信息对比精确分子量、相应碎片离子和保留时间,最后一共从黑骨藤中分析鉴定了38 个化合物,其中14 个强心苷或苷元、8个酚酸类、10个三萜类、2个甾体和其他成分。LI Y 等[9]通过液质连用(HPLC-DAD/ESI-MSn)和液核连用(HPLC/NMR)实现了对黑骨藤中微量强心苷的在线分析。首先对分离得到的9个强心苷进行质谱裂解规律总结和关键核磁信号分析,然后将所总结的规律应用于鉴定结构相似的其他强心苷类成分。最后,通过精确分子质量、代表性碎片离子和特征性的1H NMR 信号,从黑骨藤中一共鉴定了9 个微量强心苷类化合物。其中1 个化合物首次在黑骨藤中报道,另外8个均为新化合物。
5.2 定量分析强心苷是黑骨藤中一类非常重要的代表性成分,因此目前国内外学者主要以强心苷作为指标性成分来建立相应的定量分析方法,从而对黑骨藤及相应中成药进行质量控制和评价。张宏等[30]以乙腈-水(27∶73)作为流动相,检测波长221 nm,通过高效液相色谱法对不同产地黑骨藤中杠柳苷含量进行分析。徐宏等[31]以乙腈-水作为流动相进行梯度洗脱,检测波长214 nm,通过反相高效液相色谱法对黑骨藤中的滇杠柳苷Ⅰ进行含量测定。强心苷的紫外吸收主要来自五元不饱和内酯环,其吸收强度弱,最大吸收波长在217 nm 左右。因此,由于信号响应弱、低分辨率和严重的基线漂移,使用HPLC 对中药复杂体系中多种强心苷类成分同时进行定量分析也就显得尤为困难。为此,CHEN L 等[6]建立了LC-MS液质联用方法,对黑骨藤中杠柳苷(Periplocin)、杠柳次苷(Periplocymarin)和杠柳苷元(Periplogenin)进行含量测定,结果分别为(4 243.79±182.17) μg·g-1,(72.77±0.67) μg·g-1和(29.98±1.11) μg·g-1。该方法在节省时间、分辨率和灵敏度等方面具有显著优势,可用于黑骨藤中多种强心苷类成分含量测定。由于缺乏标准品,其他一些含量较高的成分,如periforoside Ⅰ,periplogenin 3-O-β-D-glucopyranosyl-β-digitaloside 和periforgenin A-3-O-β-digitoxopyranoside 未能被纳入测定,该方法有待进一步优化。
此外,HE J 等[32]也建立了一个稳健的LC-MS 方法,用于杠柳苷及其代谢产物的药代动力学研究。大鼠单次以50 mg·kg-1剂量进行灌胃给药。结果显示,杠柳苷仅在给药后几个时间点内被检测到,两个代谢产物杠柳次苷和杠柳苷元作为主要成分参与代谢过程。杠柳次苷和杠柳苷元的最大血药浓度时间(Tmax)在8~10 h 内,半衰期(T1/2)分别为8.22 h和13.58 h。该结果也证实了杠柳苷需要一定的时间才能转化成杠柳次苷和杠柳苷元。
6 毒理作用
黑骨藤在《中华本草》中记载为小毒,肝炎、溃疡病患者禁服,一日用量不宜超过10 g。过量会出现抽搐甚至死亡。冯剑春等[33]对2014 年11 月至2015 年12 月诊断为黑骨藤相关性肝损伤22 例患者的一般资料、临床表现及实验室检查采用国际医学科学组织理事会推荐的药物性肝损伤分型标准进行临床分型和回顾性分析。结果发现,患者中女性(12例)多于男性(10例),平均服药时间1周至2年,生物化学指标主要表现为丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBil)、碱性磷酸酶(ALP)及γ-谷氨酰转移酶(GGT)异常。22 例ALT、AST 均增高,19 例TBil 增高,ALP增高13 例,GGT 增高20 例。临床分型结果为:肝细胞损伤型18 例,胆汁淤积型0 例,混合型3 例,未分型1例。1例患者死亡,其余患者最后完全恢复。田芝奥等[34]也对本院2 年内收治的17 例患者进行研究,他们年龄均超过58 岁,服用黑骨藤制剂用于治疗关节疼痛。结果发现,服用黑骨藤制剂后,患者们均出现不同程度的药物性肝损伤,所有案例在出现中毒症状前,均有黑骨藤泡酒服或泡茶喝的病史。根据临床特点,黑骨藤所致肝损伤多发生于服药后1~4 周,大部分患者在4 个月之内。主要表现为急性肝细胞损伤型。幸运的是,在停止用药并接受适当治疗后,他们都能较好的恢复。
CHEN L 等[18]在小鼠中评价了黑骨藤的急性口服毒性,以4.0、2.0、1.0、0.5、0.25 g·kg-1剂量灌胃给药,连续观察7天。结果发现,黑骨藤在4 g·kg-1及以下不会引起小鼠死亡,对日常活动和体重也未见显著影响。金文渊等[35]评价了黑骨藤不同提取部位的急性毒性,SD 大鼠连续灌胃给药7 天(9.75 g·kg-1)。结果显示,黑骨藤不同极性部位给药7 d 后,大鼠未出现死亡,石油醚部位、氯仿部位、乙酸乙酯部位、正丁醇部位组对肝脏和肾脏生化指标均无显著性影响,水部位组大鼠血清中 的ALP 和BUN 显著升高,表现出一定的毒性。孙达等[36]进行了杠柳苷单次给药的毒性研究。结果显示,杠柳苷灌胃给药小鼠 在66、83 和103 mg·kg-1剂 量 下 没 有 死 亡;在20.65、17.55、14.92、12.68 和10.78 mg·kg-15 个剂量下,杠柳苷腹腔给药小鼠死亡率分别为100%、70%、60%、10%和0%。杠柳苷灌胃给药小鼠最大耐受剂量(Maximum tolerance dose,MTD)为103 mg·kg-1;杠柳苷腹腔注射给药小鼠半数致死量(LD50)为15.20 mg·kg-1。
总的来说,黑骨藤在传统医籍中被记载为小毒植物,在临床应用和基础研究中,也表现出一定的毒性。但是,只要在适当的剂量之下合理用药,可有效避免其毒性,并取得不错的临床效果。在未来研究中,应更多关注其慢性毒性和临床长期毒性以及毒性物质。
7 总结与展望
现代药理学揭示了黑骨藤的多种生物活性,包括抗炎、伤口愈合、抗肿瘤、强心作用等。不仅为传统用法提供了科学依据,也为黑骨藤的进一步开发利用提供了方向。糖尿病足溃疡是临床糖尿病重要并发症之一。由于长期高血糖,导致局部出现神经和血管病变,氧化应激水平升高,多种细胞因子及生长因子表达降低,引起慢性炎症持续发生,伤口增殖缺陷,导致难愈合伤口的形成[37]。而黑骨藤一方面具有显著的抗炎作用,能改善伤口局部炎症反应;另一方面还能增强成纤维细胞增殖和迁移,促进血管内皮细胞增殖和血管新生,以及促进胶原蛋白分泌,加快肉芽组织形成。因此,黑骨藤对糖尿病足溃疡也表现出了巨大的治疗潜力。其中,强心苷类组分可能是其潜在活性成分之一。
关于作用机制,目前已取得一定的进展,但是很多问题仍有待进一步阐明。然而,无论对于抗炎、伤口愈合还是抗肿瘤,许多研究都指向一个重要的靶点——Na/K ATPase。其受体功能已被广泛论证,具有调节酪氨酸激酶磷酸化和下游信号的转导,参与细胞增殖、分化、凋亡和炎症反应[19]。由于黑骨藤中存在大量的强心苷成分,我们推测黑骨藤的多种生物学作用或多或少与Na/K ATPase 有关。相关问题值得深入研究,并有赖于分子生物学和代谢组学等相关学科的交叉应用。
目前,人们对黑骨藤已进行了大量的定性和定量分析。然而,中国药典未收载任何黑骨藤及其相关制剂的定性和定量方法[38]。当前,黑骨藤生药的鉴定还主要依赖于性状鉴别和理化鉴别[39-40]。因此开发建立相应的定性和定量方法是当下一项迫切的任务。随着LC-MS 技术的不断普及,该技术也将逐渐成为中药复杂体系定性定量分析的重要手段。
本综述系统介绍了黑骨藤的传统用法、药物分析方法和毒理学研究,重点总结了其中所含的强心苷成分和相关药理作用研究进展,并将传统用法和现代药理活性、强心苷成分做了适当关联,为黑骨藤的进一步开发利用提供理论参考。

