糙叶五加根皮和茎脂溶性成分的GC-MS分析及其抗炎活性
唐思琪,徐 依,2,索宗武,罗 姣,黄 浩,程齐来,刘向前,李小军
(1. 赣南医学院药学院 国家中药现代化工程技术研究中心-客家中医药资源研究分中心;2. 赣南医学院第一附属医院药学部,江西 赣州 341000;3. 湖南中医药大学药学院,湖南 长沙 410208)
糙叶五加(Acanthopanax henryi)为中国特有的五加科五加属植物,广泛分布于湖南、江西、湖北、浙江、安徽等地[1]。其根皮(也称五加皮)收载于《湖南省中药材地方标准》,具有祛风利湿、活血舒筋、理气止痛等功效,主要用于治疗风湿痹痛、拘挛麻木、筋骨痞软、水肿、跌打损伤、疝气腹痛等[1-3]。现代药理学研究表明,糙叶五加提取物及其化学成分具有多种药理活性,如抗炎[3-5]、抗神经炎[6]、抗菌[7]、抗脂肪蓄积[8]、抗肿瘤[3,9]、抗氧化[10]、抗乙酰胆碱酯酶[10]、抗丁酰胆碱酯酶及抗透明质酸酶等活性[3]。前期有研究报道了糙叶五加主要含有萜类(单萜、二萜、三萜皂苷)[3,11-12]、苯丙素类[13]、咖啡酰基奎宁酸衍生物[3,14]、黄酮类[3,15]、木脂素类[3,16]、甾体等二次代谢产物[3,17],然而,对于糙叶五加的挥发性及脂溶性化学成分及其抗炎活性研究鲜见报道。研究表明一氧化氮(NO)在炎症的发生和发展过程中起重要作用。当机体中的免疫细胞如巨噬细胞和小胶质细胞被脂多糖(Lipopolysaccharide,LPS)激活,会产生多种促炎细胞因子如NO、前列腺素E2(Prostagladin E2,PGE2)、白细胞介素(Interleukins,ILs)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)等。然而,促炎细胞因子的过量产生,会造成实质性的器官损害甚至死亡,并引发多种慢性炎症疾病。因此,通过抑制促炎因子过度分泌是预防或抑制炎症及其相关疾病发生的有效途径[4-6]。基于此,我们首次对糙叶五加根皮和茎中的脂溶性成分进行气相色谱-质谱(Gas chromatography-mass spectrometry,GC-MS)联用对比分析,并对其进行抗炎活性评价,为今后对糙叶五加的药效物质基础研究和综合开发利用奠定基础。
1 仪器与材料
安捷伦7890B-7000D型气相色谱—三重四极杆质谱联用仪(美国安捷伦);RE-2000A 旋转蒸发仪(上 海 亚 荣);酶 标 仪(Bio-Rad, Hercules, CA,USA);乙醇(批号:20190403)、石油醚(60~90 ℃,批号:20190315)、二氯甲烷(批号:20200812)均为分析纯,购自国药集团;二甲基亚砜(DMSO)、脂多糖(LPS)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、Griess 试剂购自美国Sigma-Aldrich 公司;阳性对照紫铆因(Butein)、RAW264.7 和BV2 细胞均来源于韩国圆光大学药学院。
实验样品于2021 年3 月份采自湖南省新化,经湖南中医药大学药学院刘向前教授鉴定为五加科五加属植物糙叶五加[Acanthopanax henryi(Olive.)Harms]的根皮和茎,标本保存于赣南医学院江西省高校天然产物研究与开发重点实验室,标本号分别为AHR202103和AHS202103。
2 方 法
2.1 供试品的制备分别取阴干后的糙叶五加根皮和茎各100 g,粉碎至粗粉,用无水乙醇加热回流提取2 次(2 h/次)后合并提取液(2 × 300 mL),减压回收溶剂得总浸膏。总浸膏加入150 mL 蒸馏水分散后用石油醚(60~90 ℃)萃取3 次(3×200 mL),回收溶剂,得石油醚萃取物。取100 μL 石油醚萃取物(脂溶性成分)溶于1 mL二氯甲烷中,作为供试品用于GC-MS分析。
2.2 GC-MS 测试条件GC 条件:色谱柱为美国安捷伦DB-5MS 石英毛细管柱(30 m×0.25 mm×0.25 μm),程序升温初温为60 ℃,保持4 min,以10 ℃·min-1的速率升至180 ℃,保持5 min,再以5 ℃·min-1升温至250 ℃,保持5 min,进样口温度为250 ℃,载气为氦气,柱前压为72 kPa,进样量1 μL,流速1.2 mL·min-1。
MS 条件:离子源为EI,离子源温度230 ℃,电子能量70 eV,接口温度270 ℃,溶剂延迟时间为3 min,扫描质量范围为60~600 amu。依据糙叶五加根皮和茎的脂溶性成分总离子流色谱图,采用NIST17.L 质谱计算机数据系统进行检索,对质谱相似度>70%的化合物进行收集整理,以鉴定化合物,运用面积归一法计算得到不同化学成分占总体的相对百分含量。
2.3 MTT 细胞毒性试验采用MTT 细胞毒性分析试剂盒检测糙叶五加根皮和茎脂溶性成分对RAW264.7/BV2 细胞的毒性作用[15-16]。取对数生长期RAW264.7和BV2细胞分别接种于96孔板中(1×105个细胞/孔),37 ℃、5% CO2条件下温孵培养12 h。设置对照组和给药组,给药组分别加入不同浓度的根皮和茎脂溶性成分(0.1%的DMSO 为溶剂,终浓度分别为50、100、200 μg·mL-1),对照组加入0.1%的DMSO。继续温孵培养12 h 后,每孔取出100 μL上清液,加入终质量浓度为100 mg·mL-1的MTT工作液孵育0.5 h。形成的甲臜盐使用酸化异丙醇溶解,在酶标仪540 nm 处测定各孔吸光度(A)值,计算细胞存活率,每组独立实验重复3次。
细胞存活率 = (A给药组/A对照组)×100%。
2.4 NO 试验采用Griess 法[15-16]检测糙叶五加根皮和茎脂溶性成分对LPS刺激的RAW264.7/BV2细胞分泌NO 的抑制作用。取对数生长期RAW264.7和BV2 细胞分别接种于96 孔板中(1×105个细胞/孔),37 ℃、5% CO2条件下温孵培养12 h 后分别加入100 μL 不同浓度的糙叶五加根皮和茎脂溶性成分(0.1%的DMSO 为溶剂,终浓度分别为50、100、200 μg·mL-1),温孵培养1 h 后加入100 μL 的LPS(1 μg·mL-1),同时设空白对照组(培养液)、模型组(LPS+培养液)、阳性对照组(Butein+LPS+培养液),继续温孵培养12 h。将上清液(100 mL)与等体积的格氏试剂混合,用酶联免疫检测仪测定混合物在540 nm 处的A值,计算NO 抑制率,每组独立实验重复3次。
NO抑制率=[(A模型组-A给药组)/(A模型组-A对照组)]×100%。
3 结果与分析
本实验首次通过GC-MS 联用技术对糙叶五加根皮和茎的脂溶性化学成分进行分析研究,由分析结果可知,糙叶五加根皮脂溶性成分的主要种类为倍半萜及其含氧衍生物(57.39%)、长链脂肪酸及其酯类(17.37%)以及少量的单萜(0.18%)、长链脂肪醇(0.49%)、长链脂肪醛(1.55%)、小分子酚类(2.01%)、酚酸酯类(1.43%)、长链烯烃(3.56%)、呋喃类(0.28%);其茎中主要含有长链烷烃(55.76%)、倍半萜及其含氧衍生物(13.52%)、长链脂肪醇(8.3%)及少量的不饱和脂肪酸(2%)、小分子酚类(2.03%)、酚酸酯类(0.72%)。其中,糙叶五加根皮中的主要脂溶性成分为Naphthalene, 1,2,3,4,4a,5,6,8a-octahydro-7-methyl-4-methylene-1-(1-methylethyl)-,(1. alpha., 4a. beta.,8a. alpha.)-(依兰油烯,8.26%)、Linoleic acid ethyl ester (亚油酸乙酯,8.14%)、1H-Benzocyclohepten-9-ol,2,4a-.beta.,5,6,7,8,9,9a-.beta.-octahydro-3,5,5,9-.beta.-tetramethyl-(5.25%)、Tricyclo[5.4.0.0(2,8)]undec-9-ene,2,6,6,9-tetramethyl- ,(1R,2S,7R,8R)-(4.49%)、1H-Benzocycloheptene,2,4a,5,6,7,8-hexahydro-3,5,5,9-tetramethyl-,(R)-(4.03%);其茎中的主要脂溶性成分为Hentriacontane (正三十一烷,37.05%)、Triacontane (正三十烷,11.95%)、Naphthalene, decahydro-4a-methyl-1- methylene-7-(1-methylethenyl)-,[4aR-(4a. alpha.,7. alpha.,8a.beta.)]-(7.10%)、Pentacosane (正 二 十 五 烷,6.76%)、2,6,10-Dodecatrien-1-ol,3,7,11-trimethyl-, acetate,(E,E)- (5.53%);根皮和茎的3 种共有成分为(E)-. beta. -Famesene(根皮:2.11%;茎:0.48%)、Naphthalene, decahydro-4a-methyl-1-methylene-7-(1-methylethenyl)-,[4aR-(4a. alpha.,7. alpha.,8a. beta.)]-(根皮:0.74%;茎:7.1%)、Benzenepropanoic acid,3,5-bis(1,1-dimethylethyl)-4-hydroxy-,ethyl ester(根皮:2.01%;茎:2.03%)。从糙叶五加根皮和茎的脂溶性成分中共鉴定出66个化合物,其中根皮和茎中分别鉴定出54 和15 种脂溶性化学成分,分别占总量的89.32%和82.33%。糙叶五加根皮和茎脂溶性成分的化学成分、含量、总离子流色谱图见表1、图1、图2。结果表明糙叶五加根皮和茎的脂溶性化学成分种类和含量均存在较大差异,建议在使用时加以区分。
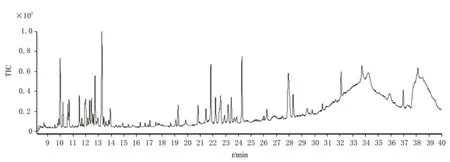
图1 糙叶五加根皮脂溶性成分的总离子流色谱图

图2 糙叶五加茎脂溶性成分的总离子流色谱图
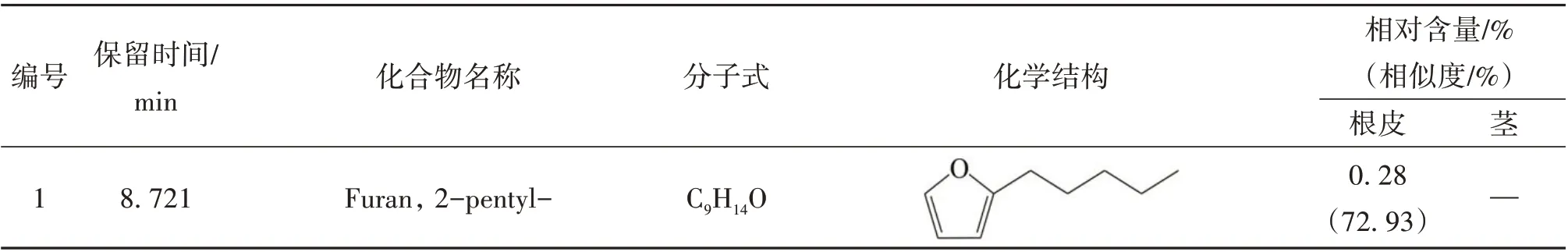
表1 糙叶五加根皮和茎脂溶性成分的组成和相对含量
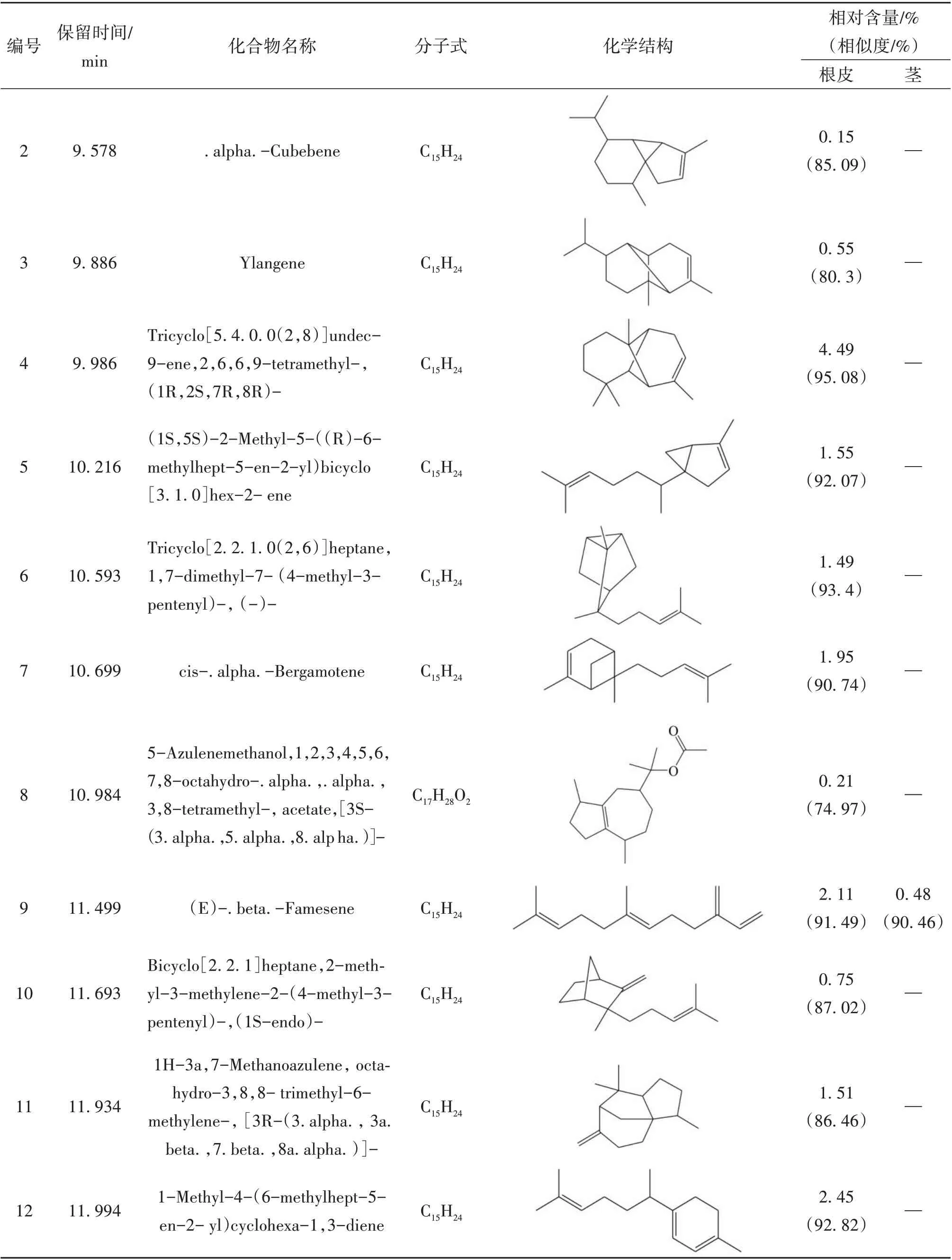
续表1 糙叶五加根皮和茎脂溶性成分的组成和相对含量
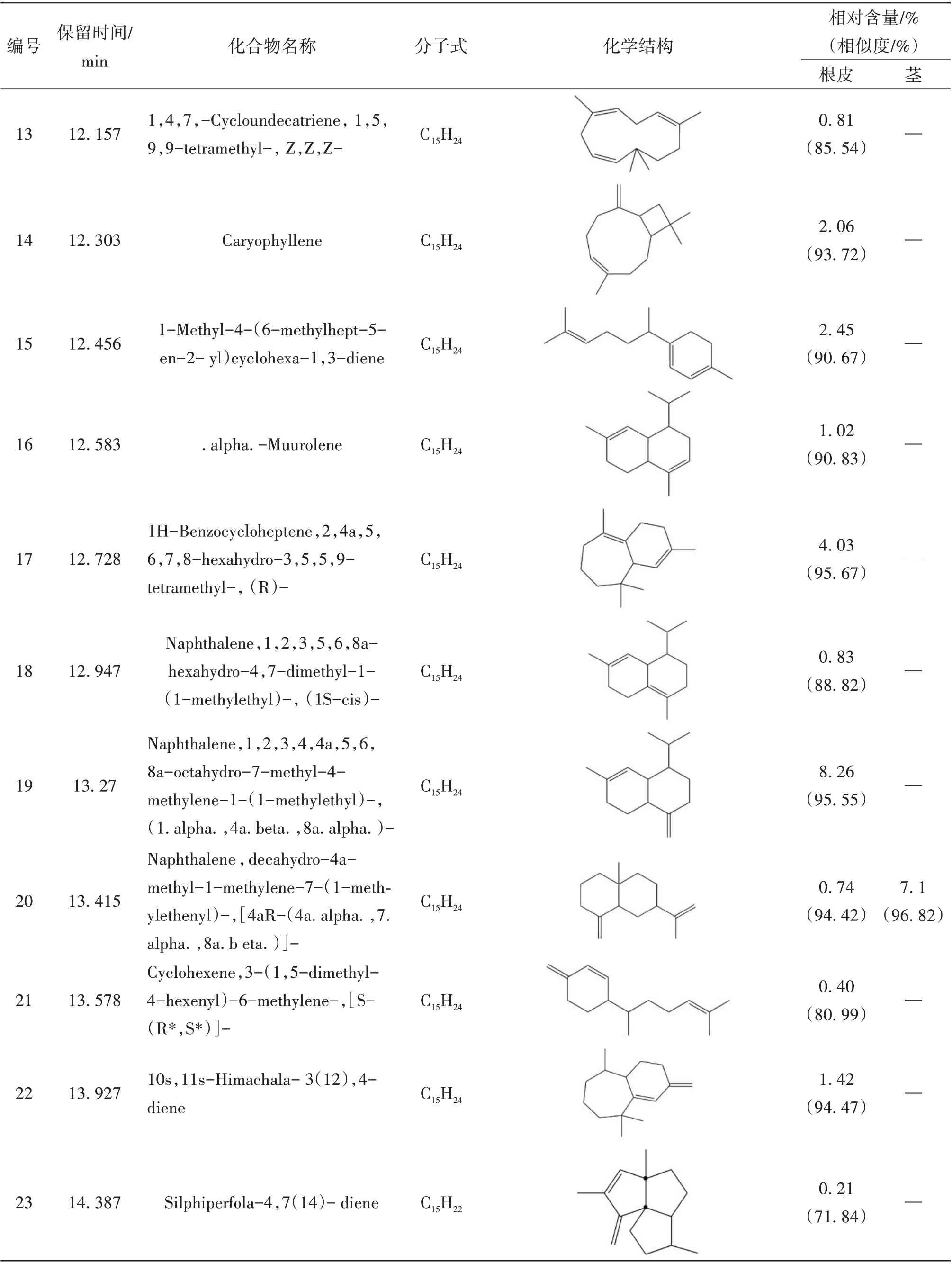
续表1 糙叶五加根皮和茎脂溶性成分的组成和相对含量
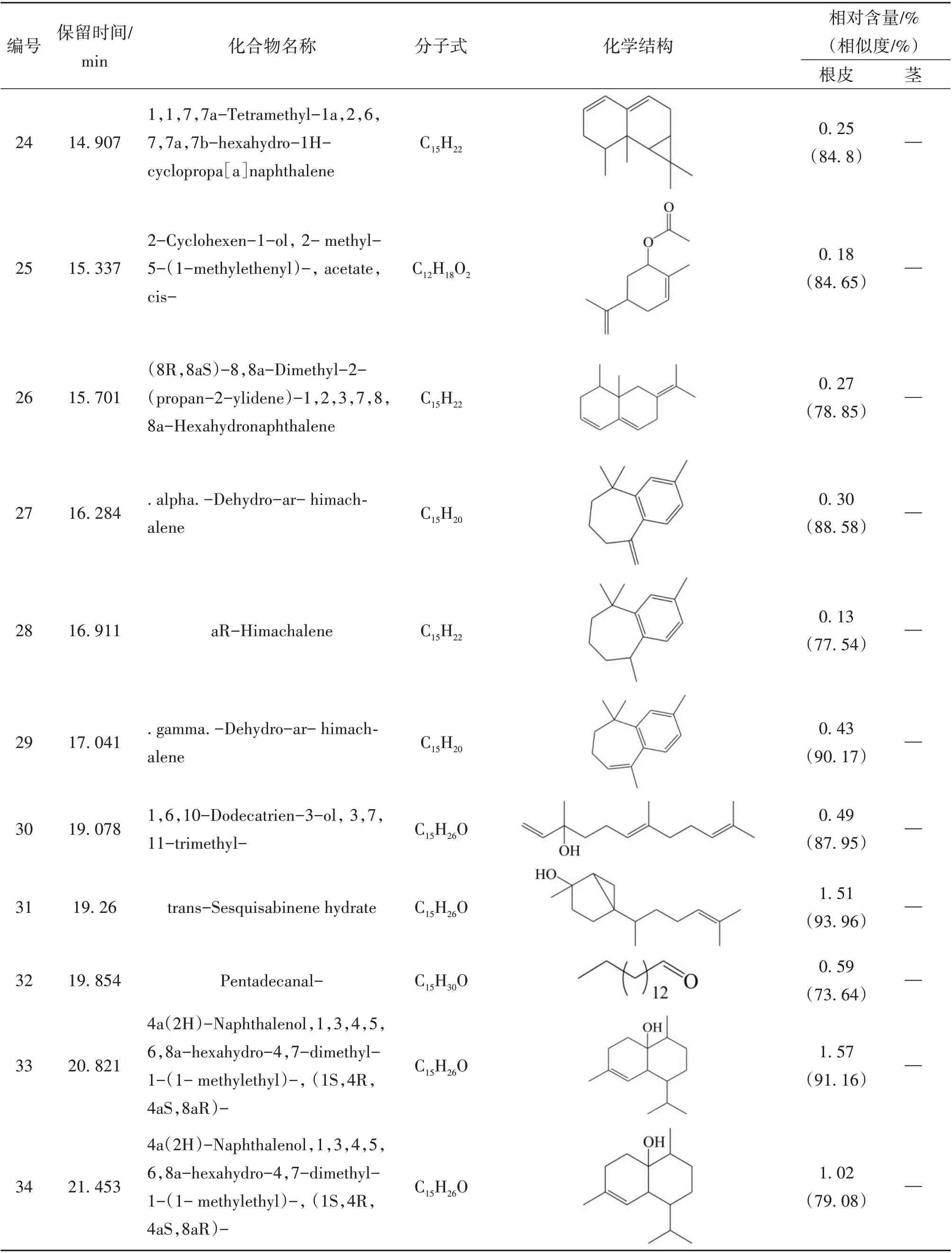
续表1 糙叶五加根皮和茎脂溶性成分的组成和相对含量
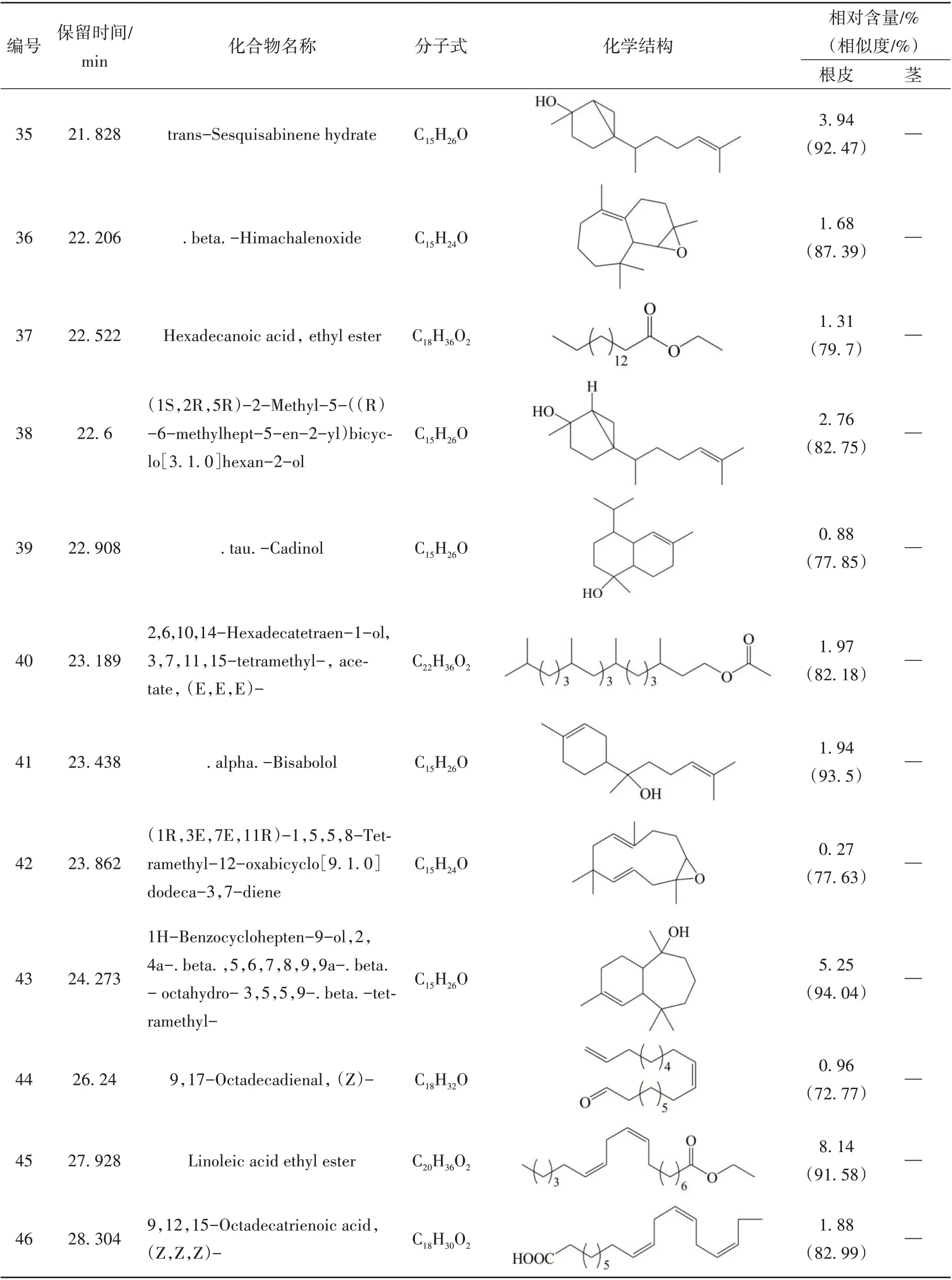
续表1 糙叶五加根皮和茎脂溶性成分的组成和相对含量
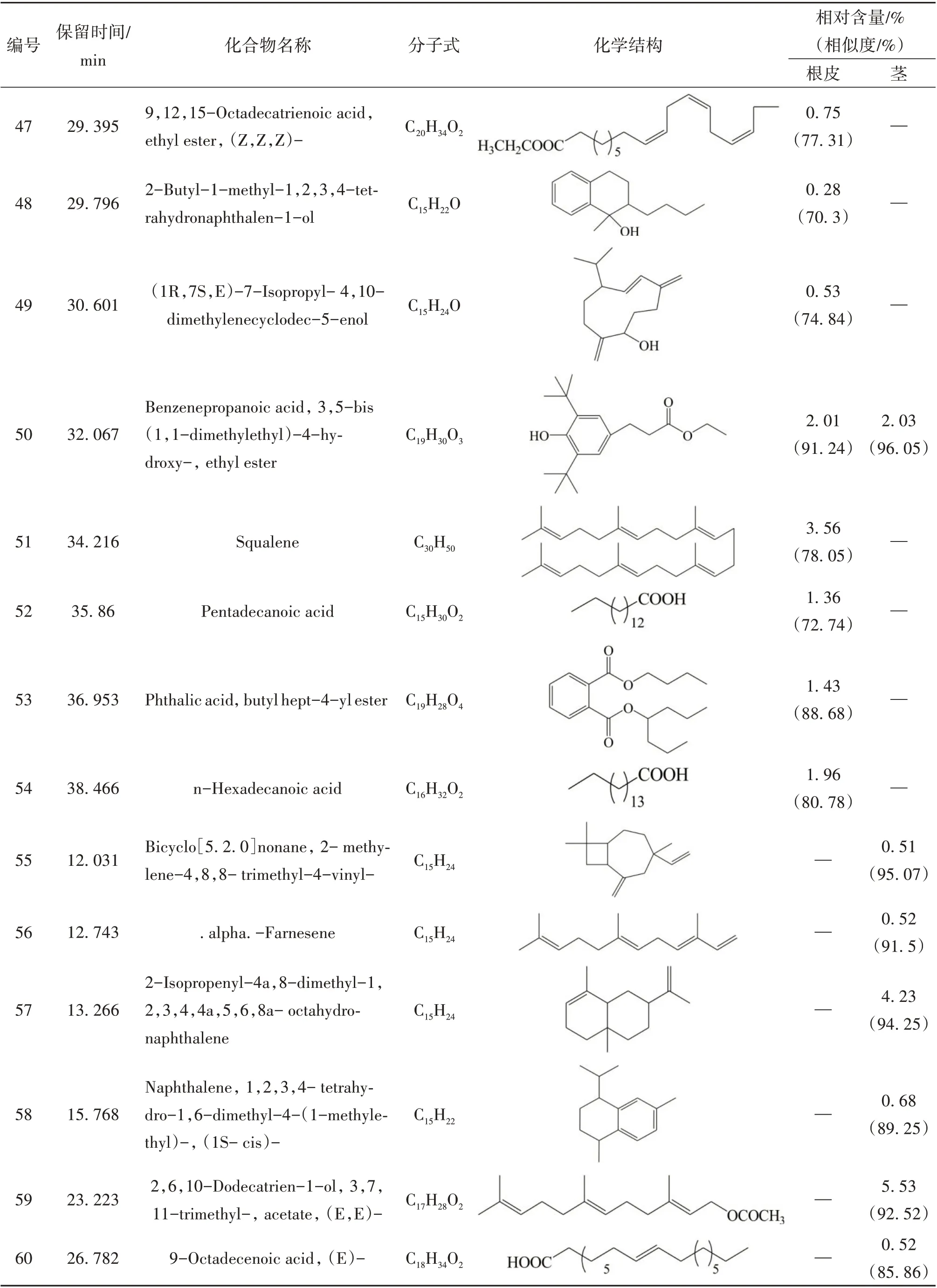
续表1 糙叶五加根皮和茎脂溶性成分的组成和相对含量
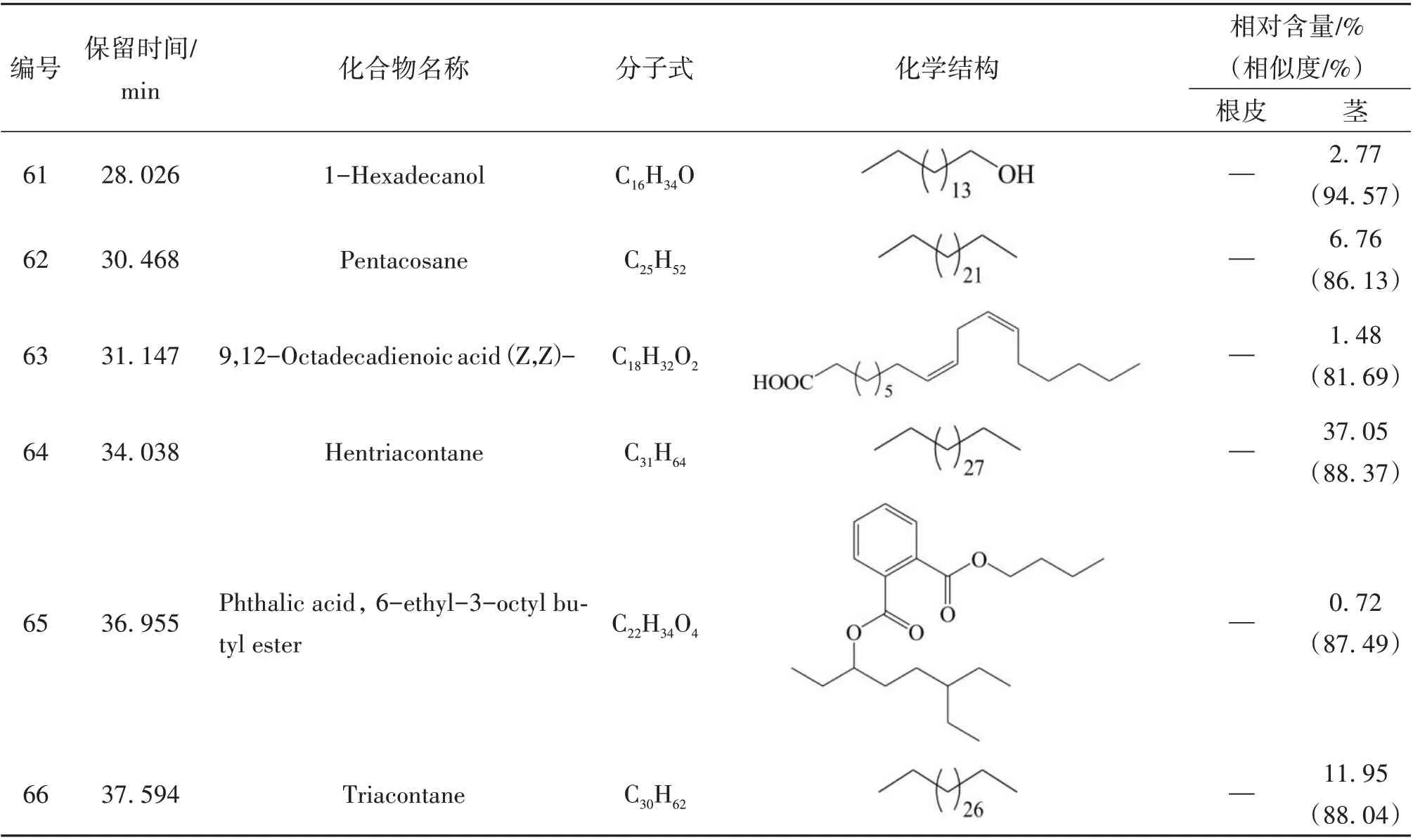
续表1 糙叶五加根皮和茎脂溶性成分的组成和相对含量
另外,MTT 细胞毒性试验结果表明在测试浓度为50 μg·mL-1时,对于RAW264.7 和BV2 细胞,根皮和茎的脂溶性成分均无明显的细胞毒性;当测试浓度为100 μg·mL-1时,根皮和茎的脂溶性成分对RAW264.7 和BV2 细胞均表现出一定的细胞毒性;当测试浓度增至200 μg·mL-1时,根皮和茎的脂溶性成分对RAW264.7 和BV2 细胞均表现出较显著的 细胞毒性(图3)。

图3 糙叶五加根皮和茎脂溶性成分对LPS刺激的RAW264.7和BV2细胞存活率的影响
NO 试验结果表明在测试浓度为50 μg·mL-1时,根皮和茎的脂溶性成分对RAW264.7 和BV2 细胞均表现出较好的NO 生成抑制活性,且根皮效果优于茎;当测试浓度为100 和200 μg·mL-1时,根皮和茎的脂溶性成分对RAW264.7 和BV2 细胞均表现出显著的NO 生成抑制活性。研究结果表明,糙叶五加根皮和茎的脂溶性成分具有潜在的抗炎活性(图4)。
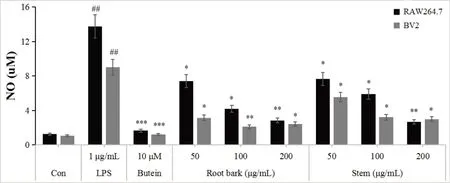
图4 糙叶五加根皮和茎脂溶性成分对LPS刺激的RAW264.7和BV2细胞NO抑制活性
4 讨 论
天然倍半萜类化合物在医药行业有重要作用,其药理活性丰富多样,包括抗炎、抗肿瘤、保护神经系统、保护胃肠道、保肝、抗菌和抗病毒、降血糖等活性[18-19]。糙叶五加根皮和茎脂溶性成分中含有丰富的倍半萜类化合物,该类成分可能是根皮和茎脂溶性成分表现出抗炎活性的主要物质基础,比如根皮中的杜松烷型倍半萜具有多种重要的药理活性,如抗炎、抗菌、降血糖、抗肿瘤等[19],具有深度开发的价值。同时,其根皮脂溶性成分中含有较多的不饱和脂肪酸,具有重要的医药功效,如亚油酸乙酯具有降低胆固醇和血脂的作用,主要用作制药原料,防治动脉粥样硬化症[20]。同时,有研究报道,亚油酸乙酯对HepG2细胞具有较明显的保护作用,表明其具有潜在的护肝活性[21]。糙叶五加根皮中还发现了角鲨烯,它是一种无毒性的海洋生物活性物质,是一种高度不饱和烯烃类化合物,具有提高体内超氧化物歧化酶活性、抗肿瘤、抗衰老等多种功能[22]。研究表明,角鲨烯还有耐缺氧、促进皮肤健康、用于化妆品的保湿剂和抗氧化剂及自由基清除剂的作用,另外,角鲨烯也可用作高级香皂的高脂剂、食品机械设备中的润滑剂、杀虫剂、衣物护理剂、铅笔芯稳定剂等[23]。综上所述,糙叶五加是一种很有开发前景的传统中药。本研究丰富了糙叶五加脂溶性成分的研究内容,并进一步丰富了五加科五加属植物的研究内容,为对其进行深入物质基础研究提供了参考依据,也为糙叶五加的质量评价提供了实验依据和理论参考。

