基于蛋白降解靶向嵌合体技术的分子胶降解剂的研究进展
魏一飞,欧阳毅翔,程齐来,郭小华
(1. 赣南医学院药学院;2. 赣南医学院图书馆,江西 赣州 341000)
蛋白降解靶向嵌合体(Proteolysis Targeting Chimera,PROTAC),是一类可利用细胞内的垃圾分类处理系统降解一些蛋白的新型药物分子,PROTAC 药物一端连接E3 连接酶,一端连接拟降解的蛋白,当三者形成复合体,拟降解的蛋白就会被一种叫泛素的分子标记,然后细胞内的降解酶就会降解该蛋白,达到治病的目的。基于PROTAC 技术设计药物的最大的优势之一是能够使靶点从“不可成药性”变成“可成药性”[1-3]。大多数小分子药物或单抗需要结合酶的活性位点发挥作用,但对于那些无酶功能的蛋白,尤其那些缺乏酶活性或表面缺乏成药位点的蛋白,却是无能为力的。然而,人类细胞中80%以上的蛋白缺乏这样的位点,而PROTAC 分子却可以捕获这些蛋白,并将其快速降解清除[4]。近年来,随着诱导靶蛋白降解策略的突飞猛进,PROTAC技术已成为很有希望的新药开发技术之一[5-6]。
PROTAC 分子本身包含三个不同的部分:一个与目标蛋白结合的配体、一个与E3连接酶结合的配体,以及一个连接这两个配体的链接器。其作用机制如图1:PROTAC 分子通过与目标蛋白结合后将目标蛋白与E3 泛素连接酶进行拉拢,使得E3 可以泛素化标记的目标蛋白,被泛素化的目标蛋白可以通过蛋白酶体途径降解掉[7-8]。

图1 PROTAC分子降解目标蛋白的作用机制示意图
从化合物设计方面,PROTACs 相对简单,用一个linker 连接泛素连接酶配体和特定靶点的配体,但这类分子分子量往往较大,成药性难度较大[8]。除PROTACs 外,一类被称为分子胶(glue)的小分子也可成功诱导靶蛋白的降解。沙利度胺类抗癌药物是分子胶的一个显著例子,这类药物可重定向E3泛素连接酶CRL4CRBN,从而使转录因子IKZF1 和IKZF3 多聚泛素化,导致IKZF1 和IKZF3 被蛋白酶体降解[9]。类似地像磺胺类抗癌药物Indisulam,可引导CRL4DCAF15E3泛素连接酶降解剪接因子RBM23和RBM39。这类能降解靶蛋白的小分子化合物被称为分子胶降解剂(glue degraders)[10-11]。
简单来说,分子胶降解剂是一类可诱导E3泛素连接酶底物受体与靶蛋白之间新型相互作用,从而导致靶蛋白降解的小分子。由于分子胶降解剂与PROTACs 一样,可显著减轻对靶蛋白上的活性相关口袋(pockets)的需求,而成为有潜力的可成药候选分子,尤其在肿瘤的治疗方面有广泛的应用前景[12-14]。
尽管现有的分子胶降解剂显示出了靶向不可成药蛋白(如转录因子和剪接因子)的能力,但现有的分子胶降解剂都是偶然发现的,开发这类药物仍极具挑战性。本文将根据作用靶点的不同,分类对目前备受关注的分子胶降解剂进行综述。
1 靶向CRLs连接酶的分子胶降解剂
卡林环连接酶(cullin-ring ligases,CRLs)是E3泛素连接酶中最大的一个家族,通过将底物受体(substrate receptor,SRs)和适配器蛋白围绕不同的cullin 骨架进行组装,形成了超过250 种CRLs[15-16]。针对一些不可成药蛋白累积引起的严重疾病,传统的拮抗剂研究策略很难有所创新和突破,而蛋白质活性的药理调节的一个有希望的替代方法就是将小分子重定向到E3泛素连接酶进行降解。
研究发现,以E7820、Indisulam 和Tasisulam 为代表的磺酰胺类分子胶降解剂(图2,化合物1-3),可化学重定向CRLs 的底物受体CRL4DCAF15连接酶并与之结合[12,17-19]。与连接酶结合后的分子胶被包裹在DCAF15 表面的一个由R552、V556、V559 等氨基酸构成的浅口袋中,以协同的方式与DCAF15结合,其中磺酰胺中磺酰基上的氧原子与浅口袋周围的氨基酸形成了氢键相互作用力[20]。
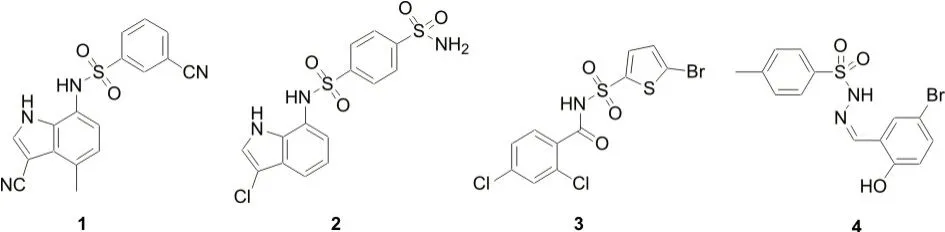
图2 DCAF15蛋白分子胶降解剂
动力学研究表明,磺酰胺类化合物作为一类分子胶降解剂,在与CRL4DCAF15连接酶结合后,可识别基因剪接因子RBM39、RBM23 的RRM2 结构域,诱导RBM39、RBM23 向CRL4DCAF15连接酶靠笼并使之发生泛素化,遂被降解[18]。
SIMONETTA K R 等[21]在2019 年报道了一类酰胺类分子胶降解剂(图3,化合物5-11),作用机制与磺酰胺分子胶降解剂类似,可与CRL4 E3 连接酶底物受体蛋白Cereblon(CRBN)结合,促进与非原生淋巴转录因子Ikaros(IKZF1)和Aiolos(IFZF3)以及酪蛋白激酶1α(CK1α)的相互作用,导致它们被RING E3 连接酶CRL4CRBN泛素化,随后被26S 蛋白酶体降解。

图3 CRBN蛋白分子胶降解剂
MAYOR-RUIZ C 等[12]通过差异化学分析方法发现了一类酰胺类分子胶降解剂(图4,化合物12-19),要通过重定向CRL4 连接酶专属的底物受体才能发挥降解目标蛋白作用。他们采用定量蛋白质组学、功能基因组策略等方法交叉研究,探索这类分子胶降解剂诱导靶蛋白降解的机制,结果表明,这类酰胺类分子胶可增强DDB1、CRBN 等专属底物受体与cyclin K 之间的亲和力,促进cyclin K 泛素化而被降解[22]。

图4 DDB1、CRBN蛋白分子胶降解剂
2 靶向细胞周期蛋白依赖性激酶的分子胶降解剂
BETTAYEB K 等[23]研究发现,CR8(图5,化合物20)是一种选择性周期蛋白依赖性激酶(CDK)抑制剂,是CDK1、2、5 和9 的有效抑制剂,其中对CDK1、CDK2 蛋白的抑制活性分别达到了0.09 μmol·L-1和0.041 μmol·L-1。
2020 年,SŁABICKI M 等[14]报道称,CR8 其类似化合物(图5,化合物20-23)作为一种分子胶降解剂可诱导CDK12-cyclin K 和CUL4 底物蛋白DDB1 之间形成复合物,将cyclin K 进行泛素化和降解。这类分子胶降解剂与CDK蛋白结合后,可占据CDK蛋白的ATP 结合口袋,并通过结构中的苯基吡啶部分与口袋周围的氨基酸形成疏水相互作用力。化合物22 苯环上无吡啶基取代、化合物23 无苯环结构,其诱导与CDK蛋白的结合能力逐渐减弱[24-26]。
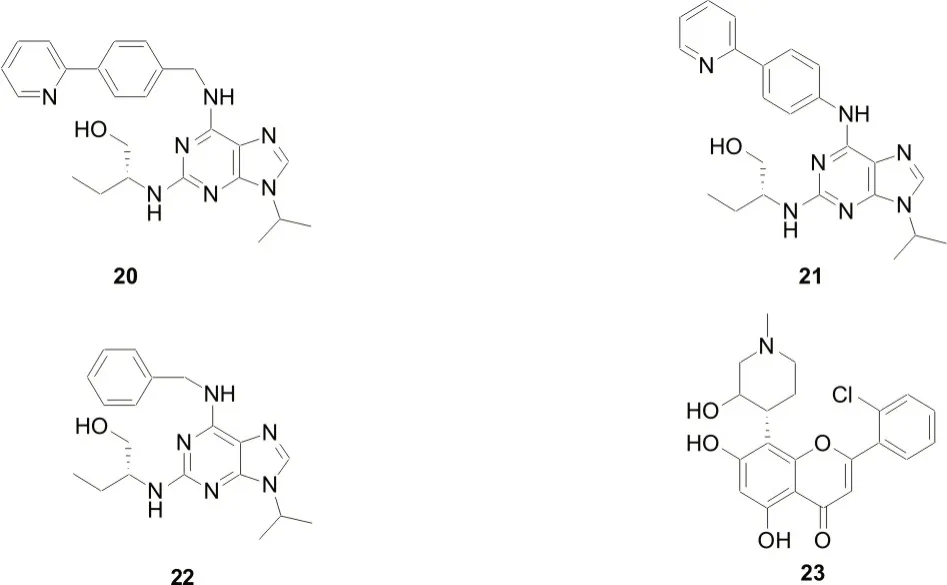
图5 CDK1、CDK2蛋白依赖性激酶分子胶降解剂
LV L 等[27]利用高通量小分子化合物筛选发现了一类新的分子胶降解剂(图6,化合物24-35),并利用化学遗传学和生物化学重组实验,揭示了这类分子胶是通过诱导CDK12 和DDB1 的相互作用,导致CDK12结合蛋白cyclin K 泛素化和降解的作用机理,这项研究为靶向蛋白降解提供了一种新的策略。

图6 CDK12蛋白依赖性激酶分子胶降解剂
李金秀等[28]在总结前人研究的基础上,介绍了目前处在临床研究中的CDK9 蛋白的分子胶降解剂(图7,化合物36-43)。尽管这些CDK9 抑制剂有潜在的抗肿瘤活性,但由于临床不良反应较明显,其临床研究进展缓慢,仅化合物37进入了Ⅲ期临床研究,活性和安全性也有待于进一步评估[29-30]。随着PROTAC 技术兴起,多个研究团队也相继报道了一些新型的CDK9抑制剂,为基于CDK9靶点的分子胶降解剂的药物研发提供了广阔的思路[31-35]。
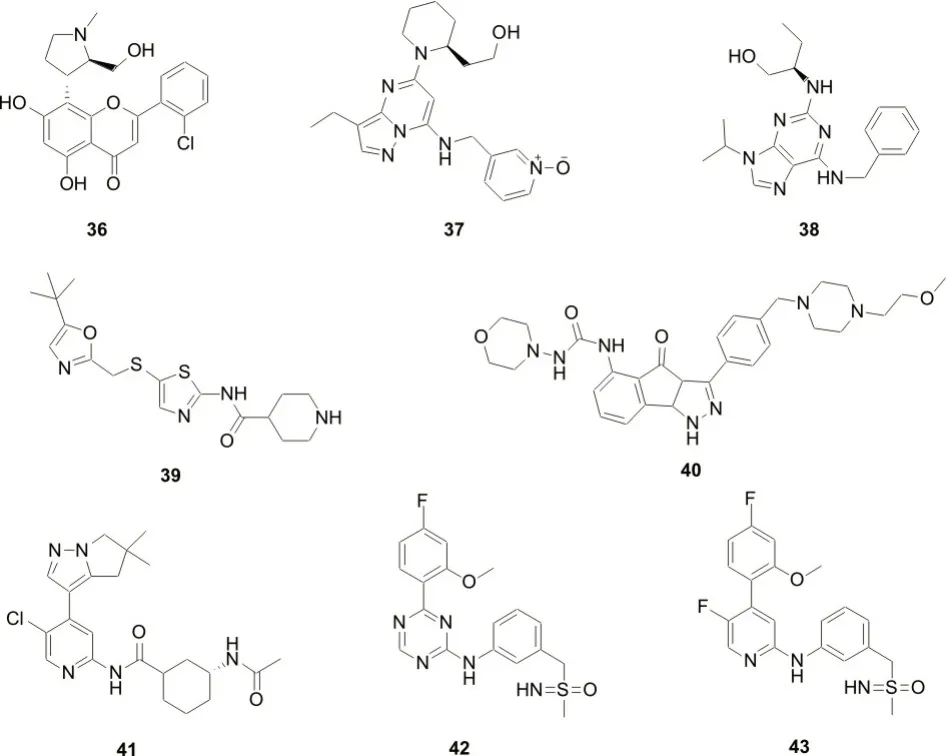
图7 CDK9蛋白依赖性激酶分子胶降解剂
3 靶向细胞色素P450 1B1的分子胶降解剂
细胞色素P450 1B1(CYP1B1)在多种肿瘤中高度表达,是肿瘤预防、治疗的一个有吸引力和潜在的靶点,抑制CYP1B1是目前治疗CYP1B1介导的恶性肿瘤的主要治疗模式,但目前治疗效果甚微[36]。利用PROTAC 技术设计分子胶降解剂可能是促进CYP1B1 蛋白泛素化和蛋白酶体降解的一种有效途径。
ZHOU L 等[37]以α-萘黄酮类为母核,设计了一类靶向CYP1B1 蛋白的特异性分子胶(图8,化合物44-52),能促进CYP1B1 蛋白的降解,降低化疗药物的耐药性。其中在α-萘黄酮上用不同碳链连接沙度利胺得到的衍生物,能有效克服CYP1B1 介导的多西他赛耐药,特别是化合物51,在无毒浓度下几乎完全逆转DU145/CY 细胞的耐药性,被认为是最有潜力的CYP1B1靶向降解剂[37]。
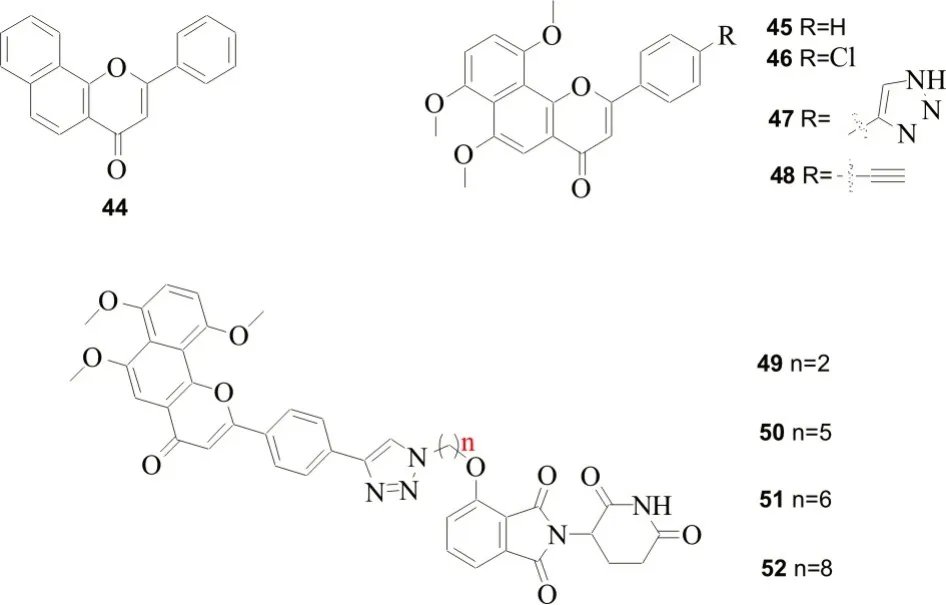
图8 CYP1B1蛋白特异性分子胶降解剂
4 靶向转录抑制因子BCL6的分子胶降解剂
BCL6是一种转录抑制因子,在抗体亲和成熟过程中起关键作用。BCL6的调控异常,可诱导生发中心的B 细胞发生肿瘤,BCL6 因此被认为是弥漫性B细胞淋巴瘤的治疗靶点[38]。
BELLENIE B R 等[39]报道了两个能诱导B 细胞中BCL6 蛋白的迅速降解的苯并咪唑酮抑制剂(图9,化合物53-54),在对这两个苯并咪唑酮化合物结构优化中,发现了化合物CCT369260(化合物55)。研究表明[39],CCT369260 口服给药后可降低淋巴瘤异种移植小鼠模型中BCL6 水平,该化合物目前在进行临床药代动力学研究,有望成为血液系统肿瘤的治疗靶点。
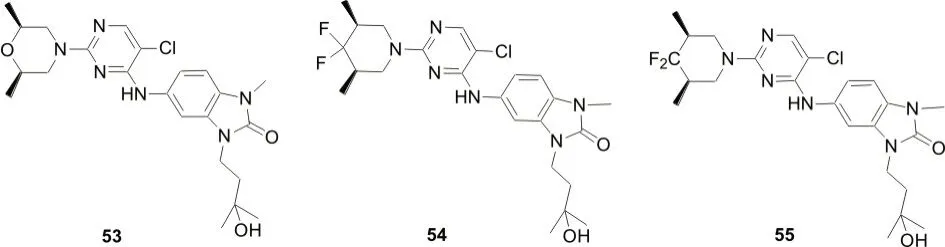
图9 BCL6蛋白分子胶降解剂
5 靶向表皮生长因子受体的分子胶降解剂
表皮生长因子受体(Epidermal growth factor receptor,EGFR)是一种受体酪氨酸激酶(tyrosine kinase,RTK),在调控细胞增殖、代谢、凋亡和存活等基本细胞过程中起着关键作用,EGFR 过表达或突变是非小细胞肺癌(NSCLC)发病和发展最常见的原因之一[40-41]。临床上治疗NSCLC的药物主要是靶向EGFR,但遗憾的是,不管是第一代、第二代还是第三代EGFR 抑制剂,都不可避免出现不同程度的耐药性,这给NSCLC的治疗提出了新的挑战[42]。
受PROTAC 技术的启发,ZHANG H 等[43]研制了第四代EGFR 抑制剂(图10,化合物56-69)作为分子胶降解剂,诱导EGFR 蛋白的降解,以期克服EGFR突变体介导的耐药。实验结果表明[43],化合物57和化合物65 在HCC827 细胞中诱导EGFR 蛋白降解的DC50值分别为45.2 nmol·L-1和34.8 nmol·L-1,有潜力成为有效的靶向EGFR的分子胶降解剂。
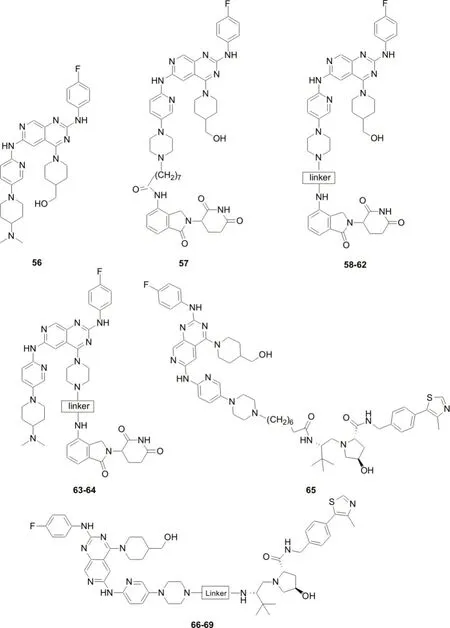
图10 EGFR蛋白分子胶降解剂
除以上综述的各靶点的分子胶降解剂外,靶向其他一些蛋白的降解剂也逐渐被发现。如YANG C Y 等[44]和LU X P 等[45]报道的靶向溴域和外末端(BET)蛋白分子胶降解剂,以酪氨酸激(BTK)[46]、间变性淋巴瘤激酶(ALK)[47]、信号传导及转录激活因子(STAT)[48]为靶点的分子胶降解剂正逐渐进入研究者的视野。不断涌现的新型分子胶降解剂也为药物治疗耐药性及蛋白缺乏成药位点等问题提供了新的解决策略。
6 总结与展望
PROTAC 技术是当前新药研发领域最热门的技术之一,以PROTACs概念为基础的分子胶降解剂通过泛素-蛋白酶体系统诱导靶蛋白降解,使靶点由“不可成药性”变成“可成药性”,克服了目前肿瘤等疾病治疗的耐药性等问题,是药物研究的一大突破性成果。尽管PROTAC 技术被认为是药物研发的“大杀器”,但其成药之路并不顺利,目前这类药物的研发仍处于临床前研究或临床研究的初期。主要原因有:分子胶降解剂分子量普遍偏大,其水溶性、口服生物利用度不理想;分子胶降解剂易降解除致病蛋白之外的其他蛋白而产生脱靶毒性,其毒性评价有待于进一步研究;分子胶降解剂合成难度和合成成本较高,开发周期较长。
基于PROTAC 技术的分子胶降解剂已经为新药研发开启了新的篇章,给全球制药巨头企业带来了前所未有的机遇和挑战。随着 PROTAC 技术的不断发展完善,分子胶降解剂的诸多瓶颈势必被打破,这类药物帮助更多患者的曙光也即将到来。

