固相萃取法联用UPLC-Triple-TOF/MS法鉴定花菜中自由和结合态植物甾醇
冯思敏,吴思杰,江佳萍,廖 杰,孙培龙,2,邵 平,2*
(1 浙江工业大学食品科学与工程学院 杭州 310014 2 中国轻工业食品大分子资源加工技术研究重点实验室(浙江工业大学) 杭州 310014 3 浙江华才检测技术有限公司 浙江绍兴 311800)
花菜(Brassica oleracea L.var.botrytis L.),又名花椰菜、菜花、洋花菜,为十字花科芸薹属甘蓝种的一个变种[1]。其适应性强,在我国分布广泛,主要集中于福建、浙江、江苏等沿海地区,以及河北、云南等地区[2]。花菜中含有丰富的维生素、碳水化合物、矿物质等营养成分,以及萝卜硫素[3]、多酚、芥子油苷[4]、植物甾醇[5]等生物活性物质,具有较高的营养价值。
植物甾醇(Phytosterol)是一类以环戊烷多氢菲为骨架的天然活性物质[6],其结构与胆固醇相似,然而功能完全不同,广泛存在于各种植物油、坚果及其它植物性食物中。Han 等[7]发现蔬菜中总植物甾醇含量为1.1~53.7 mg/100 g,其中最高浓度出现在豌豆、花椰菜、西兰花和生菜中。在已报道的200 多种植物甾醇中,谷甾醇、豆甾醇、麦胶甾醇最为常见。有研究表明,植物甾醇具有降低胆固醇[8]、抗肿瘤[9]、抗炎[10]、抗氧化[11]等功效,Feng 等[12]指出植物甾醇能调节胆固醇、脂肪酸、TG 和BA,从而缓解非酒精性脂肪肝、炎症性肠病和肥胖症等不同疾病。由此可见,植物甾醇在疾病防治方面具有重要作用,使其在医学、生命科学、食品等领域日益受到重视,具有广阔的开发前景。然而植物甾醇结构较复杂,国内对该领域的研究与开发较国外相对滞后,用于分析不同类型、形态植物甾醇的方法尚不完善[13],尚需深入研究。
甾醇的生理活性可能受其结构的影响[14]。为进一步扩大植物甾醇在食品、医药、化妆品等领域的应用,对其纯度应有更高的要求。对不同形态植物甾醇的分离、纯化,定量、定性分析以及结构鉴定,具有重要意义。本研究采用固相萃取法(SPE)分离花菜中4 种结合状态的植物甾醇,用超高效液相色谱串联三重四极杆飞行时间质谱 (UPLCTriple-TOF/MS)鉴定其甾醇的种类,分析其结构,为进一步研究花菜及其它蔬菜中植物甾醇提供理论和试验依据。
1 材料与方法
1.1 材料与试剂
花菜,当地农贸市场,热风干燥后粉碎待用。
异丙醇(特级色谱纯),上海阿拉丁生化科技股份有限公司;正己烷(特级色谱纯)、乙腈(特级色谱纯),天津市四友精细化学品有限公司;Silica固相萃取柱(500 mg/3 mL),Phenomenex 公司;Diol固相萃取柱 (500 mg/3 mL),GL Sciences Inc 公司;其余化学试剂均为国产分析纯级。
1.2 仪器与设备
AY220 型电子天平,日本岛津公司;AcquityTM ultra 型超高效液相色谱仪,美国Waters公司;Triple TOF 5600+三重四极杆-高分辨飞行时间质谱仪 (配有大气压力化学电离源),美国ABSCIEX 公司;752N 紫外可见分光光度计,上海仪电分析仪器有限公司;RE-2000A 真空旋转蒸发仪,上海研承仪器有限公司;miVac 真空离心浓缩仪,英国GeneVac 公司;GZX-9076MBE 电热鼓风干燥箱,上海博讯实业有限公司医疗设备厂;CR21N 高速冷冻离心机,日本日立工机株式会社;FS-1200pv 超声波处理器,上海生析超声仪器有限公司;HH-6 数显恒温水浴锅,江苏国华电器有限公司。
1.3 方法
1.3.1 标准曲线的绘制 配制豆甾醇标准溶液:称取100.0 mg 豆甾醇标样,加入适量无水乙醇,溶解后定容至100 mL。准确吸取10 mL 并用无水乙醇定容至100 mL,此时的溶液作为标准液。
配制磷硫铁显色剂:准确称取10 g 三氯化铁(Ⅲ)六水合物,加入适量浓磷酸(85%),溶解后定容至100 mL。吸取1.5 mL 上述溶液于100 mL 棕色容量瓶,用浓硫酸定容。
称量100.0 mg 豆甾醇标样,加入适量无水乙醇,溶解后定容至100 mL。使用时取10 mL,用无水乙醇定容至100 mL,此时的溶液作为标准液。分别吸取0,0.5,1.0,1.5,2.0,2.5 mL 标准液于试管,加入无水乙醇补充至4 mL,再加入2 mL 磷硫铁显色剂显色15 min,于520 nm 波长下测定吸光度,以豆甾醇含量为横坐标,以吸光度为纵坐标,绘制标准曲线。得到回归方程y=0.063x-0.0066,R2=0.9965,表明豆甾醇质量浓度在0~62.5 μg/mL内线性关系良好。
1.3.2 花菜中植物甾醇的提取及总甾醇含量的测定 称取500 mg 花菜粉,各加入2.5 mL 氯仿和甲醇,摇匀,超声20 min,过滤,将滤液转移至圆底烧瓶,45 ℃旋蒸至干,复溶于10 mL 无水乙醇。取1 mL 样品溶液和3 mL 无水乙醇于试管中,按上述方法测其吸光度,得到总甾醇含量。
1.3.3 固相萃取法分离植物甾醇
1.3.3.1 游离甾醇、甾醇酯和酰化甾醇糖苷、甾醇糖苷分离 准确称取花菜粉1.000 g,加入各5 mL 氯仿和甲醇,提取方法如上所述,45 ℃旋蒸,加1 mL 氯仿复溶。硅胶柱中加入5 mL 氯仿活化,上样1 mL,先用氯仿洗脱游离甾醇(FS)和甾醇酯(SE),干燥后,加入1 mL 己烷复溶;再加入丙酮-异丙醇(体积比1∶1)洗脱酰化甾醇糖苷(ASG)和甾醇糖苷(SG),干燥后,加1 mL 庚烷-异丙醇(体积比95∶5)复溶。
1.3.3.2 洗脱 硅胶柱中加入5 mL 己烷活化,将
1.3.3.1 节中的第1 个洗脱组分加入柱内,先用己烷-乙醚(体积比99∶1)洗脱SE,再加入己烷-乙醚(体积比85∶15)洗脱FS。
Diol SPE 柱(500 mg,3 mL)加入5 mL 庚烷活化,将1.3.3.1 节中的第2 个洗脱组分加入柱内,庚烷-异丙醇(体积比97∶3)洗柱后,先加入庚烷-异丙醇(体积比92∶8)洗脱ASG,再加入庚烷-异丙醇(体积比85∶15)洗脱SG。
分别用3,4,5,6,7,8 mL 的溶剂按照上述流程洗脱甾醇。
1.3.3.3 各组分甾醇含量的测定 按1.3.2 节的方法测定吸光度,记录分析不同体积洗脱液对甾醇洗脱量的影响。
1.3.4 UPLC-Triple-TOF/MS 检测分析
1.3.4.1 超高效液相色谱条件 色谱柱:Agilent eclipseplus C18 柱 (4.6 mm×100 mm,1.8 μm);流动相A:90%甲醇,B 相:乙腈-异丙醇(体积比1∶1);流速:0.6 mL/min;检测器:紫外可见光;检测波长:210 nm;柱温:30 ℃;进样量:10 μL;流动相梯度洗脱见表1。

表1 液相梯度洗脱条件Table 1 Liquid gradient elution conditions
1.3.4.2 质谱条件 扫描方式:正离子模式(AP-CI),一级全扫描,加自动二级扫描;电喷雾电压:+5.5 kV;扫描范围:m/z 100~1 000;离子源温度:600 ℃;辅助气Gas1 压力:344.75 kPa;辅助气Gas2 压力:344.75 kPa;最大允许误差:±5 ppm 范围内;去簇电压(DP):100 V;聚焦能量:10 V。
1.4 数据统计与分析
除液质分析外,试验所得数据结果采用2 次及以上平行试验,数据表示方法为“平均值±标准差”。使用Peakview 软件进行质谱图分析鉴定,使用Origin 2019 进行数据处理及分析,使用Chem-Draw Professional 17 绘制甾醇结构式。
2 结果与分析
2.1 花菜中总甾醇含量
甾醇提取液与磷硫铁试剂显色反应后,在520 nm 紫外光波长下测吸光度,结果取平均值,总甾醇含量为(5.034±0.097)mg/g,RSD=1.733%。
2.2 SPE 不同体积洗脱液对甾醇洗脱量的影响
由图1(a,b)可知,SE 洗脱量随着洗脱液体积增加呈先增加后稳定的趋势,在5~6 mL 内,洗脱量显著增加(P<0.05),6 mL 后随着洗脱液体积增加,SE 洗脱量无明显变化(P>0.05);FS 洗脱量在洗脱液体积小于5 mL 时呈下降趋势,6 mL 时洗脱量显著增加(P<0.05),在7 mL 时又下降。通过FS 和SE 图像对比分析可知,洗脱液体积小于5 mL 时,SE 未完全洗脱,导致FS 洗脱液中SE 的存在。由此可以解释5 mL 之前FS 洗脱量随洗脱体积增加而下降,在6 mL 之后SE 洗脱量没有发生明显上升,说明在6 mL 左右SE 已洗脱完全,则可将6 mL 定为SE 的最佳洗脱体积,计算此时SE的洗脱量为(334.69±18.09)μg。而FS 洗脱量在6 mL 时出现一个峰值,可将6 mL 定为FS 的最佳洗脱体积,此时FS 的洗脱量为(695.64±31.50)μg。
由图1(c,d)可知,ASG 的洗脱量随着洗脱液体积的增加,在6 mL 处出现最大值,在4~5 mL内,洗脱量显著增加(P<0.05),洗脱液体积大于6 mL 后,洗脱量差异不显著(P<0.05);SG 的洗脱量在洗脱液体积为3~5 mL 时显著减少(P<0.05),5~6 mL 时上升,且之后差异不显著(P>0.05)。通过ASG 和SG 图像对比分析可得,洗脱液体积小于6 mL 时ASG 未完全洗脱,导致SG 中混有ASG,ASG 洗脱量在6 mL 之后变化不大,可认为此时ASG 已洗脱完全,可取6 mL 为其最佳洗脱体积,此时ASG 洗脱量为(1 856.69±38.22)μg。SG 在洗脱液体积为5 mL 时洗脱量最少,5~6 mL 时开始上升,此时应是SG 逐步洗脱的表现,在7 mL 后洗脱量基本不变,可将7 mL 定为其最佳洗脱条件,此时SG 洗脱量为(828.66±32.78)μg。
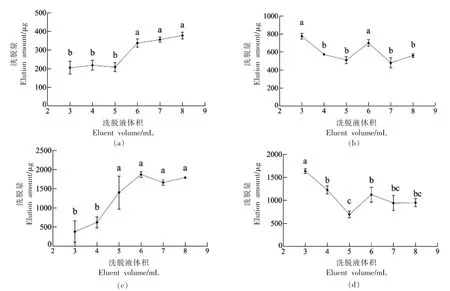
图1 洗脱液体积对SE(a)、FS(b)、ASG(c)、SG(d)洗脱量的影响Fig.1 Effects of eluent volume on the elution amount of SE (a),FS (b),ASG (c) and SG (d)
2.3 UPLC-Triple-TOF/MS 分析结果
2.3.1 花菜中植物甾醇总离子流色谱图及解析 花菜中4 种结合状态的甾醇经UPLC-Triple-TOF/MS 分析检测,总离子流图见图2。分析图中各峰,并结合文献中各甾醇二级质谱的特点,筛选出丰度较高且可能是甾醇母离子的离子进行检索,最后通过精确分子质量与实测质荷比的对比,对误差范围在±5 ppm 以内的分子式进行筛选。经筛选得到4 个游离甾醇峰(图2a),1~4 分别为豆甾醇、菜油甾醇、羽扇豆醇、β-谷甾醇;3 个甾醇酯峰(图2b),1~3 分别为菜油甾醇亚油酸酯、豆甾醇油酸酯、β-谷甾醇油酸酯。2 个甾醇糖苷峰(图2c),1~2分别为菜油甾醇葡萄糖苷、β-谷甾醇葡萄糖苷。5个酰化甾醇糖苷峰(图2d),1~5 分别为菜油甾醇葡萄糖苷棕榈油酸酯、菜油甾醇葡萄糖苷二十碳烯酸酯、豆甾醇葡萄糖苷亚麻酸酯、β-谷甾醇葡萄糖苷二十碳烯酸酯、β-谷甾醇葡萄糖苷亚麻酸酯。
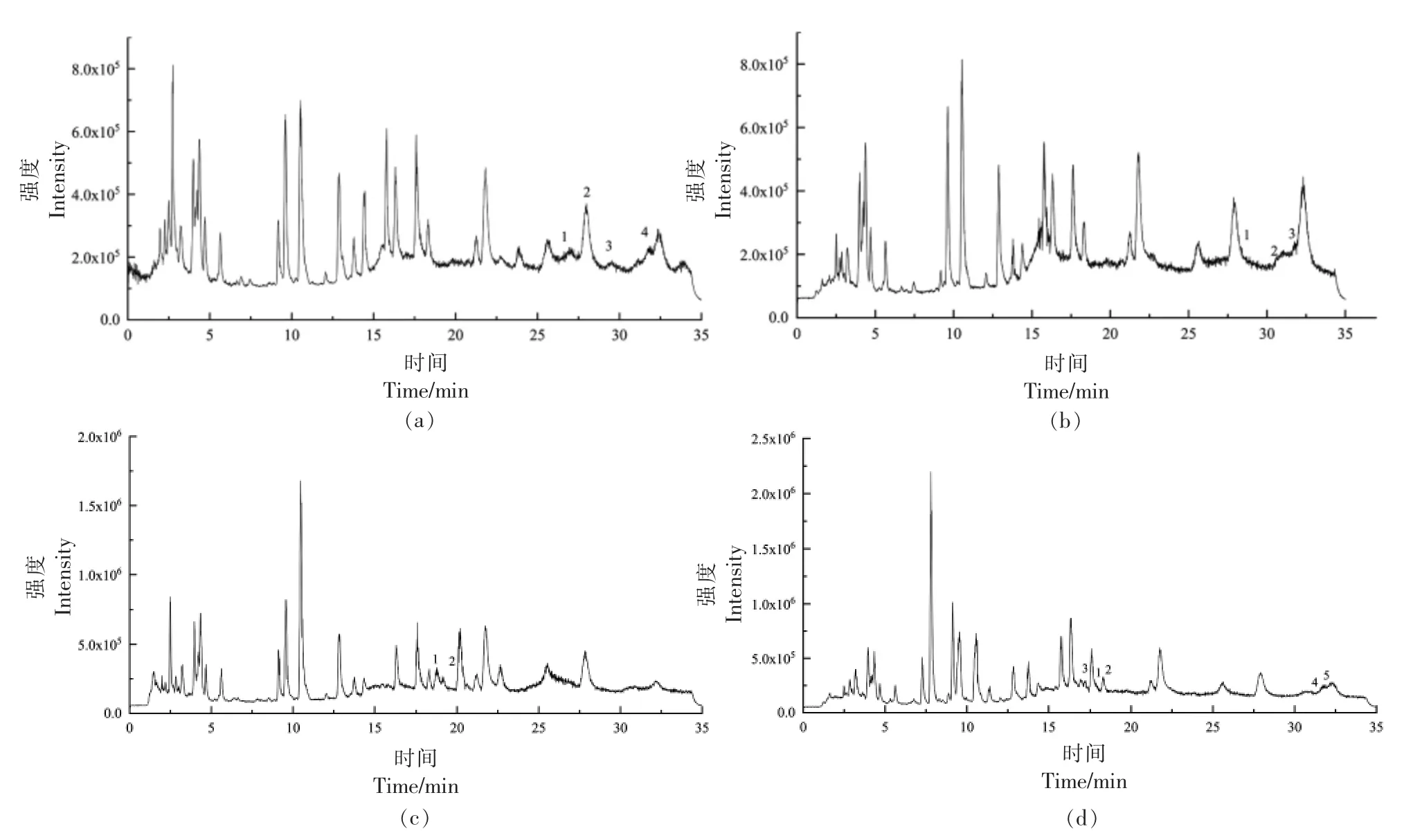
图2 花菜中甾醇UPLC-Triple-TOF/MS 总离子流色谱图Fig.2 UPLC-Triple-TOF/MS total ion current chromatogram of phytosterols from cauliflower
2.3.2 游离甾醇(FS)质谱解析 FS 各峰具体信息见表2,对应的二级质谱图如图3所示,分析图中碎片离子峰,并与相关文献比对,得到其结构式。对化合物1 的[M+H-H2O]+离子峰m/z 395.3368 进行二级质谱裂解分析,得到m/z 121.1012,m/z 147.1163,m/z 161.1325,m/z 175.1474,m/z 257.2260,m/z 297.2565,m/z 353.3215,m/z 379.3372,m/z 395.3668 等碎片离子峰(图3a),根据相关文献[15],与豆甾醇裂解规律相符,因此推断化合物1为豆甾醇(C29H48O)。Mo 等[16]选择[M+H-H2O]+的一个丰富的产物离子作为定量剂,除油菜素甾醇和豆甾醇分别从C17 侧链上除去84 和98 个质量单位形成m/z 297 产物离子外,大多数片段离子是通过切割甾醇C 环形成,还检测到m/z 161 的产物离子,对应于油菜素甾醇和豆甾醇的碳环断裂。对化合物2 的[M+H-H2O]+离子峰m/z 383.3668 进行二级质谱裂解分析,得到m/z 109.1017,m/z 133.1011,m/z 147.1165,m/z 161.1325,m/z 173.1325,m/z 215.1796,m/z 243.2097,m/z 287.2738,m/z 383.3668 等碎片离子峰(图3b),参考相关文献[14,16],其裂解规律与菜油甾醇一致,因此推断化合物2为菜油甾醇(C28H48O)。对化合物3 的[M+H-H2O]+离子峰m/z 409.3822 进行二级质谱裂解分析,得到m/z 109.1015,m/z 121.1013,m/z 137.1319,m/z 149.1321,m/z 163.1476,m/z 175.1484,m/z 245.2257,m/z 259.2412,m/z 353.3205,m/z 409.3822 等碎片离子峰(图3c),其裂解规律与羽扇豆醇相符,因此推断化合物3 为羽扇豆醇(C30H50O)。Khatal 等[17]研究发现,在APCI 阳离子模式下,羽扇豆醇在m/z 409.5 处有一基峰[M+H-H2O]+,二级质谱显示m/z 137.3 是一个突出的产物离子。对化合物4 的[M+H-H2O]+离子峰m/z 397.3821 进行二级质谱裂解分析,得到m/z 133.1018,m/z 135.1165,m/z 147.1173,m/z 203.1791,m/z 215.1793,m/z 243.2105,m/z 255.2100,m/z 287.2723,m/z 397.3821 等碎片离子峰(图3d),其裂解规律与β-谷甾醇一致[16],因此推断化合物4 为β-谷甾醇(C29H50O)。

表2 FS 一级质谱图表Table 2 FS first-order mass spectrometry chart
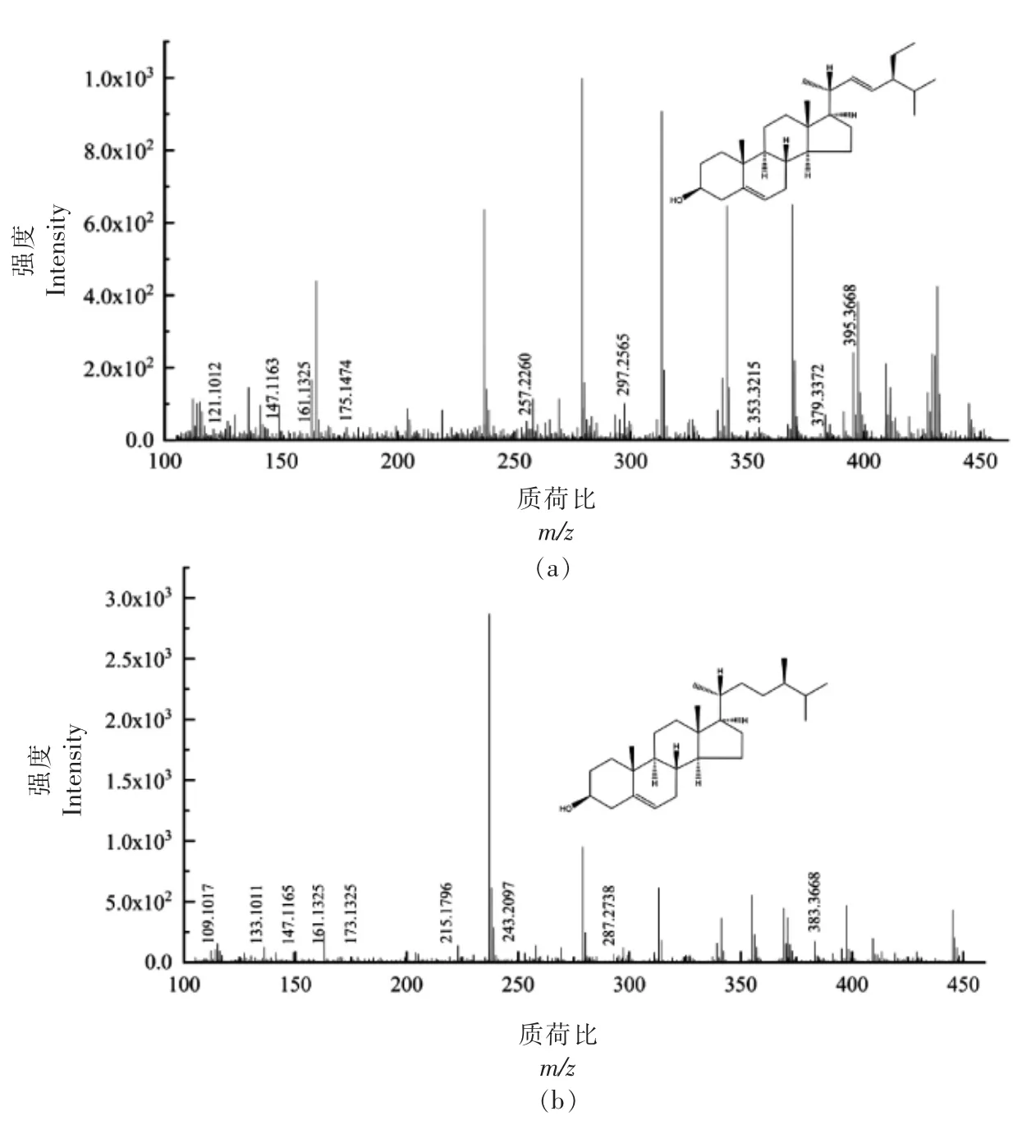

图3 FS 各峰二级质谱图Fig.3 Secondary mass spectrogram of each peak of FS
2.3.3 甾醇酯(SE)质谱解析 甾醇酯在APCI 正离子模式下形成[M-FA+H]+碎片离子[18],可通过甾核母离子[M-FA+H]+的质荷比,区分不同甾醇核的酯。对化合物1 进行二级质谱裂解分析,得到m/z 109.1017,m/z 133.1011,m/z 135.1169,m/z 147.1167,m/z 189.1644,m/z 203.1787,m/z 243.2105,m/z 257.2261,m/z 281.2482,m/z 301.2899,m/z 383.3671,m/z 663.6085 等碎片离子峰(图4a),m/z 383.3671为菜油甾醇特征峰,m/z 281.2484 为亚油酸(C18H32O2)特征峰,m/z 663.6085 为分子离子峰,根据相关文献[19],与菜油甾醇亚油酸酯分子质量理论值相当,因此推断化合物1 为菜油甾醇亚油酸酯(C46H78O2)。Rocha 等[20]采用ESI-MS 和串联质谱对菜籽油中的甾醇酯进行分析,质谱结果显示SE的铵加化合物([M+NH4]+)是基峰,串联质谱显示了[(M+NH4)-NH3]+(m/z 663.7)片段的形成,特别是甾醇片段离子[(M+NH4)-NH3-FA]+(m/z 383.4)的形成,可鉴定该化合物为18∶2-菜油酯。对化合物2 进行二级质谱裂解分析,得到m/z 105.0704,m/z 147.1161,m/z 187.1481,m/z 189.1632,m/z 203.1788,m/z 243.2102,m/z 255.2110,m/z 283.2644,m/z 363.3059,m/z 395.3674,m/z 677.6236 等碎片离子峰 (图4b),m/z 395.3674 为豆甾醇特征峰,m/z 283.2644 为油酸(C18H34O2)特征峰,m/z 677.6236 为分子离子峰,与豆甾醇油酸酯分子质量相符,因此推断化合物2 为豆甾醇油酸酯,分子式为C47H80O2。Tan 等[21]以响应性、信噪比和线性度为选择标准研究植物甾醇酯的最佳特性离子,选择了m/z 394,m/z 255,m/z 43 作为豆甾醇油酸酯的特征离子。对化合物3 进行二级质谱裂解分析,得到m/z 161.1331,m/z 175.1490,m/z 189.1631,m/z 203.1786,m/z 257.2258,m/z 261.2564,m/z 283.2622,m/z 315.3060,m/z 355.3364,m/z 397.3824,m/z 679.6389 等碎片离子峰 (图4c),其中m/z 397.3824 为β-谷甾醇特征峰,m/z 283.2622 为油酸(C18H34O2)特征峰,m/z 679.6389 为分子离子峰,参考相关文献[22],与β-谷甾醇油酸酯分子质量相当,因此推断化合物3 为β-谷甾醇油酸酯(C47H82O2)。
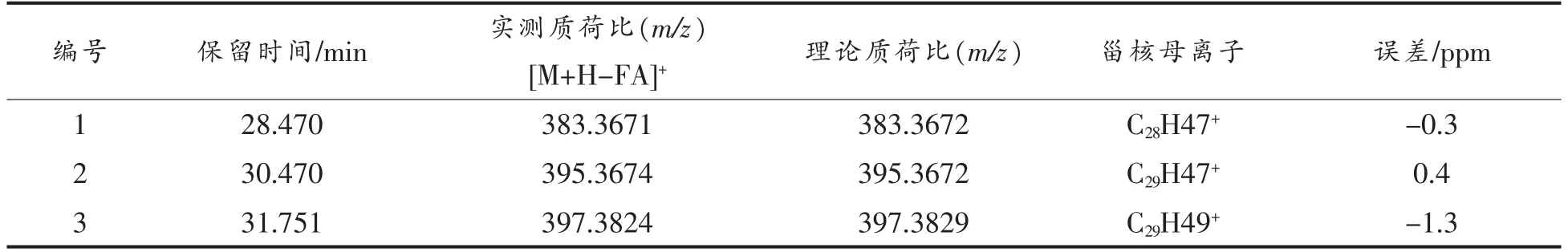
表3 SE 一级质谱图表Table 3 SE first-order mass spectrometry chart

图4 SE 各峰二级质谱图Fig.4 Secondary mass spectrogram of each peak of SE
2.3.4 甾醇糖苷(SG)质谱解析 在SG 的最常见形式中,糖单体(通常是D-吡喃葡萄糖)连接到甾醇的C3 羟基上,SG 可水解生成甾醇[23]。SG 各峰具体信息见表4,为获得更多结构信息,需对其进行二级质谱裂解分析。对化合物1,裂解得到m/z 109.1009,m/z 135.1164,m/z 161.1324,m/z 175.1482,m/z 189.1645,m/z 203.1794,m/z 215.1804,m/z 243.2099,m/z 257.2264,m/z 273.2574,m/z 301.2880,m/z 383.3674,m/z 563.4326 等碎片离子峰(图5a),与相关文献[24-25]比对,甾醇糖苷的甾核母离子为菜油甾醇,m/z 563.4326 为分子离子峰,因此推断化合物1 为菜油甾醇葡萄糖苷(C34H58O6)。化合物2 的[M+HGlc]+离子峰m/z 397.3832 进行二级质谱裂解分析,得 到m/z 107.0854,m/z 147.1164,m/z 161.132,0,m/z 189.1630,m/z 203.1787,m/z 215.1794,m/z 243.2099,m/z 257.2259,m/z 261.2568,m/z 287.2730,m/z 315.3052,m/z 397.3832,m/z 577.4461 等碎片离子峰(图5b),结合相关文献[24,26]其裂解规律与β-谷甾醇相符合,甾醇糖苷的甾核母离子为β-谷甾醇,m/z 577.4461 为分子离子峰,因此推断化合物2 为β-谷甾醇葡萄糖苷(C35H60O6)。Munger 等[14]对以上3 种甾醇糖苷的研究表明,MS/MS 谱中主要的特征峰为m/z 147 和m/z 161,表示它们的△5 结构,谷甾醇糖苷和菜油甾醇糖苷侧链的缺失导致的特征峰为m/z 257,而豆甾醇糖苷的特征峰为m/z 255 表示C22 不饱和侧链。豆甾醇葡糖苷的进一步特征是m/z 297 的显性出现,这是区分不饱和侧链甾醇和饱和侧链甾醇的另一个特征。

表4 SG 一级质谱图表Table 4 SG first-order mass spectrometry chart
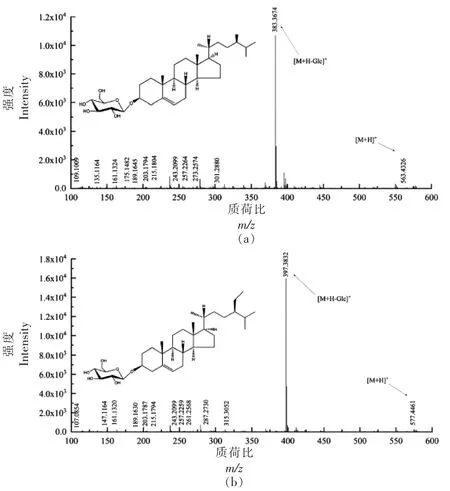
图5 SG 各峰二级质谱图Fig.5 Secondary mass spectrogram of each peak of SG
2.3.5 酰化甾醇糖苷(ASG)质谱解析 D-葡萄糖单体通过糖苷键与甾醇体中C3 的羟基结合,糖部分的C6 羟基进一步被脂肪酸酰化,从而形成ASG。ASG 各峰具体信息见表5,对化合物1 进行二级质谱裂解分析,得到m/z 109.1010,m/z 135.1174,m/z 161.1331,m/z 175.1473,m/z 243.2115,m/z 257.2262,m/z 273.2581,m/z 301.2888,m/z 383.3673,m/z 799.6435 等碎片离子峰(图6a),m/z 383.3673 为[M+H-Glc-FA]+离子峰,甾核为菜油甾醇,m/z 799.6435 为分子离子峰[M+H]+,因此推断化合物1 为菜油甾醇葡萄糖苷棕榈油酸酯(C50H86O7)。Usuki 等[27]在对发芽糙米麸皮中酰化甾醇糖苷结构分析中,m/z 818.3 的MS/MS 谱图中,前体离子(m/z 818.3)为[棕榈酰化菜油酯 基 β-葡萄糖苷+NH4]+,m/z 401.2 和m/z 383.2 分别为[棕榈酰化β-葡萄糖-H2O+H]+和[菜油甾醇-H2O+H]+。对化合物2 进行二级质谱裂解分析,得到m/z 109.1012,m/z 135.1167,m/z 161.1319,m/z 189.1643,m/z 203.1787,m/z 215.1792,m/z 273.2573,m/z 383.3670,m/z 855.7095等碎片离子峰 (图6b),m/z 383.3670 为[M+HGlc-FA]+离子峰,裂解规律同化合物1,甾核为菜油甾醇,m/z 855.7095 为分子离子峰[M+H]+,因此推断化合物2 为菜油甾醇葡萄糖苷二十碳烯酸酯(C54H94O7)。对化合物3 进行二级质谱裂解分析,得到m/z 107.0852,m/z 147.1166,m/z 161.1318,m/z 173.1323,m/z 187.1747,m/z 201.1640,m/z 257.2253,m/z 273.2578,m/z 395.3676,m/z 835.6471等碎片离子峰 (图6c),m/z 395.3676 为[M+HGlc-FA]+离子峰,甾核为豆甾醇,m/z 835.6471 为分子离子峰[M+H]+,因此推断化合物3 为豆甾醇葡萄糖苷亚麻酸酯(C53H86O7)。对化合物4 进行二级质谱裂解分析,得到m/z 109.1016,m/z 135.1166,m/z 147.1169,m/z 189.1644,m/z 203.1784,m/z 257.2265,m/z 287.2744,m/z 315.3036,m/z 397.3837,m/z 869.7251 等碎片离子峰(图6d),m/z 397.3837 为[M+H-Glc-FA]+离子峰,其裂解规律与β-谷甾醇相符,甾核为β-谷甾醇,m/z 869.7251为分子离子峰[M+H]+,因此推断化合物4 为β-谷甾醇葡萄糖苷二十碳烯酸酯(C55H96O7)。对化合物5 进行二级质谱裂解分析,得到m/z 109.1015,m/z 133.1007,m/z 147.1165,m/z 161.1323,m/z 203.1795,m/z 215.1785,m/z 355.3371,m/z 397.3829,m/z 837.6576 等碎片离子峰(图6e),m/z 397.3829 为
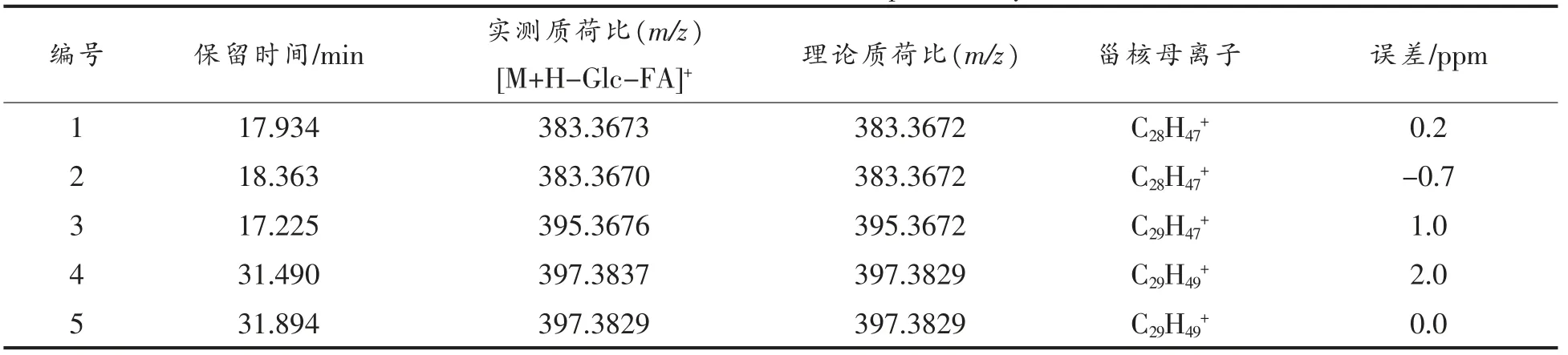
表5 ASG 一级质谱图表Table 5 ASG first-order mass spectrometry chart
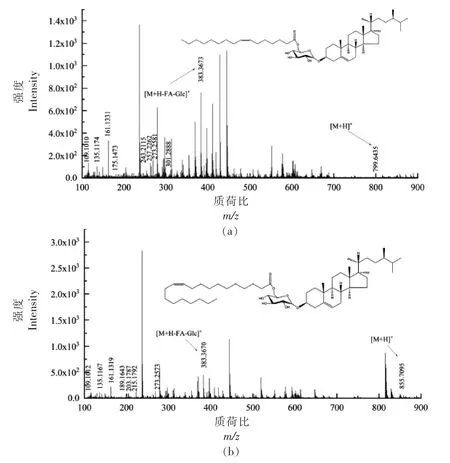
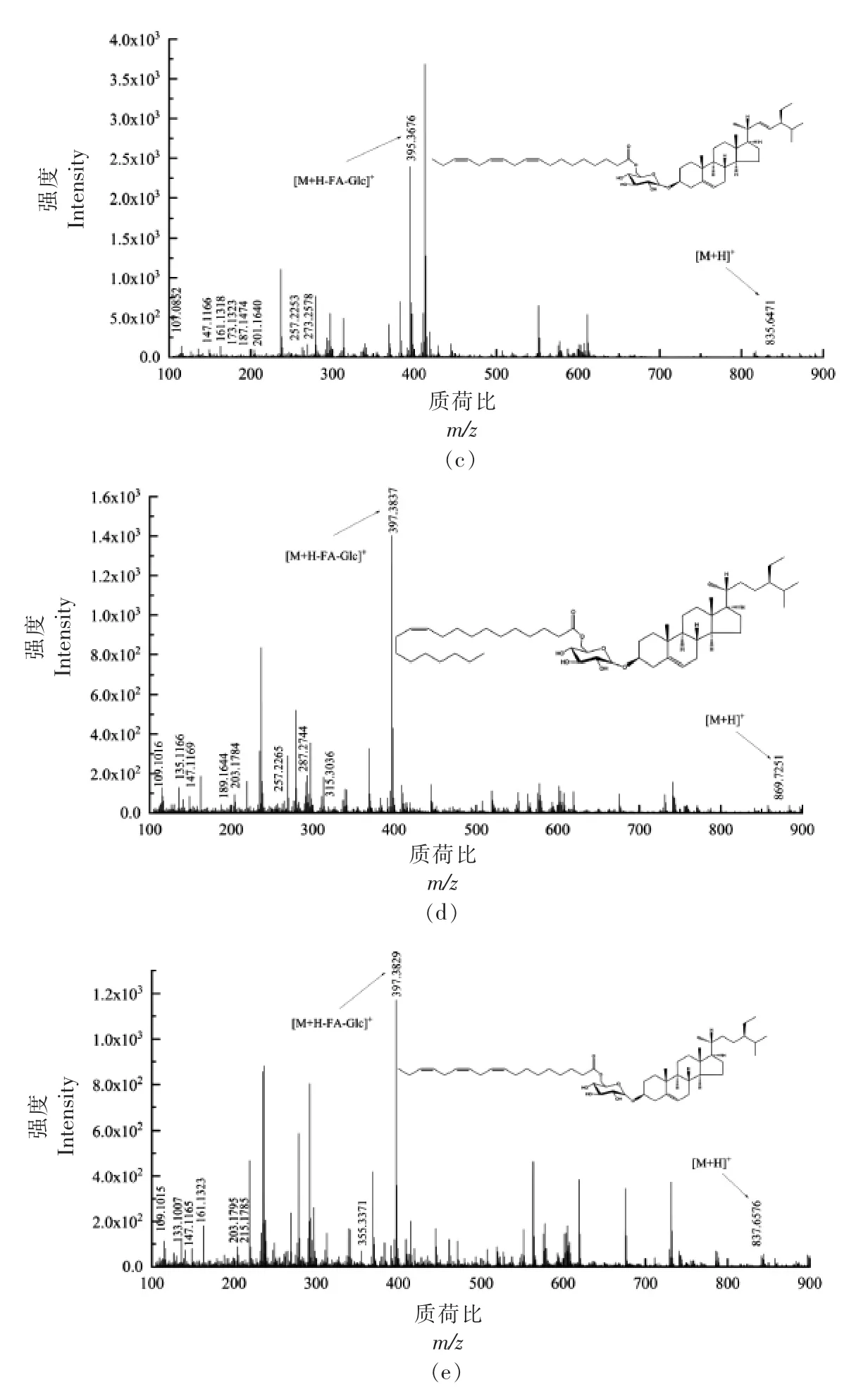
图6 ASG 各峰二级质谱图Fig.6 Secondary mass spectrogram of each peak of ASG
[M+H-Glc-FA]+离子峰,甾核为β-谷甾醇,m/z 837.6576 为分子离子峰[M+H]+,因此推断化合物5为β-谷甾醇葡萄糖苷亚麻酸酯 (C53H88O7)。Yamauchi 等[28]采用LC-MS 法从红甜椒中检测出β-谷甾醇基(6'O-亚麻酸酰基)葡萄糖苷,得到如下质谱数据m/z 859([M+Na]+),m/z 411([C29H47O]+),m/z 397([C29H49]+),m/z 215([C16H23]+),m/z 261([R]+),[R]+为脂酰部离子。其裂解规律与化合物5 基本符合,m/z 859([M+Na]+-Na+H)即为m/z 837([M+H]+)。
3 结论
本研究采用固相萃取法(SPE)分离花菜中4种结合状态的植物甾醇,再用UPLC-Triple-TOF/MS 法分析鉴定其甾醇的种类与结构。结果表明,通过紫外分光光度法粗测花菜中甾醇含量为(5.034±0.097)mg/g。固相萃取法分离纯化4 种结合状态的甾醇最佳洗脱条件为6 mL 己烷-乙醚(99∶1)洗脱SE,6 mL 己烷-乙醚(85∶15)洗脱FS,6 mL 庚烷-异丙醇(92∶8)洗脱ASG,7 mL 庚烷-异丙醇(85∶15)洗脱SG。在最佳洗脱条件下得到的甾醇的洗脱量分别为SE:(334.69±18.09)μg,FS:(695.64±31.50)μg,ASG:(1856.69±38.22)μg,SG:(828.66±32.78)μg。花菜中主要含有的游离甾醇(FS)有豆甾醇、菜油甾醇、羽扇豆醇、β-谷甾醇,含有的甾醇酯(SE)有菜油甾醇亚油酸酯、豆甾醇油酸酯、β-谷甾醇油酸酯,含有的甾醇糖苷(SG)有菜油甾醇葡萄糖苷、β-谷甾醇葡萄糖苷,含有的酰化甾醇糖苷(ASG)有菜油甾醇葡萄糖苷棕榈油酸酯、菜油甾醇葡萄糖苷二十碳烯酸酯、豆甾醇葡萄糖苷亚麻酸酯、β-谷甾醇葡萄糖苷二十碳烯酸酯、β-谷甾醇葡萄糖苷亚麻酸酯。

