植物甾醇对其凝胶化大豆油结构稳定性和热氧化特性的影响
林荣发,钟晓芳,戴美娜,刘祖文,马穆彪,江 洲,傅 红*
(1 福州大学生物科学与工程学院 福州 350108 2 福建天马科技集团股份有限公司 福州 350308)
利用有机凝胶剂构筑晶体网络结构以固化液态油脂,是重要的代替反式脂肪和饱和脂肪的油脂凝胶化技术[1]。植物甾醇具有降低胆固醇、免疫调节等生理功能,是许多国家认可的食品添加剂或新资源食品[2-3]。2006年,Bot 等[4]首次研究β-谷甾醇和γ-谷维素混合物在植物油中的凝胶性能,与其它单一组分的凝胶剂(如乙基纤维素[5]等大分子凝胶剂和12-羟基硬脂酸[6]等小分子凝胶剂)不同,β-谷甾醇的羟基与γ-谷维素的羰基形成分子间氢键,在β-谷甾醇和γ-谷维素质量比为2∶3时,产生最大的氢键效应[7],两者通过氢键相互吸引形成自组装晶体并构成网络结构将液态油脂包裹其中[8]。
目前,植物甾醇凝胶剂的研究主要集中于凝胶机理、微观结构和力学性能等方面[9-11],然而,其凝胶化油脂的氧化特性未见报道。有研究表明,β-谷甾醇对氧自由基具有抑制作用[12],γ-谷维素的阿魏酸基团和共轭体系能够阻断油脂氧化自由基的链式传递[13],然而,等物质的量的β-谷甾醇和γ-谷维素的自组装凝胶对油脂氧化的影响尚未明确。凝胶化油脂的氧化状态可能与有机凝胶剂含量、凝胶网络结构和加工方式等因素相关[5,14-15]。本文以大豆油为基料油,研究β-谷甾醇和γ-谷维素自组装的植物甾醇凝胶剂对油脂氧化的影响,包括凝胶网络结构的稳定性、β-谷甾醇和γ-谷维素各自对油脂氧化的影响以及植物甾醇凝胶化油脂在贮藏加工过程中的氧化特性,并利用核磁共振氢谱分析其热氧化行为,以期为植物甾醇凝胶化油脂的工业化生产及产品的氧化稳定性研究提供依据。
1 材料与方法
1.1 材料与试剂
大豆油,嘉里特种油脂(上海)有限公司;β-谷甾醇(纯度95%),西安开来生物工程有限公司;γ-谷维素(纯度95%),随州佳科医药化工有限公司;氘代氯仿(光谱纯),美国CIL 公司;其它试剂均为国产分析纯级。
1.2 仪器与设备
DF-101S 集热式加热搅拌器,巩义市予华仪器公司;DNP-9052 恒温培养箱,上海侦翔机电科技公司;MCR302 旋转流变仪,奥地利安东帕公司;BK-POLR 偏振光显微镜,重庆奥特光学仪器公司;5977A 气相色谱仪,美国安捷伦科技公司;500 MHz 核磁共振波谱仪,德国布鲁克科技公司。
1.3 试验方法
1.3.1 样品制备 分别向大豆油中添加2%,4%,6%,8%,10%(质量分数)的植物甾醇凝胶剂(β-谷甾醇与γ-谷维素质量比2∶3),在130 ℃下加热搅拌11 min,冷却至室温后置于25 ℃恒温培养箱中保存24 h[16]。对照组只含有大豆油,单独添加β-谷甾醇或γ-谷维素的样品步骤同上。
1.3.2 加速氧化 模拟贮藏组:分别将不同植物甾醇凝胶剂添加量的样品置于45 ℃恒温培养箱贮藏1~10 d。模拟加工组:分别将6%植物甾醇凝胶油置于30~180 ℃烤箱加热0~2.5 h。热氧化组:将6%植物甾醇凝胶油置于70 ℃烤箱避光贮藏35 d。
1.3.3 顶空耗氧量的测定 气相色谱仪参数:TCD 检测器,进样口温度120 ℃,检测器温度230℃,柱温25 ℃,载气(He2)流速5 mL/min,尾吹气(He2)流速3 mL/min,分流比50∶1[17]。顶空耗氧量按公式(1)计算。

式中,顶空原始氧气含量为(20.8±0.1)%。
1.3.4 传统氧化指标的测定 过氧化值的测定:参照GB 5009.227-2016 《食品安全国家标准 食品中过氧化值的测定》[18];丙二醛含量的测定:参照GB 5009.181-2016 《食品安全国家标准 食品中丙二醛的测定》[19];茴香胺值的测定:参照GB/T 24304-2009《动植物油脂 茴香胺值的测定》[20]。总氧化值为茴香胺值与4 倍的过氧化值之和[21]。
1.3.5 流变学性质 45 ℃条件下,保持应变为0.01%(线性黏弹区域内),频率范围0.1~100 Hz[22],测定样品的弹性模量(G′)和黏性模量(G")随频率变化的曲线。
1.3.6 偏振光显微镜的观察 取适量样品于载玻片上,盖上盖玻片轻压成透明均匀的薄片,用偏振光显微镜观察样品的微观晶体形态,放大倍数为200。
1.3.7 核磁共振氢谱的测定 取1 mL 样品溶解于5 mL 氘代氯仿中,涡旋5 s 混匀后,取0.6 mL移入核磁管,室温静置5 min。1H NMR 谱测定参数为:扫描次数16 次,以四甲基硅烷(TMS,δ=0)为内标,谱宽δ 0~20,脉冲间隔2 s,脉冲序列zg30[23]。
1.4 数据处理与分析
所有试验均重复测定3 次,利用SPSS 19 软件进行数据统计分析,P<0.05 表明存在显著性差异。
2 结果与分析
2.1 植物甾醇添加量对凝胶结构稳定性的影响
质量分数4%,6%,8%,10%的植物甾醇凝胶剂(β-谷甾醇与γ-谷维素质量比2∶3)对凝胶化大豆油频率和黏弹性模量曲线关系的影响如图1所示。在10-1~102Hz 扫描范围内,4%添加量样品的G′和G" 随频率的增加而增加,表现为频率依赖性,说明还未形成稳定的凝胶。6%~10%添加量时,样品的G′和G"不依赖于频率变化,且G′始终大于G",表现为类固体状态,说明体系已形成稳定的凝胶网络。从凝胶机理看,β-谷甾醇和γ-谷维素在大豆油中形成的氢键数量随着凝胶剂添加量的增加而增多,自组装晶体密度增大,形成稳定的凝胶网络结构,并最终呈现出类似固体的流变学行为。
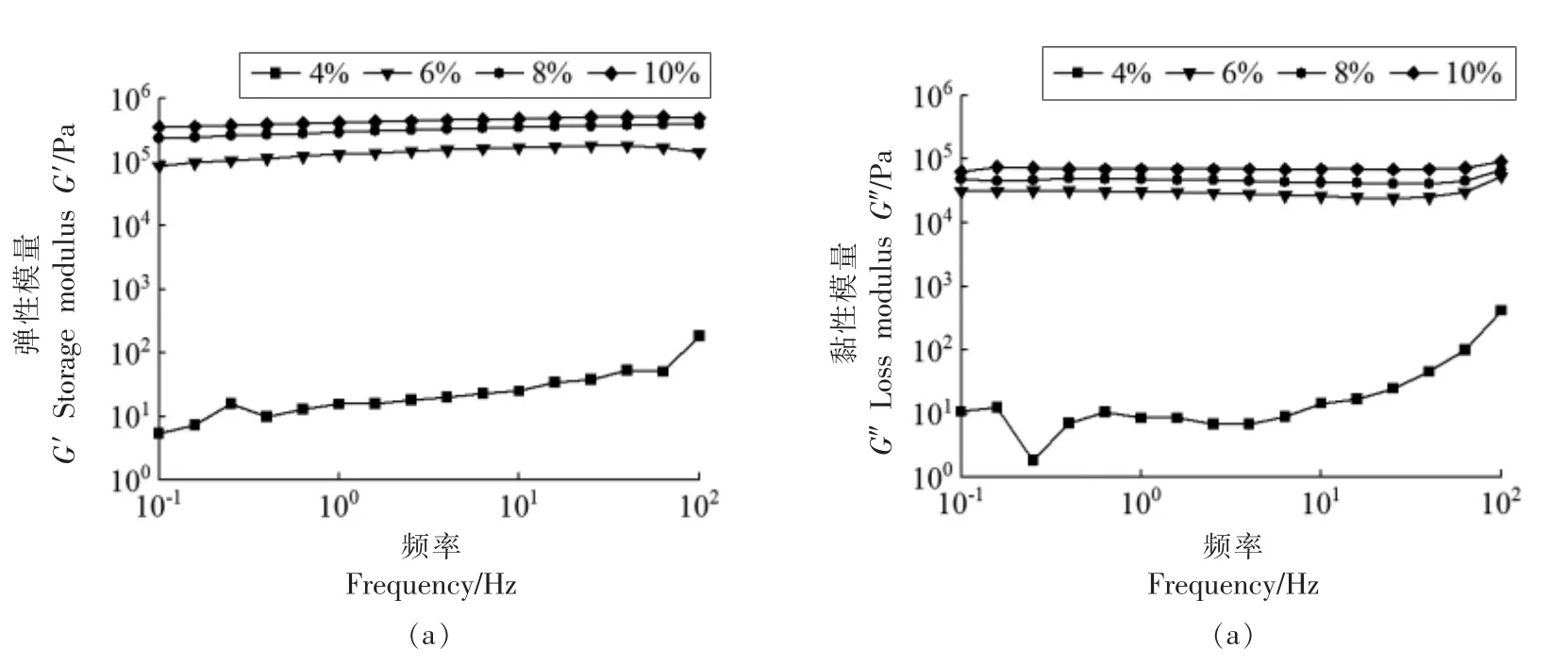
图1 不同植物甾醇凝胶剂添加量对大豆油频率-黏弹性模量曲线的影响Fig.1 Effect of different additions of phytosterol organogelators on the curves of frequency and storage and loss modulus of soybean oil
用偏振光显微镜观察4%和6%的植物甾醇凝胶剂对凝胶化大豆油晶体形态的影响。如图2所示,在45 ℃下贮藏1~10 d(2~4 d,6~9 d 的偏振光显微镜图未列出),添加4%凝胶剂的油脂体系几乎没有成型的晶体,6%植物甾醇凝胶化油脂存在大量簇状聚集针状晶体,呈现出规则且紧密的形似蒲公英的聚集态,这与图1显示的类固体流变特征相对应。另外,图像显示贮藏10 d 时,6%植物甾醇凝胶化油脂的晶体充分形成并聚集延伸为致密的凝胶网络结构。
2.2 植物甾醇凝胶剂添加量对大豆油氧化的影响
在45 ℃贮藏10 d,植物甾醇凝胶剂的添加量对油脂过氧化值、丙二醛含量和顶空耗氧量的影响如图3所示。已有研究表明,顶空耗氧法能动态反映油脂氧化过程中氧气的消耗量,适用于准确直观反映凝胶化油脂的氧化程度[5,17]。数据显示,过氧化值随着凝胶剂添加量(2%~10%)的增加呈增大趋势,而在添加量为6%时,与4%添加量相比,过氧化值下降了0.21 mmol/kg;顶空耗氧量和丙二醛含量的变化趋势一致,当添加量为2%,4%时,显著高于对照组(P<0.05)。在6%添加量时,顶空耗氧量和丙二醛含量均表现为最低,与4%添加量相比顶空耗氧量下降11.60%(P<0.05),丙二醛含量下降0.77 mg/kg (P<0.05)。当添加量为8%,10%时,顶空耗氧量基本不变,丙二醛含量虽然有所增加,但仍显著小于4%添加量(P<0.05)。由此可见,添加6%植物甾醇凝胶剂的凝胶化大豆油的氧化稳定性最好。这一结论与图1和图2的数据相对应,表明此时大豆油凝胶结构稳定,阻碍油脂和氧气的分子运动,提高了油脂氧化稳定性。

图2 不同凝胶剂添加量和贮藏时间的凝胶化大豆油偏振光显微镜图Fig.2 Polarized light microscopy images of oleogels with different organogelators addition and storage periods

图3 植物甾醇凝胶剂添加量对油脂氧化的影响Fig.3 Effect of the addition of phytosterol organogelators on the oxidation of soybean oil
2.3 β-谷甾醇和γ-谷维素分别对油脂氧化的影响
在45 ℃贮藏10 d,β-谷甾醇、γ-谷维素及其凝胶态对油脂氧化的影响如图4所示。数据显示,单独添加β-谷甾醇的顶空耗氧量与添加量呈负相关(r=-0.866,P<0.01),在添加量为8%,10%时,比对照组显著降低(P<0.05),表现出一定的抗氧化作用。单独添加γ-谷维素的顶空耗氧量均比对照组显著升高(P<0.05),与添加量呈正相关(r=0.912,P<0.01),说明γ-谷维素具有促氧化作用。虽然有研究表明,添加适量(约1%以内)谷维素能提高油脂的氧化稳定性[24-25],但是为使大豆油凝胶化,本试验考察的γ-谷维素添加量均大于1%(2%~10%的植物甾醇凝胶剂,其中β-谷甾醇与γ-谷维素质量比2∶3)。因此,γ-谷维素的促氧化作用可能与其它链阻断型酚类抗氧化剂类似,即添加量超过最佳水平的酚类化合物及其酚基会参与氧化副反应,促进油脂氧化[26]。

图4 植物甾醇凝胶剂及其成分对油脂顶空耗氧量的影响Fig.4 Effect of phytosterol organogelators and its components on the headspace oxygen consumption of oil
同时,数据显示,当添加量为2%,4%时,植物甾醇凝胶剂的顶空耗氧量约等于β-谷甾醇与γ-谷维素各自的顶空耗氧量按2∶3 比例的叠加之和,如2%添加量时,β-谷甾醇、γ-谷维素油脂体系的顶空耗氧量分别为28.70%,34.41%,两者按2∶3 叠加之和约等于植物甾醇凝胶剂的真实顶空耗氧量32.22%。当添加量为6%~10%时,凝胶剂的顶空耗氧量远低于两者按比例叠加之和(降低约10%),暗示植物甾醇凝胶剂在6%以上的添加量后,形成的稳定凝胶结构更加充分地阻碍油脂氧化。以上结果显示,β-谷甾醇和γ-谷维素凝胶剂的抗氧化效应主要是β-谷甾醇和稳定的凝胶化网络共同贡献的结果。
2.4 加工温度和时间对油脂氧化的影响
凝胶化油脂应用于特种油脂时,将随着复杂的食品制作过程经历不同的加工温度和时间。其中,不同加热温度(30~180 ℃)对6%植物甾醇凝胶化油脂的顶空耗氧量的影响如图5所示。数据显示,30~120 ℃下加热1 h,植物甾醇凝胶化大豆油的顶空耗氧量与对照组基本相当;在150,180℃下加热1 h,虽然顶空耗氧量均显著增加(P<0.05),但6%植物甾醇凝胶化油脂的顶空耗氧量略低于对照组。为进一步研究植物甾醇凝胶化油脂在高温条件下的氧化稳定性,对其进行不同时间的加热处理。图6数据显示,180 ℃下加热0~2.5 h,6%植物甾醇凝胶化油脂的顶空耗氧量始终低于对照组,且随着加热时间的延长,两者的顶空耗氧量差距逐渐增大,在2.5 h 时,顶空耗氧量相差5.00%,说明在高温加工条件下6%的植物甾醇凝胶剂有利于减缓油脂氧化的程度。
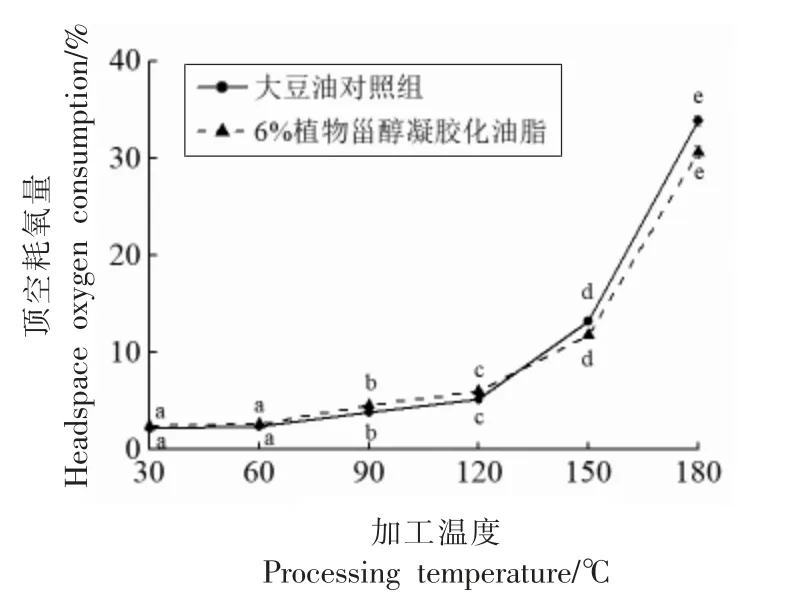
图5 加热1 h 时不同加热温度对凝胶化大豆油顶空耗氧量的影响Fig.5 Effect of heating temperatures on the headspace oxygen consumption of soybean oil for heating one hour

图6 180 ℃下不同加工时间对凝胶化大豆油顶空耗氧量的影响Fig.6 Effect of different processing times on the headspace oxygen consumption of soybean oil at 180 ℃
2.5 植物甾醇凝胶化油脂的热氧化分析
图7是新鲜制备的6%植物甾醇凝胶化油脂的核磁共振氢谱(1H NMR)图,δ 0~5.5 区间的9个峰分别对应甘油三酯中不同结构的氢质子。70℃热氧化过程中,1H NMR 位于δ 5.7~6.6(代表共轭二烯质子)和δ 9.5~9.8(代表醛质子)[27-28]区间的信号随着贮藏时间的延长而增强,如图8所示。这表明在植物甾醇凝胶化油脂的热氧化过程中,随着大豆油不饱和脂肪酸的氧化分解,烯族类(峰A)和二烯丙基(峰C)质子逐渐减少,饱和脂肪族质子(峰D、E、F、G、H)则相应增加,同时生成新的初级氧化产物和次级氧化产物,如共轭二烯和醛。
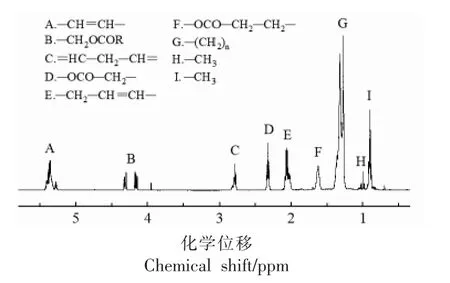
图7 植物甾醇凝胶化油脂的核磁共振氢谱谱图Fig.7 1H NMR spectra of phytosterol oleogels
图9为70 ℃贮藏过程中6%植物甾醇凝胶油的过氧化值和茴香胺值变化,两数值随时间延长而增加的趋势与图8油脂氧化产物的1H NMR 一致。为进一步定量分析凝胶油的氧化,将脂肪族质子(δ 0.6~2.5)与烯质子(δ 5.1~5.4)峰面积积分的比值记为Rao,脂肪族质子与二烯丙基亚甲基质子(δ 2.6~2.9)峰面积积分的比值记为Rad[5],并分别与总氧化值进行相关性分析,结果如图10所示。总氧化值与Rao、Rad的相关系数分别为0.9300,0.9185,具有较高的正相关性。因此,高场核磁共振技术可用于快速、无损估计植物甾醇凝胶化油脂在贮藏过程中的氧化稳定性。

图8 70 ℃贮藏过程中1H NMR 在δ 5.7~6.6和δ 9.5~9.8 的图Fig.8 1H NMR spectra at δ 5.7~6.6 and δ 9.5~9.8 during different storage periods at 70 ℃
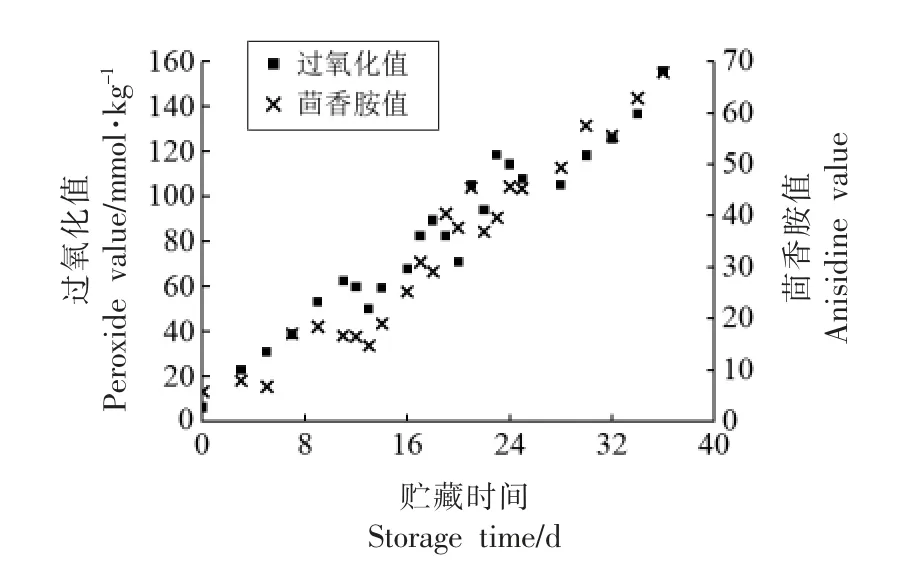
图9 在70 ℃不同贮藏时间的过氧化值和茴香胺值变化Fig.9 Changes of peroxide value and anisidine value during different storage periods at 70 ℃
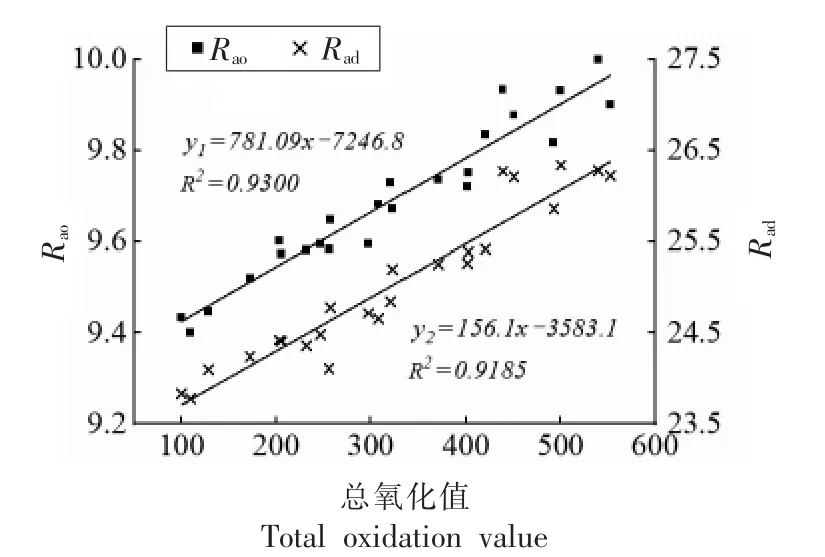
图10 植物甾醇凝胶化油脂总氧化值与Rao、Rad的相关性分析Fig.10 Correlation analysis of the total oxidation value of phytosterol oleogels with Rao and Rad
3 结论
β-谷甾醇和γ-谷维素植物甾醇型凝胶剂的氧化研究显示,45 ℃贮藏10 d 时,6%植物甾醇型凝胶剂添加量的凝胶化大豆油G′和G"不依赖于频率变化,且G′始终大于G",说明体系已形成稳定的类固体凝胶结构。过氧化值、丙二醛含量和顶空耗氧量的油脂氧化数据显示,添加6%植物甾醇凝胶剂的凝胶化大豆油的氧化稳定性最好;其中β-谷甾醇表现出一定的抗氧化作用,γ-谷维素具有促氧化作用,植物甾醇凝胶剂的抗氧化效应主要是β-谷甾醇和稳定的凝胶网络共同贡献的结果。同时,植物甾醇凝胶化油脂在180 ℃高温加工的氧化程度比对照组低,表现出较好的热氧化稳定性。70 ℃热氧化过程中,基于核磁共振氢谱的Rao、Rad值与总氧化值具有良好的正相关性。

