益生菌对2 型糖尿病患者恒定自然杀伤T 细胞、血糖指标、炎性因子及肠道菌群的影响*
冯 罡,仲威振,赵 洁,王晓丽
(1.青岛滨海学院附属医院内分泌代谢科,山东 青岛 266000;2.浙江省立同德医院内分泌代谢科,浙江 杭州 310012)
高盐、高糖及高脂的摄入等不良生活习惯导致肥胖及糖尿病(DM)等慢性代谢性疾病的发病率不断增加,其中以2 型糖尿病(T2DM)最多见[1-2]。恒定自然杀伤T(iNKT)细胞为特殊免疫细胞亚群,可通过多条代谢途径参与机体的免疫应答及维持脂肪组织的免疫稳态。iNKT细胞与脂肪组织炎症密切相关,而脂肪组织炎症是DM 发病的重要机制[3-4]。益生菌为有利于宿主的一种非致病性微生物,已被证实可改善DM 患者的糖代谢及肠道菌群失调等[5]。本研究中探讨了益生菌干预对T2DM 患者的iNKT 细胞、血糖指标、炎性因子及肠道菌群的影响,从而为防治T2DM提供参考。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合世界卫生组织(WHO)T2DM诊断和分型标准[6];无相关治疗或服药史,且近1 个月内未服用抗生素及微生物制剂。本研究经医院医学伦理委员会批准,患者签署知情同意书。
排除标准:单纯降血糖药不能控制血糖,需皮下注射胰岛素治疗;合并严重并发症;既往有胃肠道手术史及近期有胃肠道或肝胆系统疾病;合并严重心、肝、肾功能不全,及其他内分泌疾病及自身免疫性疾病。
病例选择与分组:本研究为随机对照研究。选取青岛滨海学院附属医院和浙江省立同德医院2018年3 月至2020年12 月收治的T2DM 患者102 例,按随机数字表法分为观察组及对照组,各51例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。
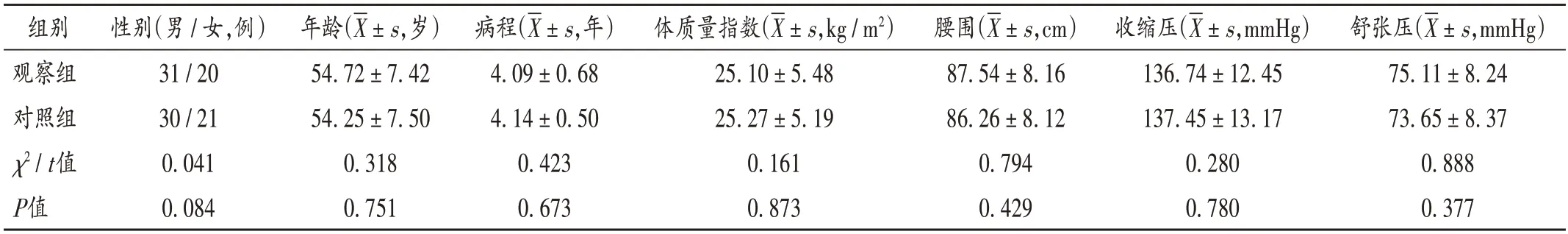
表1 两组患者一般资料比较(n=51)Tab.1 Comparison of the patients’general data between the two groups(n=51)
1.2 方法
两组患者均予基础治疗,包括糖尿病有关的饮食运动等健康指导、他汀类药物调脂等,并予盐酸二甲双胍缓释片(青岛黄海制药有限责任公司,国药准字H20040154,批号为2012159,规格为每片0.5 g),每次0.5 g,每日2 次,早晚饭后口服;阿卡波糖片(拜耳医药保健有限公司,国药准字H19990205,批号为8J56377,规格为每片50 mg),起始剂量为每次1 片、每日3 次,以后逐渐增加至每次2 片、每日3 次,餐前口服。观察组患者加服双歧杆菌三联活菌胶囊(晋城海斯制药有限公司,国药准字S19993065,批号为20200906,规格为每粒0.21 g),每次3 片,每日3 次,饭后温开水送服。两组患者均治疗8周。
1.3 观察指标与疗效判定标准
外周血iNKT 细胞比例及细胞因子水平:分别采集患者治疗前后的空腹静脉血各约3 mL,提取外周血淋巴细胞,加入CD3-PerCP 抗体及Vα24-Jα18FTTC 抗体后,采用流式细胞仪检测iNKT细胞比例。试剂盒购自北京索莱宝生物科技有限公司,按试剂盒说明书操作。将外周淋巴细胞接种到96 孔板中,经过培养、刺激、洗涤及重悬后,加入CD3-PerCP 抗体及Vα24-Jα 18FTTC抗体,染色,在经过孵育、洗涤、固定、重悬后,加入白细胞介素4-抗原提呈红细胞(IL-4-APC)抗体及藻红蛋白(IFN-γ-PE)抗体,采用流式细胞仪检测IL-4+iNKT及IFN-γ+iNKT因子水平。
血糖指标:分别采集患者治疗前后的静脉血各约3 mL,采用血糖仪检测外周血空腹血糖(FBG)、糖化血红蛋白(HbA1C)及餐后2 h血糖(2 hPG)水平。
外周血炎性因子:采用酶联免疫吸附(ELISA)法检测血清超敏C反应蛋白(hs-CRP)、白细胞介素6(IL-6)及脂多糖(LPS)水平,试剂盒均购自北京索莱宝生物科技有限公司,按试剂盒说明书操作。
肠道菌群分布:采集患者治疗前后的中段大便样本。采用定量法检测肠道菌群变化,包括大肠杆菌、球杆菌、双歧杆菌、乳杆菌。从无菌厌氧罐内取出1 g 粪便样本,溶于灭菌液中,按1∶10(m/V)稀释,反复多次稀释直至为原浓度的10-8,将大肠杆菌、球杆菌分别置需氧培养基中,37 ℃培养24 h,双歧杆菌、乳杆菌分别置厌氧培养基中,37 ℃培养48 h。计算各培养基中每1 g大便中的目标菌落数(平均菌落数×稀释倍数×500)。
疗效判定[7]:显效,血糖指标水平达标或降幅≥90%;有效,血糖指标水平降幅50%~<90%;无效,血糖指标水平降幅<50%、维持不变甚至有增加。总有效=显效+有效。
1.4 统计学处理
采用SPSS 20.0 统计学软件分析。计量资料首先采用Kolmogorov-Smirnov 检验进行正态性分析,符合正态分布的以表示,组间比较行独立样本t检验,组内比较行配对样本t检验,不符合正态分布的则采用非参数检验;计数资料比较行χ2检验;等级资料组间比较行秩和检验。P<0.05为差异有统计学意义。
2 结果
结果见表2至表7。
表2 两组患者外周血中iNKT细胞比例及细胞因子水平比较(,%,n=51)Tab.2 Comparison of the proportion of iNKT cells in peripheral blood and the cytokine levels between the two groups(,%,n=51)

表2 两组患者外周血中iNKT细胞比例及细胞因子水平比较(,%,n=51)Tab.2 Comparison of the proportion of iNKT cells in peripheral blood and the cytokine levels between the two groups(,%,n=51)
表3 两组患者外周血血糖指标水平比较(,n=51)Tab.3 Comparison of peripheral blood glucose index levels between the two groups(,n=51)

表3 两组患者外周血血糖指标水平比较(,n=51)Tab.3 Comparison of peripheral blood glucose index levels between the two groups(,n=51)
表4 两组患者外周血炎性因子水平比较(,n=51)Tab.4 Comparison of peripheral blood inflammatory factor levels between the two groups(,n=51)

表4 两组患者外周血炎性因子水平比较(,n=51)Tab.4 Comparison of peripheral blood inflammatory factor levels between the two groups(,n=51)
表5 两组患者肠道菌群水平比较[,lg(N/g),n=51]Tab.5 Comparison of intestinal flora levels between the two groups[,lg(N/g),n=51]
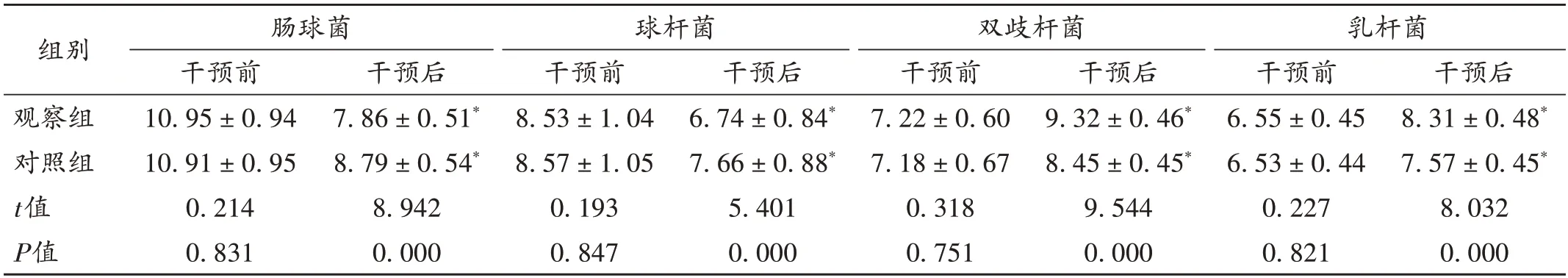
表5 两组患者肠道菌群水平比较[,lg(N/g),n=51]Tab.5 Comparison of intestinal flora levels between the two groups[,lg(N/g),n=51]
注:与本组治疗前比较,*P <0.05。Note:Compared with those before treatment,*P <0.05.

表6 两组患者临床疗效比较[例(%),n=51]Tab.6 Comparison of clinical efficacy between the two groups[case(%),n=51]

表7 两组患者不良反应发生情况比较[例(%),n=51]Tab.7 Comparison of incidence of adverse reactions between the two groups[case(%),n=51]
3 讨论
目前,临床治疗T2DM以口服降糖药物为主,如盐酸二甲双胍和阿卡波糖等,疗效已得到证实,但同时也有不良反应,故临床仍需寻求新的增效减毒治疗方案[8]。
iNKT 细胞属特殊的T 淋巴细胞亚群,其可通过识别由CD1d 分子提呈的脂质抗原,进而被激活,活化的iNKT 细胞可分泌IL-4 和IFN-γ 等多种细胞因子,进一步发挥免疫调节作用[9]。研究显示,肥胖患者外周血中iNKT 细胞比例降低,其分泌的抗炎因子水平也随之下降[10]。LYNCH 等[11]的研究表明,缺乏iNKT 细胞的模型小鼠通过高脂喂养后出现促炎因子水平升高而抑炎因子水平降低、体质量增加、FBG 显著升高等糖耐量受损现象,直接输注iNKT 细胞后,可改善模型小鼠iNKT细胞增殖活跃、体质量减轻等情况,提示iNKT 细胞与T2DM的发生、发展密切相关。
T2DM 也是一种由细胞因子介导的慢性炎性疾病,IL-6 和hs-CRP 等炎性因子水平的升高可能是T2DM进展的危险因素[12]。IL-6 是由活化的T细胞分泌的促炎细胞因子,其可促进B 细胞活化,产生大量IgG 抗体,进而使杀伤性T 细胞的过度活化,引起胰岛B 细胞死亡,导致胰岛素分泌不足。hs-CRP 是当机体受到刺激或损伤时由肝脏合成的一种急性期蛋白,是机体炎性反应的灵敏性指标。当各种刺激导致细胞因子分泌增多时,肝脏可促进合成hs-CRP,从而抑制胰岛素受体活性、加重胰岛素抵抗;而胰岛素抵抗会导致胰岛素敏感性下降,减弱对肝脏合成hs-CRP 的抑制作用,进一步促进其分泌增加。研究已证实,DM 患者外周血中IL-6和hs-CRP水平显著升高[13]。
LPS是革兰阴性细菌代谢过程中的主要产物,被认为是慢性炎症的关键刺激因子[14]。T2DM 患者的LPS 水平显著高于健康人群,经治疗后显著降低[15-16]。
肠道菌群紊乱可引发组织的慢性炎症及能量代谢紊乱等,进而导致机体胰岛素抵抗等[17],其与T2DM 发生、发展密切相关。T2DM 患者肠道中存在有害菌群增多状况,通过益生菌干预可显著增加肠道有益菌含量,改善肠道菌群失调状态[18-19]。郑雪萍等[20]的研究显示,益生菌联合常规降糖治疗可显著改善DM 患者的糖代谢指标,并提高原有治疗方案的临床疗效。SUN 等[21]的研究表明,使用益生菌联合降血糖药治疗后患者的炎性因子水平显著降低,说明益生菌具有调节免疫及减轻炎性反应作用。本研究结果显示,益生菌干预后患者的临床疗效、iNKT 细胞比例、IL-4+iNKT 比例显著升高,双歧杆菌及乳杆菌数量显著增加,其IFN-γ+iNKT 比例和FBG,HbA1C,2 hPG,hs-CRP,IL-6,LPS 水平均显著降低,肠球菌和球杆菌数量均显著减少,说明益生菌干预可改善T2DM 患者的免疫内环境、糖代谢、肠道菌群失调状况,并减轻机体的炎性反应。此外,两组患者的不良反应发生率相当,表明益生菌干预不会增加药品不良反应。
综上所述,益生菌干预可改善T2DM 患者的iNKT细胞水平、降低血糖和炎性因子水平,并改善肠道菌群失调状态。

