原位肝移植治疗暴发性肝衰竭型肝豆状核变性1例报道并文献复习
杨 悦, 黄 鹏, 魏涛华,, 李 祥,, 何望生, 杨文明,3
1.安徽中医药大学研究生院,安徽 合肥 230038;2.安徽中医药大学第一附属医院脑病中心;3.新安医学教育部重点实验室
肝豆状核变性(Wilson’s disease,WD)是由于ATP7B基因突变导致铜代谢障碍疾病,本病临床上表现复杂多变,误诊率较高。暴发性WD(fulminant Wilson’s disease,FWD)是WD中罕见的一种类型,病程进展迅速,死亡率极高。本文报道1例原位肝移植治疗FWD患者,总结其临床资料特征并进行文献复习,以期为罕见的肝脏疾病诊断和治疗提供借鉴。
病例患者,女,16岁,因“腹痛3个月”于2020年8月6日就诊于安徽中医药大学第一附属医院脑病三科。患者3个月前无明显诱因下出现腹痛,以脐周隐痛为主,疼痛持续,可自行缓解,未予以重视。病程中患者伴有巩膜黄染、四肢乏力、双下肢水肿,小便黄,大便溏,纳眠可。患者平素健康状况良好,无食物及药物过敏史。初潮年龄14岁,经期5~7 d,周期28 d,经量正常,月经颜色正常,无痛经及血块,已停经2个月。该患者系独生女,父母非近亲结婚,并否认家族三代以内有相似疾病发生。
入院时生命体征:体温36.7 ℃,心率91次/min,呼吸19次/min,血压115/71 mmHg,血氧饱和度93%。体格检查:精神疲惫,皮肤及巩膜黄染,腹部略膨隆,脐周压痛(+),腹肌紧张,无反跳痛,肝脾肋下未触及,双下肺呼吸音减弱,右肺明显,双下肢凹陷性水肿。眼科检查:角膜未见K-F环。实验室检查:血常规:RBC 2.26×1012L-1↓,Hb 95 g/L↓,PLT 94×109L-1↓,WBC 10.52×109L-1↑,NEU 7.84×109L-1↑;尿常规:尿胆红素3+,尿蛋白 弱阳性,亚硝酸盐 阳性;凝血常规:PT 41.3 s↑,INR 3.84↑,APTT 80.7 s↑,tt 26.2 s↑,FIB 0.85 g/L↓;GLU:2.76 mmol/L↓;生化检查:hs-CRP 12.15 mg/L↑,TP 50.3 g/L↓,ALB 18.4 g/L↓,PA 59 mg/L↓,TBIL 327.00 μmol/L↑,IBIL 171.00 μmol/L↑,DBIL 156.00 μmol/L↑,ALT 40 U/L↑,AST 149 U/L↑,AST/ALT 3.73↑,ALP 46 U/L,LDH 393 U/L↑,TBA 84.2 μmol/L↑,γ-GGT 62 U/L↑,ALB/GLB 0.58↓;急诊血浆氨测定68.8 μmol/L↑;肝炎全套、自免肝系列未见异常。心电图检查:窦性心动过速。胸部CT平扫:双肺下叶炎症,以右肺为主并局部实变可能,右侧胸腔积液伴邻近肺叶膨胀不全。血培养5 d无菌生长。上腹部CT:肝脏弥漫性病变,腹水(见图1)。肝脏胰脾腹腔超声:肝脏内部回声增粗增强,胆囊内絮状及实性低回声(胆泥可能),腹水(见图2)。铜代谢检查:铜氧化酶0.06活力单位/L↓;血清铜蓝蛋白(CER)0.058 g/L↓;血清铜17.56 μmol/L;24 h尿铜4 941 μg/24 h↑。基因检测显示,ATP7B基因存在c.2120A>G(p.Qln707Arg)和c.3982G>A(p.Ala1328Thr)复合杂合突变(见图3),WD诊断明确。入院后予以二巯丙磺酸钠注射液0.125 g qd静滴排铜,同时给予保肝、抗感染以及输注人血白蛋白、新鲜冰冻血浆等支持治疗。
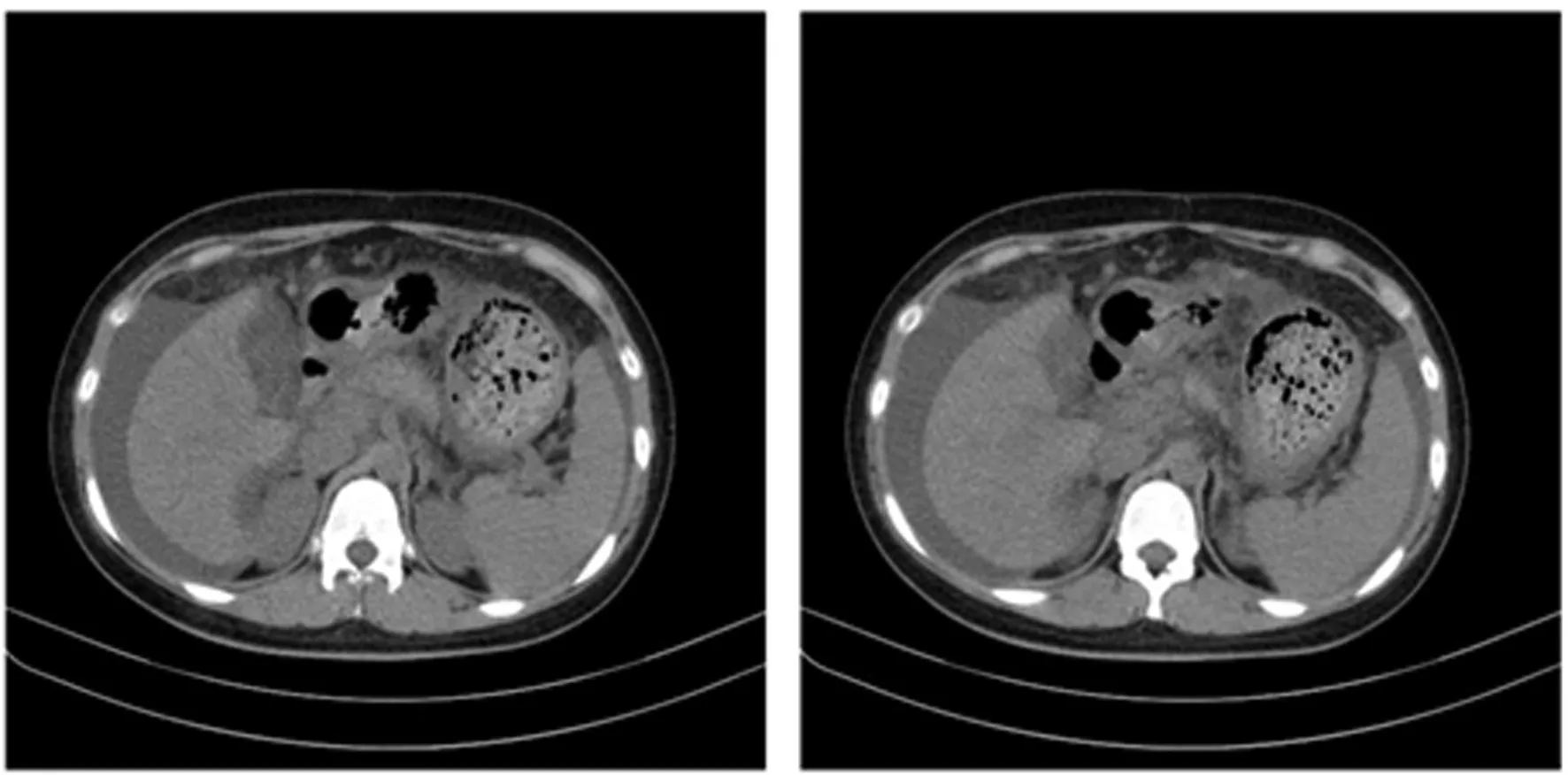
图1 上腹部CT:肝脏弥漫性病变,腹水
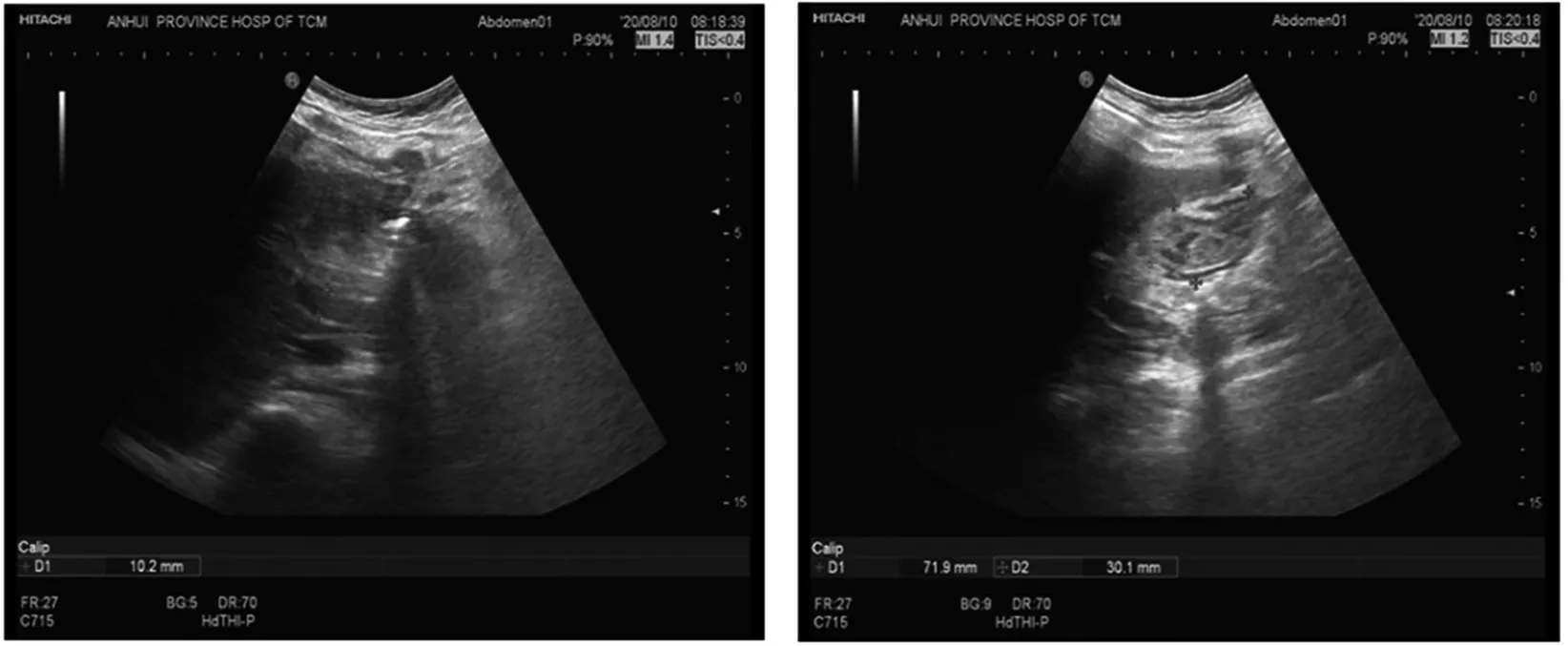
图2 肝胆胰脾腹腔超声:肝脏内部回声增粗增强,胆囊内絮状及实性低回声(胆泥可能),腹水

注:均为正向测序结果。
入院第5天出现意识障碍,呈昏睡状态,回答不切题,不欲饮食,夜间躁动不安,小便颜色深如茶色,大便3 d未解。实验室检测:急诊血浆氨测定81.9 μmol/L↑。考虑该患者处于肝病终末期,病情呈进行性加重,预后不佳,随时可能发生死亡风险,建议行肝移植或人工肝治疗。在排除相关禁忌证和得到适宜供肝后,患者于8月31日在外院行同种异体原位肝移植术(劈离式,右半肝供肝)。插管全麻成功后取平卧位,常规消毒铺巾,取上腹部“人”形切口,逐层切开进腹,探查:腹腔少量淡黄色腹水,约500 ml,肝脏缩小、质地硬、变形,表面有小结节,呈重度小结节性肝硬化(见图4),脾脏中度肿大,胃底、肝周静脉中度曲张,腹腔其余部分未探及转移肿瘤及肿大淋巴结。供肝重1 449 g,GRWR 2.2%,供肝肝右动脉内径约3 mm,胆总管直径约5 mm,门静脉内径约12 mm。术中出血量约500 ml,供肝冷缺血647 min,无肝期54 min,术后病理示:肝小叶结构破坏,肝细胞大片状坏死伴结节状增生,肝细胞及毛细胆内淤胆,汇管区见多量淋巴细胞浸润,小胆管增生明显伴胆栓形成,纤维组织增生分割肝小叶,特殊染色:铜染色(+,亮红色)(见图5),符合WD继发的重症肝炎伴结节性硬化。术后抗排异治疗方案为他克莫司+麦考酚钠肠溶片+甲泼尼龙。9月16日复查CER 0.217 g/L;9月24日复查CER 0.24 g/L;10月20日复查血常规未见异常;凝血常规:D-二聚体2.58 mg/L;肝功能:ALT 60 U/L,AST 149 U/L,TBIL 27.58 μmol/L,DBIL 11.81 μmol/L,ALP 241 U/L,γ-GGT 740 U/L,ALT/AST 0.4。

图4 病肝肉眼大体所见:21 cm×16 cm×8.5 cm灰红肝脏组织一个,表面及切面成弥漫及结节状改变,附胆囊一条,内含黄绿色胆汁,黏膜粗糙
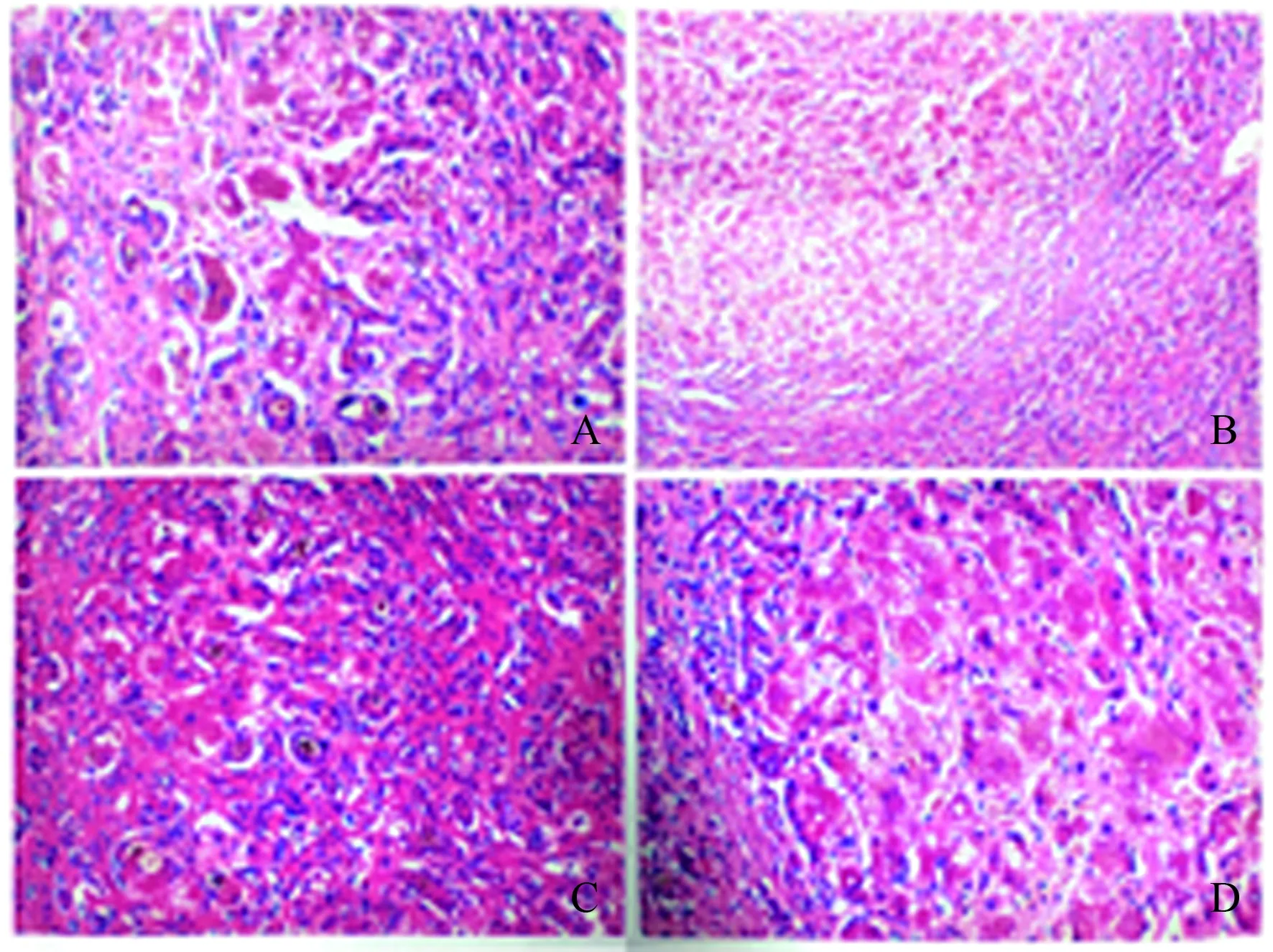
注:图A放大40倍,图B~D放大100倍。
讨论暴发性肝衰竭是指既往无肝病史的患者在26周内由于肝细胞大量急性坏死引起的明显的凝血功能障碍和肝性脑病,并可迅速发展为多器官衰竭的一种疾病,WD是引起暴发性肝衰竭的罕见病因之一[1]。WD是因ATP7B基因突变导致铜蓝蛋白合成障碍,铜在细胞内蓄积,通过类Fenton反应产生羟自由基,通过氧化损伤攻击线粒体,导致肝细胞死亡甚至肝衰竭[2]。FWD多见于青少年女性,病程进展迅速,预后不佳。本病目前尚缺乏统一的诊断标准,早在1991年Berman等提出,ALP/TB<4,AST/ALT>2.2,诊断FWD的灵敏性和特异性接近100%[3]。Shah[4]总结本病临床实验室指标具有以下特点:(1)Coombs试验阴性溶血性贫血;(2)肝脏合成功能障碍;(3)急性肾功能损伤;(4)血清转氨酶异常升高;(5)ALP正常或降低;(6)ALP/TB<4,伴AST/ALT>2.2。另有报道指出,FWD患者24 h尿铜均明显高于正常值,异常高尿铜可能是诊断FWD极有价值的指标[5]。
1986年Nazer等根据TB、INR、AST建立了Nazer评分,用于评价肝脏受损严重程度,表明≥7分FWD患者如果不进行肝移植,死亡率高[6]。后2005年Dhawan等通过回顾88例WD患儿临床特征和实验室检测指标,在Nazer评分基础加上ALB和WBC数值重新修正构成新威尔逊指数指出,当评分≥11时,需紧急进行肝移植[7]。原位肝移植是治疗FWD患者的有效途径[8],基于一个大型儿科WD队列研究结果显示,肝移植的中位年龄为14.0岁,总体患者生存率很高,分别为87%(1年生存率)、84%(5年生存率)和81%(10年生存率)[9]。研究表明,分子吸附剂循环系统和血浆置换治疗可以作为FWD的辅助治疗[10-11]。新近发现,甲烷菌素可以有效逆转威尔逊病大鼠模型肝铜积累和急性期的线粒体损伤,防止肝细胞死亡,具有作为治疗急性WD的治疗剂的潜力[12]。
本病例表现为青少年女性,急性起病,病程短,病情进展快,临床表现为急剧进行性加重性黄疸、腹腔积液、重度出血倾向,并发腹膜炎、肝性脑病、心肌损伤、肺部感染,ALP/TB<4,伴AST/ALT>2.2,诊断为FWD,经内科保肝治疗效果不佳,建议行肝移植治疗。此例患者通过原位劈离式肝移植术在短时间内肝功能、凝血功能得到恢复,明显改善体内的铜代谢情况,充分说明肝移植是治疗FWD的有效途径之一。本研究提示,对于以暴发性肝衰竭患儿需警惕WD可能,应结合患者临床症状、辅助检查结果及Leipzig评分、新威尔逊指数等量表尽早明确诊断,若积极内科保肝治疗无效,经济条件允许,应尽早启动肝移植程序,降低死亡率。

