玉米秸秆连续还田对土壤微生物群落组成的影响
何亚玲,崔慧珍,王兵兵,马 琨
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏大学西北土地退化与生态恢复国家重点实验室培育基地,宁夏 银川 750021)
秸秆还田是培肥地力,保持土壤养分平衡,提高土壤肥力最有效的措施和途径[1]。通过秸秆粉碎还田、深翻等方式,可以加快秸秆在土壤中腐熟速度,增加土壤有机质与速效养分,不断提高耕地质量[2]。相关研究认为,土壤微生物群落在作物秸秆的腐解中起着决定性作用,土壤微生物群落会对秸秆腐解过程作出响应[3]。土壤微生物能够提高土壤中无机物的有效性,促进植物根系对养分的吸收,提高土壤质量,改善土壤环境[4]。
长期秸秆还田可改善土壤质地,提高土壤固碳能力,增加作物产量和土壤微生物活性[5-6];Yang等[7]认为长期秸秆还田可形成更健康的土壤微生物群落。玉米秸秆还田后,土壤微生物对碳源的利用能力提高,微生物群落多样性及均匀度增加[8]。崔慧珍等[9]发现,持续玉米秸秆还田后,以磷脂脂肪酸(PLFAs)表征的土壤微生物生物量在秸秆还田后明显增加;水稻秸秆还田后,土壤中碳源种类产生变化,细菌优势种群及相应丰度改变[10];刘骁蒨等[11]认为,水稻秸秆覆盖还田配施适量的氮磷钾肥能显著提高土壤微生物生物量碳、氮和土壤的细菌多样性;Wu等[12]研究发现秸秆还田较无机肥处理的土壤中有更多的微生物类群。尽管不同作物秸秆还田管理后,土壤有机碳种类变化不同,但均增加了土壤微生物的多样性。因此,长期秸秆还田对土壤微生物的生存环境产生了一定的影响,有助于形成稳定的土壤微生物群落,对改善土壤肥力及土壤结构至关重要。
在农业生产中,除气候、土壤类型等因素之外,秸秆还田量是影响土壤微生物群落组成的一个重要因素。目前,有关秸秆还田后土壤微生物群落变化的研究,多集中于某一季作物的秸秆还田对土壤微生物群落的影响方面。因此,开展不同秸秆还田量的试验,研究连续玉米秸秆还田后,土壤微生物群落组成的变化特征及其与土壤理化性状间的相互关系,以期为提高该地区土壤肥力、促进土壤养分良性循环提供科学依据。
1 材料与方法
1.1 试验地概况
试验地位于宁夏同心县河西镇农场村(37°9′34″N,105°48′2″E)。海拔1 310 m,年平均降水量277 mm,平均蒸发量为2 330 mm,平均气温8.7℃。土壤类型为灰钙土,土壤质地为砂质壤土。2013年秋季,开始该试验前土壤基本理化性状为:pH 8.26;全盐0.28 g/kg;有机质9.2 g/kg;全氮0.54 g/kg;碱解氮41 mg/kg;全磷0.83 g/kg;有效磷41.5 mg/kg;全钾20.2 g/kg;速效钾216 mg/kg;缓效钾1 014 mg/kg;阳离子代换量9.3 cmol/kg。
1.2 试验设计
试验开始于2013年秋季,每年秋季在玉米收获后,将秸秆粉碎成3~5 cm的小段,深耕翻入0~40 cm土层。供试玉米品种为先玉335,播种密度为6 500株/667 m2,采用单因素随机区组设计,设秸秆还田量分别为0 t/hm2(M0)、0.3 t/hm2(M200)、0.6 t/hm2(M400)、0.9 t/hm2(M600)、1.2 t/hm2(M800)5个处理,3次重复,共15个小区,小区面积为60 m2(4 m×15 m)。玉米全生育期氮肥(N)年平均施用量为26 kg/667 m2,苗期追施60%,抽穗期追施30%,灌浆期追施10%;磷肥(P2O5)12.5 kg/667 m2和钾肥(K2O)2.5 kg/667 m2,苗期深施。
1.3 取样方法
2019年为连续试验的第6年,在当年6月18日(大喇叭口期)、9月22日(成熟期),按5点取样法,采集玉米行间0~20 cm土层土壤样本,同一小区的样本均匀混合为1个样本,各小区土壤样本独立。土样用冰盒保鲜带回实验室,过1 mm筛,一部分低温储存于-40℃冰箱,用于土壤微生物群落测定;一部分低温储存于-80℃冰箱,用于微生物多样性分析;剩余样品自然风干,用于土壤理化性状测定。
1.3.1 土壤理化性质土壤pH的测定采用电位计法,土壤总碳和全氮采用碳氮分析仪(Elementar Vario MAX)测定,全磷的测定采用HClO4-H2SO4消煮法,碱解氮的测定采用碱解氮扩散法,速效磷的测定采用NaHCO3浸提-钼锑抗比色法,速效钾的测定采用NH4OAc浸提-火焰光度法,含水量的测定采用烘干法[13]。
1.3.2 土壤微生物群落组成的测定土壤微生物群落结构多样性采用磷脂脂肪酸法(PLFA),参照魏常慧等[14]的方法,称取相当于4 g干土质量的鲜土于棕色玻璃瓶,加磷酸缓冲液,甲醇∶氯仿(2∶1)混合液105 mL,氯仿和无菌超纯水混匀振荡,黑暗培养18~24 h,经旋转蒸发仪浓缩和SPE硅胶柱分离磷脂脂肪酸,通过Agilent 7890B型气相色谱仪,MIDI Sherlock脂肪酸图谱微生物鉴定系统分析待测样品的成分,内标为正十九烷酸甲酯。
1.3.3 宏基因组测序流程首先,采用CTAB方法对土壤样本的基因组DNA进行提取[15],随后利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样品于离心管中,使用无菌水稀释样品至1 ng/μL。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物;使用New England Biolabs公司的PhusionHigh-Fidelity PCR Master Mix with GC Buffer为酶和缓冲液;使用高效和高保真的酶进行PCR扩增。接着,根据PCR产物浓度进行等浓度混样,选择主带大小在400~450 bp之间的序列,割胶回收目标条带。最后,委托天津诺禾致源生物科技有限公司,使用Illumina公司TruSeq DNA PCR-Free Library Preparation Kit建库试剂盒进行文库的构建,文库检测合格后,使用NovaSeq 6000进行上机测序。
1.4 数据处理
采用Microsoft Excel 2010进行数据整理,Origin 2019绘图,利用DPS 7.05单因素方差分析进行显著性检验,Canoco 5.0进行冗余分析。
2 结果与分析
2.1 秸秆连续还田在玉米关键生育时期对土壤微生物群落PLFA含量的影响
连续秸秆还田6年后,随秸秆还田量的变化,土壤微生物群落PLFA组成在玉米关键生育时期对玉米秸秆还田产生了不同的季节性响应特征(表1)。6月和9月的土壤样品分析结果显示,以PLFAs标记的细菌、真菌、放线菌、丛枝菌根真菌的脂肪酸含量,整体上表现为随秸秆还田量的增加而升高。与对照(M0)相比,M200在玉米大喇叭口期时(6月),土壤中细菌、革兰氏阳性菌、革兰氏阴性菌、丛枝菌根真菌PLFA含量有显著增加(P<0.05),分别较M0提高了75.31%、59.38%、87.76%、75.00%;M800在玉米大喇叭口期时(6月),土壤中革兰氏阴性菌、放线菌、真菌、丛枝菌根真菌的PLFA含量均有显著增加(P<0.05),较对照分别增加了71.43%、55.00%、109.09%和50.00%,但不同秸秆还田量处理间差异不著性(P>0.05)。

表1 秸秆连续还田对玉米不同生育时期对应土壤微生物群落PLFA质量比的影响 μg/g
玉米成熟期时(9月末),土壤主要微生物群落的PLFAs含量表现出与玉米大喇叭口期对应土壤类似的变化趋势,但不同秸秆还田量下,土壤细菌、革兰氏阳性菌、革兰氏阴性菌、放线菌、真菌、丛枝菌根真菌均与对照处理间有显著增加(P<0.05);与M200处理相比,当秸秆还田量为M800时,细菌、放线菌、丛枝菌根真菌间均有显著增加(P<0.05);与对照(M0)相比,M800在玉米成熟期时对应土壤中革兰氏阴性菌、放线菌、真菌、丛枝菌根真菌的PLFA含量均有显著增加(P<0.05),较对照分别增加了97.18%、77.14%、103.70%和133.33%,与玉米大喇叭口期对应土壤微生物的PLFA相比,革兰氏阴性菌、放线菌、丛枝菌根真菌分别提高了25.75%、22.14%、83.33%。可见,连续秸秆还田6年后,在对应作物的主要生育时期、受还田量的影响,以PLFAs含量表征的土壤微生物群落组成会发生显著变化。
土壤真菌/细菌PLFA含量的比值可用来表征2类微生物种群相对丰度的变化状况,比值越高说明农业生态系统越稳[16]。革兰氏阳性菌/革兰氏阴性菌PLFA含量的比值可以表征土壤营养胁迫程度,G+/G-越小,土壤质地越好[17]。由图1可见,随秸秆还田量的增加,土壤真菌/细菌PLFA含量比值在玉米大喇叭口期(6月)呈升高趋势;M600、M800与对照M0及M200间有显著差异(P<0.05),但玉米成熟期(9月),土壤真菌/细菌PLFA含量比值在各处理间并无显著差异(P>0.05)。在玉米大喇叭口期、成熟期,对应各处理土壤间的G+/G-脂肪酸含量均无显著差异(P>0.05)。可见,受不同用量玉米秸秆连续还田的影响,土壤生态系统的稳定性仍然较好;高还田量下,有促进生态系统稳定性增强的趋势,但不会显著影响革兰氏阳性菌/革兰氏阴性菌的比值。

图1 秸秆连续还田对土壤真菌/细菌(F/B)、革兰氏阳性菌/革兰氏阴性菌PLFA含量比值(G+/G-)的影响
2.2 玉米秸秆还田对土壤细菌群落相对丰度的影响
不同秸秆还田量下土壤细菌相对丰度在门、属水平下均存在一定的差异。由图2(a)可知,在门分类水平上,土壤Proteobacteria(变形菌门)和Acidobactera(酸杆菌门)细菌为优势菌群,各处理的相对丰度为47.05%~50.47%。随着玉米秸秆还田量的增加,各处理间变形菌门的相对丰度无显著差异,但酸杆菌门相对丰度呈增加趋势,与对照(M0)相比,M800处理下土壤酸杆菌门的相对丰度增加了13.83%,有显著差异(P<0.05)。由图2b可知,在属分类水平上,土壤细菌相对丰度较高的的4个类群分别为Sphingomonas(鞘氨醇单胞菌属)、Pedosphaera(叉丝单囊壳属)、Gemmatirosa和Gemmatimonas(芽单胞菌属),相对丰度达到总丰度的3.90%~4.73%,但随着秸秆还田量的次序增加,土壤细菌优势属的相对丰度有逐步逐步下降的趋势;与M0相比,在秸秆还田量为M800时,土壤芽孢杆菌属相对丰度较M0降低了17.65%,2个处理间有显著差异(P<0.05)。不同秸秆还田量处理间,土壤鞘氨醇单胞菌属、芽单胞菌属、叉丝单囊壳属相对丰度间并无显著差异(P>0.05)。可见,秸秆连续高量还田可以影响基于门、属水平下的土壤细菌群落组成相对丰度。

图2 玉米秸秆连续还田对基于门(a)、属(b)水平上土壤细菌相对丰度的影响
2.3 玉米秸秆连续还田对土壤细菌群落组成的影响
不同秸秆还田处理下,基于宏基因测序下35个相对丰度较高的物种聚类热图(图3)表明,玉米秸秆还田后土壤微生物群落的物种组成结构发生了变化。与M0相比,玉米秸秆还田后增加了变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、硝化螺旋菌门(Nitrospirae)和酸杆菌门(Acidobacteria)的相对丰度;显著降低了奇古菌门(Thaumarchaeota)、放线菌门(Actinobacteria)、毛霉门(Mucoromycota)、广古菌门(Euryarchaeota)、装甲菌门(Armatimonadetes)、迷踪菌门(Elusimicrobia)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、绿菌门(Chlorobi)等微生物类群的相对丰度(P>0.05)。当秸秆还田量为M200时,硝棘菌门(Nitrospinae)、降氨酸菌门(Candidatus Aminicenantes)、河床菌门(candidate division Zixibacteria)、护微菌门(Candidatus Tectomicrobia)、懒杆菌门(Ignavibacteriae)、蓝菌门(Cyanobacteria)等微生物类群相对丰度显著降低(P<0.05),拟杆菌门的相对丰度显著增加(P<0.05)。

图3 玉米秸秆连续还田后土壤细菌群落组成聚类热图分析
2.4 玉米秸秆连续还田对土壤细菌群落分布影响的PCA分析
主成分分析(PCA,Principal Component Analysis)结果表明(图4),第一排序轴(32.19%)和第二排序轴(14.11%)可在累积贡献率46.30%上揭示不同用量秸秆连续还田对土壤细菌群落组成的差异。图4中每个点代表一个样品,不同颜色代表不同的处理组,样点之间距离远近及空间分布离散程度,可反映样品细菌群落组成的相似度或差异性大小。尽管各处理下,土壤样点分布较为分散,但秸秆还田后各处理土壤样点与对照处理(M0)土壤样点在第一排序轴上分开。此外,M400、M600和M800处理的土壤样品空间分布聚集度提高,组间距离也较近。整体上,秸秆还田可影响土壤细菌群落的组成,但秸秆还田量在200~800 kg/666.7 m2时,土壤细菌群落组成的相似性仍较高。
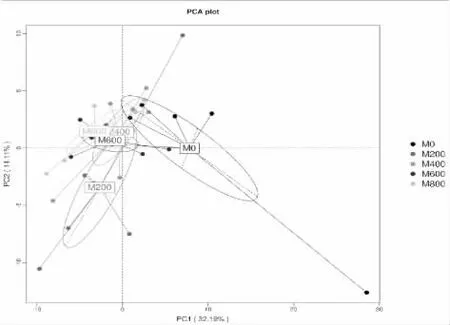
图4 玉米秸秆连续还田对土壤细菌群落分布影响的PCA分析
2.5 土壤主要细菌类群与土壤理化性状间的相互关系
第一主轴(RDA1)和第二主轴(RDA2)累计解释总方差的75.36%(图5a),土壤主要微生物类群与土壤理化性质间有较好的相关性。真菌、细菌、放线菌的PLFA含量与土壤速效钾、速效磷、全磷、全氮、碱解氮、有机质均呈正相关,与pH呈负相关。基于门水平上土壤细菌群落相对丰度与土壤理化性状间的相互关系在第一主轴(RDA1)和第二主轴(RDA2)累计解释变量为27.29%(图5a),蒙特卡罗检验表明,全氮(P=0.006)、碱解氮(P=0.008)是影响土壤主要微生物PLFA含量变化的主要因素;冗余分析结果表明,土壤总PLFAs量、细菌、真菌和放线菌PLFAs量与土壤全氮和碱解氮相关性较强。

图5 土壤微生物PLFA含量、土壤细菌群落相对丰度与土壤理化性状间相互关系的冗余分析
土壤中拟杆菌门、酸杆菌门、变形菌门细菌相对丰度与土壤有机质、全氮、碱解氮呈正相关;芽单胞菌门、绿弯菌门、疣微菌门、放线菌门等与pH、全磷呈正相关。但蒙特卡罗检验表明,只有土壤全氮与土壤细菌群落相对丰度间的相关性达到显著水平,土壤全氮(P=0.04)是驱动不同秸秆量连续还田下土壤细菌群落组成相对丰度发生变化的主要驱动因子。
3 讨论
3.1 秸秆连续还田对玉米不同生育时期下对应土壤微生物PLFA的影响
连续秸秆还田6年后,不同秸秆还田量下对应土壤微生物PLFAs含量均高于对照(M0),高量秸秆还田与对照间存在显著差异。于寒等[18]的研究证实,秸秆还田为微生物提供了丰富的碳源和氮源,促进了微生物的生长和繁殖,长期还田(15年)更能显著提高微生物生物量;王伟华等[19]的研究表明,长期秸秆还田直接调节和优化了土壤C/N,为土壤微生物的生长繁殖提供更多的能源、养分及适宜的土壤环境,导致土壤中微生物PLFAs含量升高,本文的研究结果与之一致。
试验中,随作物生育进程的变化,在玉米成熟期对应土壤样本中的土壤微生物PLFAs含量明显高于玉米大喇叭口期。分析认为,随秸秆还田时间的延长,秸秆的腐熟程度越高,微生物所能利用的有机碳含量越高,更有利于土壤微生物获得养分,并保护土壤微生物成分,如构成土壤微生物生物量大部分的细菌和真菌[20]。相关研究认为,以PLFAs表征的土壤微生物生物量随着干旱的加剧而降低,在潮湿、低温的环境下较高[21-22]。分析认为,玉米大喇叭口期是作物的需水高峰期,植物对水分的需求量极高,因此可能导致土壤中水分的迅速下降。由于研究区域的土壤水分限制,反而会导致土壤微生物的竞争作用加剧,可能是以PLFAs表征的土壤微生物总生物量在大喇叭口期间对应土壤样本中降低的主要原因。
真菌和细菌是土壤中2类重要的微生物,真菌/细菌的比值会影响土壤生态系统的稳定性。试验中,连续6年不同秸秆还田量下土壤微生物真菌/细菌比值在大喇叭口期对应土壤样本中的差异显著,在成熟期无明显差异。这说明,随秸秆还田量的增加,更有利于促进真菌的生长,但这与Bardgett等[23-24]人的研究报告中认为,高土壤肥力和养分有效性有利于细菌而非真菌的研究不一致,分析认为,秸秆还田条件下,土壤微生物群落的变化,可能并不能完全归因于资源供应的数量差异。Christophe的研究证实,秸秆资源的质量差异可使土壤细菌向真菌的转变[24]。此外,由于土壤丛植菌根真菌会向宿主转移大量的矿物质元素[25]。因此,在菌根真菌寄主植物玉米后,土壤丛植菌根真菌会消耗土壤养分[24]。而玉米大喇叭口期正是玉米对土壤养分需求的最大效率期,其较成熟期对土壤养分的耗养更大,因此,更易引起土壤微生物菌群的变化,而导致真菌/细菌的比值出现差异。与真菌/细菌比值变化不同的是,秸秆还田后对应各秸秆处理土壤间的G+/G-脂肪酸含量在玉米大喇叭口期、成熟期均无显著差异,但土壤G+、G-的PLFAs含量较M0处理均有显著差异,且随秸秆还田量增加而增加。崔慧珍等[9]研究也发现,尽管G+/G-在各处理间无显著性差异,但G-较G+所占细菌总磷脂脂肪酸含量比例大,本研究结果与之一致。徐学池等[26]的研究也证实了秸秆还田能够提高革兰氏阳性菌和革兰氏阴性菌的生物量,主要是因为G-对土壤环境的敏感度高,在富营养环境中生长速度高于G+的缘故。
3.2 秸秆连续还田对土壤细菌群落组成的影响
土壤细菌群落组成的改变是影响土壤微生物群落结构的重要原因[27]。本试验中,在门水平上,土壤变形菌门和酸杆菌门细菌为土壤优势菌群,这与前人[28]研究结果基本一致。在秸秆还田处理土壤中,变形菌门相对丰度最高,其次为酸杆菌门。由于大多数变形菌门细菌是营兼性或者专性厌氧生活,因此,变形菌门偏好干旱型土壤环境[29-30]。试验中,较M0相比,秸秆还田下变形菌门相对丰度更高,但不同秸秆还田量下土壤变形菌门无明显差异,高秸秆还田量显著增加了酸杆菌门的相对丰度。Zhang等[31]发现,与秸秆不还田相比,秸秆还田处理显著提高了土壤变形菌门的相对丰度,但各秸秆还田梯度间土壤变形菌门的相对丰度变化无规律性;李妍[32]认为随秸秆还田量的增加,很大程度上增加了土壤的碳氮含量,使土壤理化性质发生改变,促进了酸杆菌门的繁殖。此外,有研究发现酸杆菌具有许多编码纤维素酶和半纤维素分解酶的基因[33]。因此,随秸秆还田量的增加,土壤中需要被分解的高纤维素含量的秸秆越多,所施环境压力越大,促进了酸杆菌门的繁殖。
许多研究已经证实了土壤因素对土壤细菌群落组成的重要性[34]。在本研究中,土壤全氮和碱解氮含量是长期秸秆还田后影响土壤主要微生物PLFAs含量变化的主要因素,而土壤全氮是影响土壤细菌群落相对丰度的显著因子。任万军等[35]研究表明,秸秆的利用和活跃的土壤微生物活动,可以有效提高土壤有全氮、碱解氮的含量。在土壤碱解氮含量较高的条件下,土壤变形菌门的相对丰度才较高[36]。靳玉婷等[37]认为,土壤细菌包含多种代谢种类,且广泛参与了土壤氮元素的生物化学循环。如变形菌门中的α-变形菌中较多的为固氮菌,在固氮菌的作用下,游离的氮素能被植物吸收利用,同时改变了土壤中氮素的含量,进而影响了土壤细菌群落的组成。邱文静等[38]研究表明,固氮菌是土壤细菌类群中的重要组成部分,秸秆还田显著改变了固氮菌群落丰富度,提高了固氮菌群落的多样性,全氮能够改变固氮菌群落组成。这可能是土壤全氮影响细菌群落相对丰度的主要原因。
4 结论
玉米秸秆连续还田改变了土壤微生物群落的结构组成,土壤微生物的PLFA含量在玉米不同生育时期具有明显的变化特征;土壤变形菌门和酸杆菌门细菌是土壤优势菌门;土壤全氮、碱解氮是影响土壤主要微生物PLFA含量变化的主要因素;土壤全氮也是影响土壤细菌群落变形菌门、拟杆菌门等相对丰度变化的主导因子。

