非小细胞肺癌血浆天然CD25 抗体及FOXP3 抗体的表达变化及其作为诊断标志物的探讨
赵 欢 张 萱 李庆海 (青岛大学附属青岛市市立医院内分泌科,青岛 266071)
肺癌是我国发病率最高的恶性肿瘤,也是最常见的死亡原因,其病死率在同期恶性肿瘤中高居榜首[1]。肺癌最常见的病理类型是非小细胞肺癌,约占所有肺癌病例数的85%[2-3]。虽然放疗、化疗及分子靶向药物等对改善患者预后发挥了一定的积极作用,但目前肺癌的总生存率仍不超过15%[4]。约2/3 的肺癌患者在确诊时已属晚期[5]。因此,早期诊断对降低肺癌病死率至关重要。若患者在Ⅰ、Ⅱ期被诊断,五年生存率将提高至50%,若癌灶较局限时即被检测到,五年生存率则高达80%[6]。因此,寻找一种可用于肺癌早期诊断的生物标志物对于改善NSCLC预后具有重要的临床意义。
天然抗体(natural antibody,NAbs)是在完全缺乏外源性抗原刺激下,无菌小鼠及健康人血清中自发产生的抗体[7-8]。绝大部分天然抗体由B-1细胞经T 细胞非依赖性途径产生[9-10]。天然抗体能够识别并清除机体内的有害分子,在维持免疫稳态中发挥重要作用。如健康人血清可表达抗氧化型低密度脂蛋白天然抗体,通过与循环中的低密度脂蛋白结合促进其清除,从而降低心血管事件的发生风险[11-12]。天然抗体的水平随年龄增长逐渐下降。天然抗体的减少可造成体内某些有害分子蓄积,这与老年人群中的某些疾病如肿瘤、动脉粥样硬化等的高发有关[13]。提示天然抗体在作为肿瘤诊断标志物方面具有很大的潜在价值。目前国外已有学者提出,天然抗体可用作识别免疫相关疾病(如癌症)的生物标志物。
调节性T 细胞(regulatory T cells,Tregs)可促进肿瘤的免疫逃逸,在肿瘤发生、发展及转归中扮演重要角色[14]。CD25也称为IL-2受体α 链,主要表达在活化的T 细胞、B 细胞等表面,亦表达于Treg 细胞。FOXP3 作为转录因子叉头/翅螺旋家族的一个新成员,特异性表达于Treg,且与Treg的分化及免疫抑制功能密切相关[15-16]。本研究旨在运用抗原表位预测工具设计并合成CD25、FOXP3 线性抗原肽及自行建立的ELISA 检测方法,通过分析NSCLC 患者血浆CD25、FOXP3 天然抗体的表达变化,明确CD25、FOXP3 天然抗体表达的临床意义及其对NSCLC的诊断价值。
1 资料与方法
1.1 资料
1.1.1 研究对象与分组 选取2014 年11 月至2018年8月于青岛大学附属青岛市市立医院胸外科首次确诊、未经治疗的非小细胞肺癌(仅包括腺癌和鳞状细胞癌)患者200 例,所有患者的诊断均由2 名副高级以上病理科医师经术后病理确定。选取同期健康志愿者190 例作为正常对照组。排除标准:①患有肺部良、恶性肿瘤或其他来源的肿瘤;②恶性肿瘤家族史;③患有类风湿关节炎、系统性红斑狼疮等自身免疫性疾病者。本研究经青岛市立医院伦理委员会审核批准,所有患者均签署知情同意书。
1.1.2 试剂与仪器 96 孔酶标板(美国Thermo Fisher Scientific 公司);过氧化物酶标记的羊抗人IgG抗体(英国Abcam公司);1.0 mol/L磷酸盐缓冲液、磷酸盐缓冲片、小牛血清白蛋白(美国Sigma-Aldrich公司);显色剂及终止液(美国Life Technologies 公司);酶标仪(美国Bio Tek公司)等。
1.2 方法
1.2.1 血浆采集 于清晨、空腹状态下,采集两组研究对象外周静脉血5 ml,2 500 r/min 离心10 min后收集上层血浆,置于-80℃保存待用。
1.2.2 抗原的设计、合成 利用生物信息学数据库及在线表位预测软件设计抗原肽,过程简述如下:首先,逐条肽段评估其pH 值、亲水性、柔性、表面可及性、抗原性等特性。之后,评估每条肽段与HLA-Ⅱ51 个等位基因分子的结合力,筛选出与HLA-Ⅱ高结合力的肽段。然后,预测肽段中潜在的B 细胞表位。最终,对满足上述要求的肽段进行综合评估,结合抗原设计的一般原则进行适当调整以实现抗原的优化。基于上述过程,最终设计并委托上海吉尔生化公司合成了3 条抗原肽,分别为CD25a、CD25b、FOXP3。3 条抗原肽序列信息如表1所示。
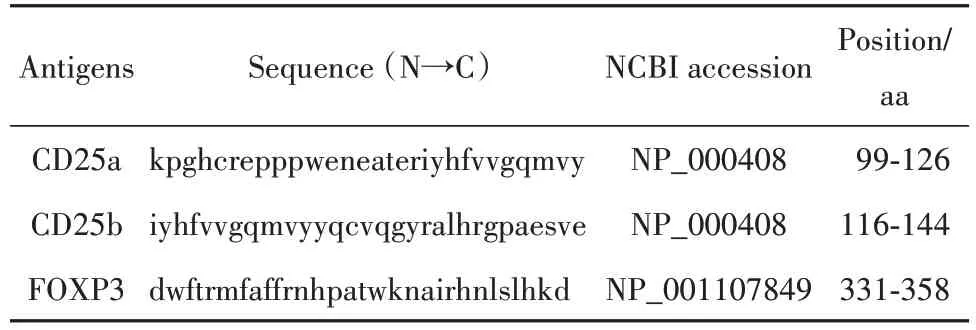
表1 CD25 与FOXP3抗原肽的序列信息Tab.1 Information of peptide antigens derived from CD25 and FOXP3
1.2.3 抗原的溶解与包被 67%冰乙酸溶解、稀释抗原至工作浓度5 mg/ml。按照Thermo Fisher Scientific说明书操作步骤包被抗原。
1.2.4 ELISA 法检测抗 CD25、FOXP3 抗体 实验操作步骤详见之前研究[17],现简述如下:0.1%PBST洗涤96孔酶标板3次,将血浆样本以0.5%BSA稀释100 倍后每孔加样50 μl,室温孵育1.5 h。将过氧化物酶标记的IgG 二抗以0.5%BSA 稀释50 000 倍后每孔加入50 μl,室温孵育1 h。洗板3次后每孔加入显色剂 50 μl,避光显色 25 min 后加入 25 μl 终止液终止反应,在450 nm标准波长和620 nm参考波长下读取吸光度。每板同时设空白对照、阳性对照、正常对照,每一样本均设双复孔。所有样本均重复测定2 次,以2 次测定值的平均值代表每一样本的OD值。以特异性结合指数(specific binding index,SBR)代表血浆 CD25、FOXP3 抗体的水平。SBR 的计算公式如下:SBR=(OD样本-OD阴性对照)(/OD阳性对照-OD阴性对照)。
1.3 统计学处理 应用SPSS22.0软件建立数据库并分析数据,采用Graphpad prism 5.0软件绘制ROC曲线,Kolmogorov-Smirnov检验对计量资料进行正态性检验,呈正态分布的数据采用Student'st检验进行组间比较,偏态分布的数据则采用Mann-WhitneyU检验进行组间比较。多个独立样本之间的两两比较采用LSD 检验。计数资料组间比较采用χ2检验。应用受试者工作特征(receiver operating characteristic,ROC)曲线分析 CD25、FOXP3 抗体对NSCLC 的诊断效能,并计算灵敏度及特异度。P<0.05为差异具有统计学意义。
2 结果
2.1 NSCLC 组及对照组的基线特征比较 NSCLC组 200 例,其中男 125 例,女 75 例,中位年龄为 60 岁(38~79岁)。对照组190例,其中男101例,女89例,中位年龄为59.5岁(38~79岁)。两组的性别、年龄、吸烟史等临床资料比较,差异均无统计学意义(P>0.05,表2)。
表2 NSCLC组及对照组的基线特征[,例(%)]Tab.2 Baseline characteristics of NSCLC patients and control subjects[,n(%)]
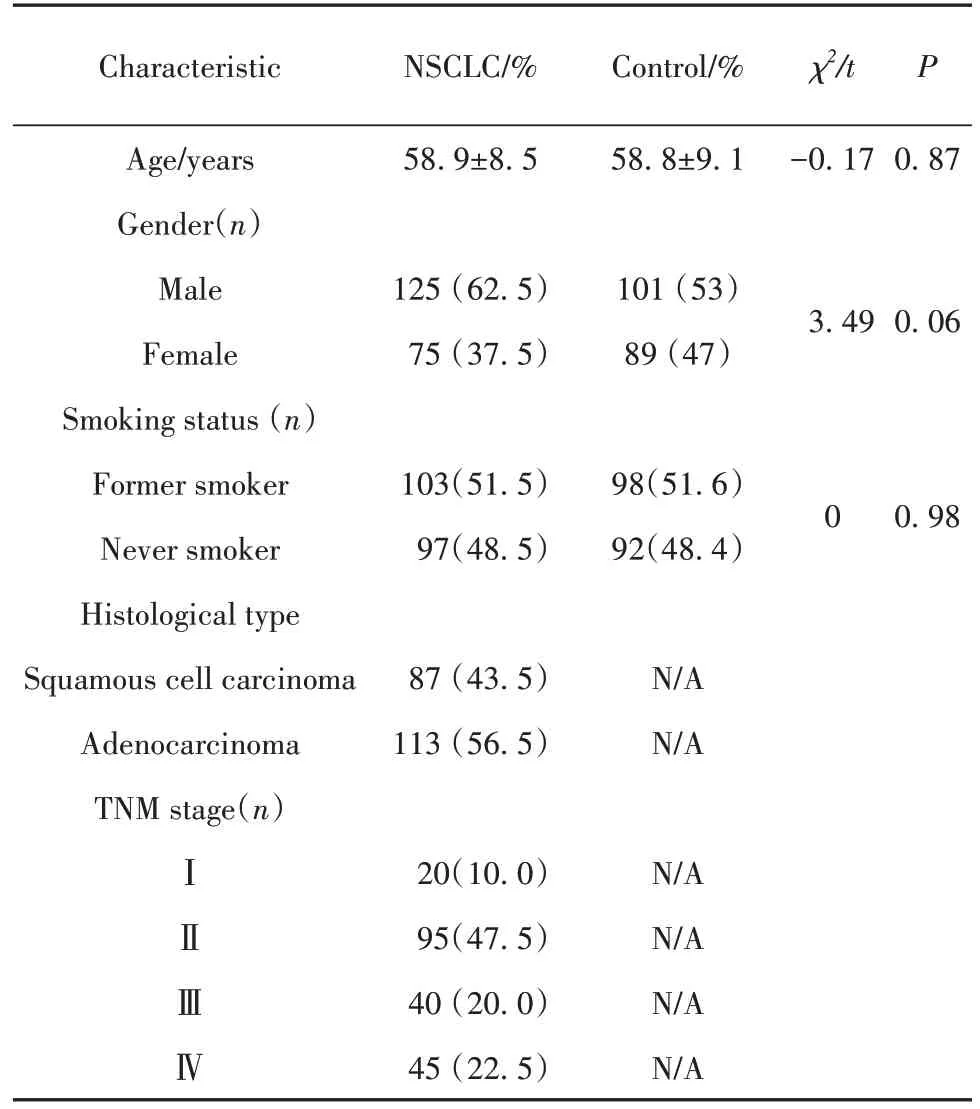
表2 NSCLC组及对照组的基线特征[,例(%)]Tab.2 Baseline characteristics of NSCLC patients and control subjects[,n(%)]
Characteristic NSCLC/%Control/%χ2/t P Age/years Gender(n)Male Female Smoking status(n)Former smoker Never smoker Histological type Squamous cell carcinoma Adenocarcinoma TNM stage(n)58.9±8.558.8±9.1-0.170.87 125(62.5)75(37.5)101(53)89(47)3.490.06 103(51.5)97(48.5)98(51.6)92(48.4)00.98 87(43.5)113(56.5)N/A N/AⅠⅡⅢⅣ20(10.0)95(47.5)40(20.0)45(22.5)N/A N/A N/A N/A
2.2 非小细胞肺癌患者血浆CD25、FOXP3 抗体的表达水平与对照组比较 NSCLC Ⅱ~Ⅳ期患者血浆CD25a、FOXP3 抗体的表达较对照组显著增加(P<0.001,P<0.05),Ⅰ期患者血浆CD25a、FOXP3 抗体的表达与对照组相比,差异无统计学意义(P>0.05)。NSCLC 患者血浆CD25b 抗体的表达较对照组显著降低,这一变化在早期即Ⅰ~Ⅱ期患者中尤为显著(P<0.001),晚期即Ⅳ期患者血浆CD25b 抗体的表达与对照组相比差异无统计学意义(P>0.05,表3)。
2.3 不同分期NSCLC 患者血浆CD25、FOXP3 抗体的表达水平 Ⅰ、Ⅱ、Ⅲ、Ⅳ期NSCLC 患者血浆CD25a、FOXP3 抗体的表达水平组间比较差异均无统计学意义(均P>0.05)。Ⅰ、Ⅱ期NSCLC 患者血浆CD25b 抗体的表达较Ⅳ期患者具有统计学差异(均P<0.05),Ⅰ、Ⅱ、Ⅲ期间CD25b抗体的表达水平无显著差异(均P>0.05,表3)。
表3 各组血浆CD25、FOXP3抗体的表达水平比较()Tab.3 Comparison of expression of CD25 and FOXP3 antibody in plasma of each groups()

表3 各组血浆CD25、FOXP3抗体的表达水平比较()Tab.3 Comparison of expression of CD25 and FOXP3 antibody in plasma of each groups()
Note:1)P<0.05 vs control group,2)P<0.001 vs control group,3)P<0.05 vs stage Ⅳ.
Anti-FOXP3 IgG 0.53±0.25 0.60±0.232)0.55±0.28 0.60±0.241)0.60±0.181)0.62±0.231)Groups n Control NSCLCⅠⅡⅢⅣ190 200 20 95 40 45 Anti-CD25a IgG 0.52±0.17 0.66±0.182)0.61±0.22 0.65±0.172)0.70±0.152)0.67±0.192)Anti-CD25b IgG 0.43±0.22 0.37±0.212)0.31±0.161)3)0.36±0.202)3)0.35±0.141)0.44±0.27
2.4 NSCLC 患者血浆 CD25、FOXP3 抗体的表达与临床病理特征的关系 CD25a 抗体在不同性别、组织学类型、有无淋巴结转移的NSCLC 患者血浆中的表达有统计学差异(P<0.05),而在不同年龄、有无吸烟史、不同肿瘤大小、TNM 分期NSCLC 患者中的表达无统计学差异(均P>0.05)。CD25b 抗体在不同性别、年龄、分化程度的NSCLC 患者血浆中的表达差异有统计学意义(P<0.05),在不同组织学类型、肿瘤大小、TNM 分期、有无淋巴结转移患者中的表达无统计学差异(均P>0.05)。而FOXP3 抗体的表达仅与肿瘤的分化程度有关(P<0.05,表4)。
表4 NSCLC患者血浆CD25抗体及FOXP3抗体的表达与临床病理特征的关系()Tab.4 Relationship between plasma levels of antibodies against CD25 and FOXP3 and clinicopathological characteristics of patients with NSCLC()

表4 NSCLC患者血浆CD25抗体及FOXP3抗体的表达与临床病理特征的关系()Tab.4 Relationship between plasma levels of antibodies against CD25 and FOXP3 and clinicopathological characteristics of patients with NSCLC()
Note:a.Squamous cell carcinoma;b.Adenocarcinma.
Characteristic Gender Male Female Age/year≥60<60 Smoking status Former smoker Never smoker Histological type SCCa ACb Differentiation grade Well/moderate Poor pT 1~2 3~4 Lymph node metastasis Absent Present TNM stageⅠ~ⅡⅢ~Ⅳn Anti-CD25a IgG t P Anti-CD25b IgG t P Anti-FOXP3 IgG t P 125 75 0.69±0.17 0.61±0.18 3.070.0020.40±0.23 0.32±0.16 2.600.010.62±0.24 0.56±0.21 1.860.07 102 98 0.67±0.17 0.65±0.18-1.130.260.34±0.17 0.40±0.24-2.190.030.62±0.23 0.58±0.23-1.180.24 103 97 0.62±0.16 0.64±0.18 1.350.310.35±0.17 0.40±0.23 0.520.170.63±0.18 0.66±0.12 1.740.12 87 113 0.69±0.17 0.63±0.18-2.450.020.40±0.21 0.35±0.21-1.850.070.62±0.21 0.58±0.25-1.160.25 100 100 0.65±0.18 0.67±0.17 1.120.260.40±0.23 0.34±0.19 2.100.040.56±0.21 0.63±0.25 2.090.03 196 4 0.66±0.18 0.60±0.12 0.710.480.37±0.21 0.33±0.18 0.430.670.60±0.23 0.68±0.21-0.660.51 102 96 0.63±0.17 0.68±0.18-2.140.040.35±0.20 0.40±0.22-1.540.130.60±0.25 0.60±0.21-0.060.95 20 180 0.61±0.22 0.67±0.17-1.250.210.31±0.16 0.39±0.21-1.410.160.55±0.28 0.61±0.23-1.000.32
2.5 CD25、FOXP3 抗体对 NSCLC 诊断效能的分析 绘制CD25、FOXP3 抗体对NSCLC 诊断的ROC曲线,CD25a 曲线下面积为 0.727(95%CI:0.677~0.778),最佳截断值为0.55,敏感度为77%,特异度为64%;CD25b 曲线下面积为0.601(95%CI:0.545~0.657),最佳截断值为0.35,敏感度为62%,特异度为 57%;FOXP3 曲 线 下 面 积 为 0.613(95%CI:0.557~0.669),最佳截断值为0.54,敏感度为58%,特异度为65%(图1)。

图1 血浆CD25、FOXP3抗体诊断NSCLC的ROC曲线图Fig.1 ROC curve of diagnostic value of CD25 and FOXP3 antibodies for NSCLC
3 讨论
Tregs 是一类具有免疫抑制功能的T 细胞亚群,在维持免疫耐受、调控免疫应答中起重要作用[18-19]。Tregs与肿瘤关系密切,它可抑制机体抗肿瘤免疫应答,促进肿瘤的免疫逃逸,在肿瘤的发生、发展及转归中发挥重要作用。CD25 分子可表达于激活态的T 细胞表面,亦可表达于Treg,其在两者的表达有明显区别,FOXP3 在 Treg 的表达具有高度特异性[20]。FOXP3 被认为是目前Tregs 高度特异性的分子标志,其表达与Treg 的成熟、分化及其免疫抑制功能密切相关[21]。本研究通过检测NSCLC 患者血浆CD25、FOXP3 抗体表达变化,以明确其在 NSCLC 发生发展中的作用及其作为诊断标志物的潜能。
本研究发现NSCLC 患者血浆CD25a 和FOXP3抗体的水平显著高于健康对照,且随肺癌的进展逐渐增加,由此可推测Treg 数量可能与NSCLC 分期呈正相关。随着肺癌的进展,Treg 数量逐渐增多,CD25a 和FOXP3 分子释放增加,激活机体体液免疫应答,导致CD25a 和FOXP3 抗体增多。本课题组用流式细胞仪检测各期NSCLC 患者外周血中Tregs 数目,也证实了这一推测。Ⅳ期NSCLC 患者外周血中Tregs 细胞数量高于Ⅲ期患者,Ⅲ期患者外周血中Tregs细胞数量高于Ⅱ期患者,且差异均有统计学意义(P<0.05)。对 CD25a 抗体诊断 NSCLC 效能的ROC 曲线分析发现CD25a 曲线下面积为0.727(95%CI:0.677~0.778),最佳截断值为 0.55,敏感度为77%,特异度为64%,提示CD25a 抗体对NSCLC 具有一定的诊断价值。进一步分析发现CD25a 抗体的表达与淋巴结转移密切相关,提示血浆CD25a 抗体的表达可能与NSCLC 预后有关,这一初步结论仍需大规模回顾性研究进一步验证。
本研究根据CD25 分子中不同抗原表位设计了2 个线性抗原肽即CD25a 和CD25b,通过检测其抗体表达水平发现CD25a 和CD25b 抗体在NSCLC 患者中呈现出完全相反的表达趋势。相较于健康对照,CD25a 抗体在NSCLC 患者表达增加,而CD25b抗体在NSCLC 患者表达显著降低,这一变化在Ⅰ~Ⅲ期NSCLC 患者中尤为显著,且Ⅰ~Ⅱ期NSCLC 患者CD25b 抗体表达降低较Ⅳ期患者有统计学差异。这源于不同抗原表位的免疫原性不同,与相应B 细胞受体结合后激活免疫应答的能力不同[22]。同时也说明CD25b 天然抗体可能参与维持机体免疫稳态,其含量减少可削弱机体的免疫监视功能,促进NSCLC 的发生。本研究结果与之前报道的CD25b抗体在NSCLC 患者血浆中的表达存在相反趋势[23-24]。推测可能与以下因素有关:①由于肿瘤的异质性,同种肿瘤抗体的表达水平可能存在差异;②样本量及来源不同、偏倚采样、检测方法的不同也可能是导致结论不一的原因。
此外,血清肿瘤标志物对NSCLC 的发生也有一定预测价值,目前临床常用的NSCLC 肿瘤标志物有癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原 19-9(carbohydrate antigen 19-9,CA19-9)、神经元特异性烯醇化酶(neuron-specific enolase,NSE)等。由于单个标志物对NSCLC 的诊断价值有限,下一步将与上述敏感肿瘤标志物联合,以提高NSCLC 诊断的敏感度及特异度。
综上所述,CD25a、CD25b、FOXP3抗体在NSCLC中的表达变化提示其可能参与NSCLC 的发病机制,其中CD25a 抗体可能对诊断肺癌有帮助,CD25b 抗体在早期NSCLC(Ⅰ~Ⅱ期)中表达降低,可能对肺癌发生有一定预测价值,但对NSCLC 诊断效能有限,后续研究将扩大样本量进一步验证其对NSCLC的诊断价值,并联合其他NSCLC 敏感性标志物提高早期NSCLC诊断的灵敏度及特异度。

