TRIM19通过调控p53信号促进卵巢癌进展的作用及机制研究①
王 琪 廖振蓉 罗德平 余 瑛 李 荣 (赣南医学院附属肿瘤医院,赣州 341000)
卵巢癌是发达国家妇女癌症病死的第五大原因,也是最致命的妇科恶性肿瘤[1-2]。由于卵巢癌早期无明显症状、起病较隐匿,绝大多数患者初诊时已经发生肿瘤的腹腔转移和扩散,两年内复发率达80%,五年生存率从45%下降到25%[3-5]。由于卵巢癌无症状特征,通常在晚期才被诊断出来。尽管其治疗策略取得了重大进展,但仍是一种致命疾病,因此需要进一步研究以了解其发病机制和病理生理。TRIM(tripatite motif-containing protein)又称为三基序蛋白,拥有环指结构域(RING-finger)、B-box结构域、卷曲螺旋coil-coiled)3 个特征性结构域,是一类发挥E3 泛素连接酶作用的蛋白家族[6]。研究发现,在不同肿瘤中,不同的TRIM 成员呈现差异性表达,可能通过与p53信号通路的相互作用,影响肿瘤因子表达,作为癌基因或抑癌基因调控肿瘤细胞的增殖、分化、凋亡、迁移、侵袭等多种生物学过程,与肿瘤的发生发展密切相关[7]。
本研究检测卵巢癌细胞中TRIM19 基因的表达,通过RNAi 技术降低TRIM19 的表达并观察其对卵巢癌细胞增殖、凋亡、侵袭的影响,同时初步探索TRIM19 基因是否通过p53 信号通路调控卵巢癌进程及分子机制。
1 材料与方法
1.1 材料 卵巢癌细胞株SKOV-3、A2780、OVCAR3,人正常卵巢上皮细胞株 IOSE80(ATCC);DMEM 培养基、胎牛血清(FBS)、青链霉素(Sigma 公司);TRIM19-siRNA、TRIM19、GAPDH 引物(安徽通用生物科技有限公司);Lipofectamine2000(Invitrogen);RNA 提取试剂盒、反转录试剂盒、荧光定量检测试剂盒、CCK-8、DMSO、细胞凋亡检测试剂盒(碧云天生物技术有限公司);TRIM19 抗体及GAPDH 抗体、HRP标记的IgG抗体(CST公司)。
1.2 方法
1.2.1 靶向TRIM19 基因的siRNA 合成及细胞转染 委托安徽通用生物科技有限公司以化学法合成靶向敲减TRIM19 基因的siRNA,靶点序列为:5'-TGGATAACGTCTTTTTCGAGAGT-3'。以1×106个/孔将SKOV-3细胞接种于6孔培养板,无双抗培养基培养,4 h 后当细胞融合到70%~80%时进行细胞转染。按照 TRIM19-siRNA 2 μg/Lipo 8 μl、TRIM19-siRNA 4 μg/Lipo 8 μl 的浓度分别配制无血清培养液各100 μl,6 h后更换含10%FBS的DMEM培养基,24 h、48 h、72 h 后收集细胞备用。设转染组(siTRIM19)、阴性对照组(NC),每组设3个复孔,所有试验均重复3次。
1.2.2 荧光定量PCR(qPCR)检测TRIM19 基因及信号分子表达 胰酶消化收集细胞,Trizol 裂解细胞,根据RNA 提取试剂盒说明书提取细胞中总RNA,置入RNA free 水内溶解备用。严格按照反转录试剂盒使用说明制备cDNA。以cDNA 为模板,GAPDH 为内参,SYBR Green 染料法检测 TRIM19 及p53 信号分子表达。PCR 反应程序:95℃ 2 min,(95℃ 15 s、60℃ 15 s)40 个循环。每组设3 个复孔,所有试验均重复3次。
1.2.3 Western blot 检测 胰酶消化收集细胞,蛋白裂解液裂解细胞,4℃、14 000 r/min 离心10 min,提取细胞总蛋白。BCA 法测定蛋白浓度。配制SDS-PAGE 电泳胶,上样、电泳、转膜,5%脱脂奶粉封闭,PBS 洗涤。一抗4℃过夜,PBS 洗涤。二抗室温下孵育2 h,PBS 洗涤,ECL 试剂化学发光,显影、定影。扫描胶片,凝胶图像处理系统分析目标蛋白的灰度值。每组设3个复孔,所有试验均重复3次。
1.2.4 CCK-8 法检测细胞增殖能力 胰酶消化细胞,分别以 5 000 个/孔接种于 96 孔板,37℃、5%CO2培养24 h、48 h、72 h、96 h、120 h 后加入10%体积的CCK-8试剂,继续培养1~3 h后以酶标仪检测450 nm处的吸光度值。每组设3 个复孔,所有试验均重复3次。
1.2.5 流式细胞术检测细胞凋亡 用不含EDTA的胰酶消化细胞,以1 200 r/min 离心5 min,预冷的PBS 洗涤、离心,再以预冷PBS 重悬制成细胞混悬液。按照细胞凋亡检测试剂盒使用说明用Annexin V染色法检测细胞凋亡率。每组设3 个复孔,所有试验均重复3次。
1.2.6 Transwell 实验检测细胞侵袭能力 将滤膜孔径为 8 μm 的 Transwell 小室置于 24 孔板。胰酶消化并收集培养的细胞,以1×104个/孔接种于Transwell小室上室,下室加入 600 μl 含 20%FBS 的 DMEM 培养基。培养48 h 后取出小室,结晶紫染色,棉签轻轻拭去小室滤膜上层的细胞。显微镜下观察拍照,每个样本随机选取10 个视野拍照并计数。每组设3个复孔,所有试验均重复3次。
1.3 统计学分析 采用SPSS22.0软件对数据进行分析,两组间比较采用t检验,多组间差异比较采用单因素方差分析,计数资料采用χ2检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 TRIM19 在卵巢癌细胞中高表达 qPCR 结果表明,以人卵巢表皮细胞IOSE80 为对照,卵巢癌细胞 SKOV-3、A2780、OVCAR3 中 TRIM19 mRNA 表达量均显著上调,差异具有统计学意义(P<0.05)。如图 1,SKOV-3 细胞中 TRIM19 比 IOSE80 细胞中上调5.05 倍,A2780 细胞中上调 1.75 倍,OVCAR3 细胞中上调1.84倍。
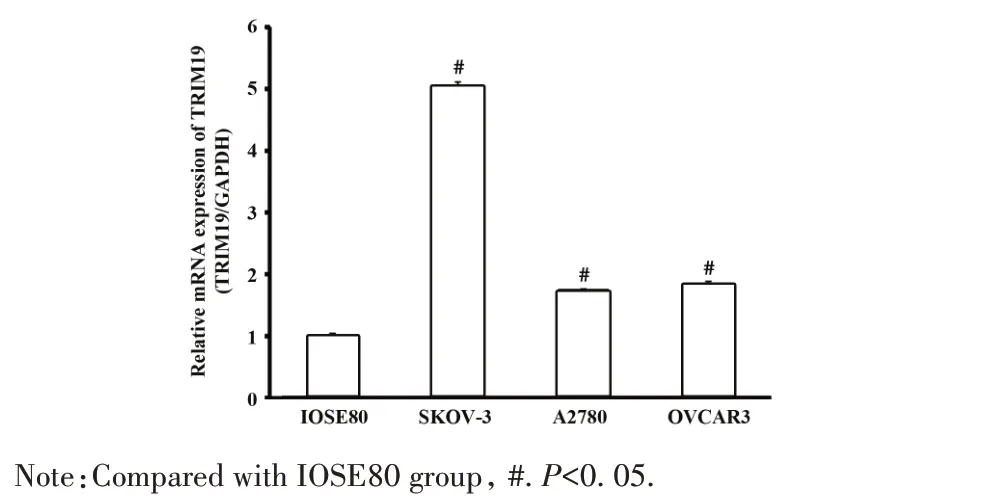
图1 qPCR检测TRIM19基因在卵巢癌细胞中的表达Fig.1 Expression of TRIM19 gene in ovarian cancer cells was detected by qPCR
2.2 TRIM19 被成功敲减 转染靶向TRIM19 基因的siRNA(siTRIM19)并培养48 h 后,转染组TRIM19基因的mRNA 表达量较对照组(NC)降低约69.3%(图2A),TRIM19 蛋白表达量较对照组(NC)降低约51.8%(图2B),差异具有统计学意义(P<0.05)。因此,卵巢癌细胞SKOV-3中TRIM19基因被成功敲减。
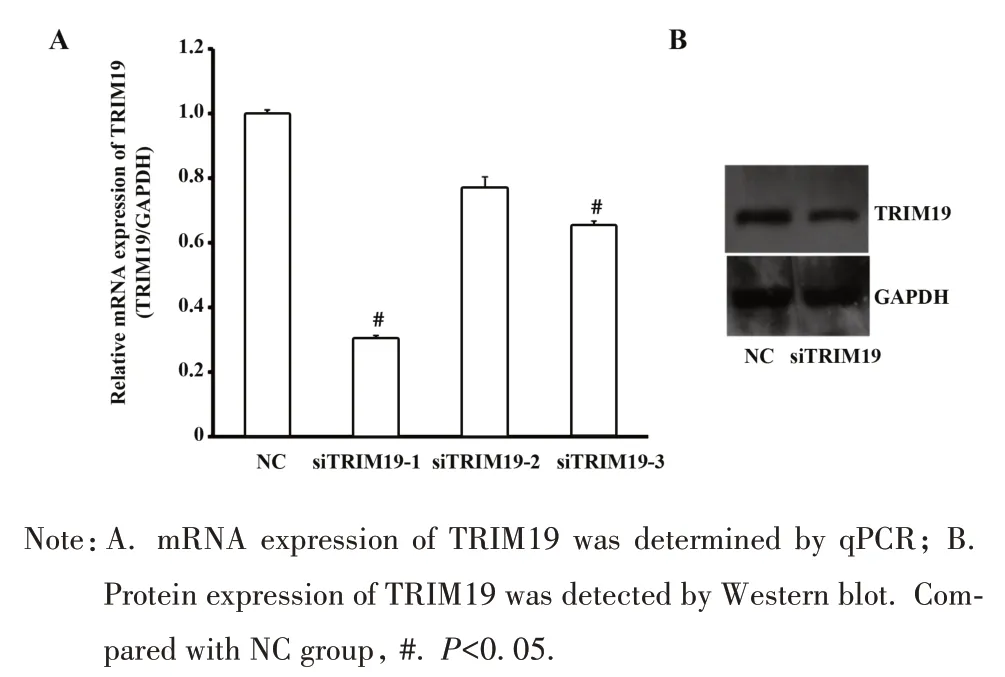
图2 SKOV-3细胞中的TRIM19基因被成功敲减Fig.2 TRIM19 gene was knocked down successfully in SKOV-3 cells
2.3 TRIM19 调控卵巢癌细胞增殖 敲减TRIM19基因后,细胞增殖能力明显减弱,在第5 天时,转染组细胞增殖率是对照组的25.8%(图3A)。同时,细胞克隆形成能力明显减弱。在第14天时,经结晶紫染色后计数细胞发现转染组中细胞克隆数只有约52 个,而对照组中克隆数量接近368 个(图3B、C)。提示TRIM19 基因对卵巢癌细胞的生长及增殖有重要贡献。
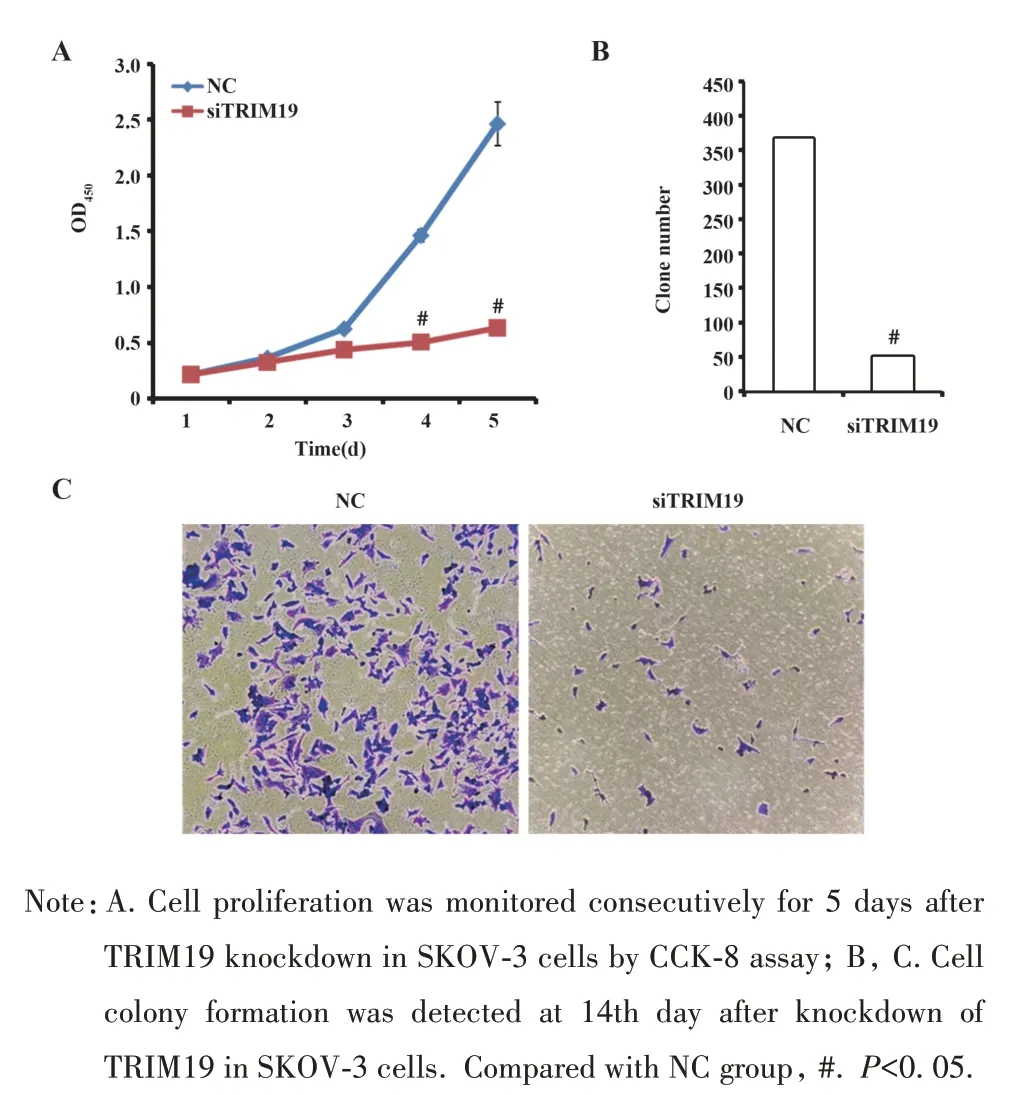
图3 敲减TRIM19基因抑制SKOV-3细胞增殖与生长Fig.3 Knockdown of TRIM19 gene inhibited proliferation and growth in SKOV-3 cells
2.4 TRIM19 调控卵巢癌细胞侵袭 转染组中可穿透小室上层阻隔膜的SKOV-3 细胞数量较对照组明显增加。经统计,敲减TRIM19后,细胞穿透能力约降低70%,差异具有统计学意义(P<0.05)。见图4。提示敲减TRIM19 基因可明显抑制卵巢癌细胞SKOV-3的侵袭行为。

图4 敲减TRIM19抑制SKOV-3细胞侵袭Fig.4 Knockdown of TRIM19 suppressed cell invasion in SKOV-3 cells
2.5 TRIM19 调控卵巢癌细胞凋亡 敲减TRIM19基因并培养48 h 后,转染组中细胞凋亡率为12.5%,对照组中细胞凋亡率为0.45%,转染组凋亡率是对照组的30倍,差异具有统计学意义(P<0.05,图5)。提示敲减TRIM19 基因明显促进卵巢癌细胞SKOV-3凋亡。

图5 敲减TRIM19诱导SKOV-3细胞凋亡Fig.5 Knockdown of TRIM19 induced cell apoptosis in SKOV-3 cells
2.6 TRIM19 调控 p53 信号通路 敲减 TRIM19 基因后,SKOV-3 细胞凋亡率明显上调,提示TRIM19协助SKOV-3 细胞抵抗凋亡。为探明TRIM19 基因是如何抗凋亡的,以qPCR 技术检测多个凋亡相关信号分子表达。如图6,敲减TRIM19 基因后,细胞中p53、p21、CyclinD、CDK2、Bax 基因表达量分别提高 2.83、3.7、2.79、4.94、6.1 倍。 当 同 时 下调SKOV-3 细胞中的 TRIM19 基因与 p53 基因后,细胞中p53、p21、CyclinD、CDK2、Bax 表达量比对照组略有提高,但差异无统计学意义。因此,在卵巢癌中,TRIM19调控p53信号通路,抵抗凋亡行为。
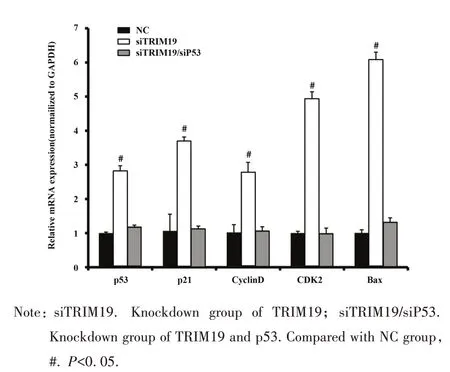
图6 qPCR检测p53相关信号分子表达Fig.6 Expressions of p53-related molecules detected by qPCR
3 讨论
卵巢癌是严重威胁全球女性健康及生命安全的致命因素。抽样调研表明在我国每年死于卵巢癌的女性接近2.3 万例,且每年新增约5.6 万例卵巢癌病患[8]。然而当前治疗卵巢癌的主要策略是手术结合放化疗,对晚期患者疗效甚微。二代基因组测序发现大部分癌症患者遗传基因发生变异,而这些变异正是诱导正常细胞癌变的关键因素。更不幸的是,包括卵巢癌的绝大部分癌症均具有异质性特征,每个亚群甚至每个患者的关键致病基因均可能不同。例如,MDC1 可促进卵巢癌细胞增殖和迁移[9];过表达PinX1 基因抑制卵巢癌细胞增殖和侵袭能力[10]。大量研究揭示癌症的遗传异质性是导致临床上不同个体对同一个治疗方案或药物产生差异反应的关键因素,发掘关键致病基因是当前精准医疗、细胞免疫治疗面临的最大挑战。
TRIM19,又 称 PML(promyelocytic leukemia protein),属于TRIM(protein of triple motif)家族,主要在细胞核中表达,在细胞核中形成被称为PML 核体的动态结构,是一种早幼粒细胞白血病蛋白[11]。TRIM19 最早被发现能够干扰许多病毒,包括人类免疫缺陷病毒、人泡沫病毒、脊髓灰质炎病毒、流感病毒、狂犬病毒、脑心肌炎病毒、腺相关病毒和水泡性口炎病毒的复制[12-17]。在部分肿瘤的发生发展过程中,作为抑癌基因,TRIM19 负向调控肿瘤的DNA损伤修复、增殖、分化、凋亡、侵袭等过程[18]。在前列腺腺癌、结肠腺癌、乳腺癌、肺癌、淋巴瘤、中枢神经系统和生殖细胞肿瘤中,TRIM19 蛋白表达完全或部分丧失,并与肿瘤的分级及分期密切相关[19]。在乳腺癌中,PML 表达随病变进展而下调,且与肿瘤大小、淋巴结转移状态及pTNM 分期显著相关;生存曲线分析显示,PML 蛋白表达水平是影响乳腺癌预后的独立因素,其表达水平越高,患者无病生存期越长[20]。在乳腺癌和造血干细胞中,细胞水平过表达PML 能够抑制肿瘤细胞增殖,诱导细胞周期阻滞、老化及细胞凋亡[21-22]。然而,每个基因在不同的肿瘤中可能发挥不同作用。在卵巢癌细胞中,沉默PML表达抑制肿瘤细胞的增殖及诱导DNA损伤[23]。
本研究发现TRIM19 在卵巢癌细胞SKOV-3、A2780、OVCAR3 中表达较人卵巢表皮细胞IOSE80表达量明显增高。敲减TRIM19 后,SKOV-3 细胞增殖能力降低,侵袭能力明显减弱。相反,敲减TRIM19 明显促进卵巢癌细胞SKOV-3 凋亡。本研究进一步证实TRIM19 基因在卵巢癌生长及转移中发挥致癌作用,同时本研究初步阐释了TRIM19 基因诱发卵巢癌的分子机制。
p53 是一种重要的肿瘤抑制因子,作为一种转录因子,选择性地转录其靶基因,调控多种细胞应激反应,发挥其抑制肿瘤的功能。TRIM 与p53 在抗肿瘤作用中相互调控,许多TRIM 是p53的负或正调控因子,同时许多 TRIM 被 p53 调控,介导 p53 在细胞应激反应和肿瘤抑制中的功能。很多带有Ring结构域的TRIM 可以与p53 结合,如TRIM24、TRIM39、 TRIM32、 TRIM59、 TRIM31、 TRIM71、TRIM69 和TRIM23,导致p53 泛素化和降解。另外,部分编码TRIM 的基因是p53 的直接靶基因,p53 能够 转 录 调 节 TRIM3、TRIM8、TRIM19、TRIM22、TRIM24、TRIM32、TRIM67和TRIML2[7]。本研究中,敲 减 TRIM19 基因 后,qPCR 检测 发现 p53、p21、CyclinD、CDK2、Bax 表达增加,提示敲减 TRIM19 可能激活p53 依赖的凋亡信号通路,促进肿瘤细胞的凋亡。然而,TRIM19 与p53 信号是如何联系的,二者之间的介导分子是什么?TRIM19 对卵巢癌细胞体内生长的作用是什么?这些问题需要更深入的研究,也是课题组后期的研究计划。
本研究证实,TRIM19基因在卵巢癌细胞SKOV-3、A2780、OVCAR3 中高表达。敲减 TRIM19 可明显抑制卵巢癌细胞SKOV-3 增殖、侵袭能力并促进凋亡。机制研究表明TRIM19 可调控p53 依赖的凋亡信号通路。因此,TRIM19 具有成为卵巢癌治疗的新靶点潜力,课题组将继续研究TRIM19 对卵巢癌的发病及转移的作用及深层分子机制。

