解淀粉芽孢杆菌缓解非酒精性脂肪肝病的作用机制
张红娜,王静,刘敬博,周玉法
1.河北经贸大学生物科学与工程学院,石家庄 050061; 2.华中农业大学生命科学技术学院,武汉 430070;3.山东农业大学动物科技学院,泰安 271000; 4.山西农业大学动物医学院,太原030031
非酒精性脂肪肝( non-alcoholic fatty liver disease,NAFLD)是指除酒精和其他明确因素导致肝细胞内脂肪过度沉积的病症,是目前全球最常见慢性肝病,患病率高达15%~40%[1-2]。有研究表明,肠道菌群可通过“肠道-肠道微生物-肝脏轴”在NAFLD等代谢疾病中发挥调节作用[2-3],而且临床中也发现NAFLD患者会出现肠道菌群失调,肠道微生物代谢功能紊乱,致病菌数量明显增多[4]。利用乳酸菌、双歧杆菌、芽孢杆菌等增加肠道有益菌,会明显改善NAFLD引起的肝脏脂质变性和肝脏炎症[5-6],这说明益生菌调控肠道微生物和肝脂代谢已成为预防和治疗NAFLD的一种新方法。
芽孢杆菌常用于动物饲料、人类膳食的益生菌补充剂[7]。在一定条件下,芽孢杆菌能够形成内生孢子,抵抗胃部强酸性环境和小肠胆盐,到达肠道发挥其益生作用[8]。临床中NAFLD患者口服枯草芽孢杆菌[9]或凝结芽孢杆菌[10]后可起到抑制炎症、改善肠道微生态系统、调节脂质代谢,以及护肝作用。但是关于芽孢杆菌缓解NAFLD的作用机制尚未被揭示。
我们先前的研究发现,解淀粉芽孢杆菌BLCC1-0238能够改善动物肠道微生物菌群,减少机体发生过敏性炎症,下调与脂肪酸合成相关的关键酶基因表达[11]。因此,我们推测解淀粉芽孢杆菌BLCC1-0238作为候选益生菌,可能会通过调节脂质代谢和肠道微生物菌群对NAFLD起到缓解作用。本研究通过建立高脂饮食诱导的NAFLD小鼠模型,采用肠道基因组学和肝脏转录组学技术探讨解淀粉芽孢杆菌BLCC1-0238缓解NAFLD的作用机制,以期为临床应用提供理论依据。
1 材料与方法
1.1 实验动物、材料与试剂
解淀粉芽孢杆菌BLCC1-0238由山东宝来利来生物有限公司提供。48只C57BL/6雄性小鼠(5周龄,体质量18~20 g)购于济南朋悦实验动物繁育有限公司,许可证号SCXK(鲁)20190003。2种实验饲料,购自北京科澳协力饲料有限公司。
天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-c)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-c)试剂盒,购自南京建成生物工程研究所。苏木精和伊红染色液,购自碧云天生物技术公司。细胞油红O染色液,购自索莱宝生物科技有限公司。QlAamp DNA Stool Mini试剂盒、RNeasy Mini试剂盒,购自Qiagen公司。TRIzol A+试剂盒、SYBR Green 试剂盒,购自天根生化科技有限公司。
1.2 解淀粉芽孢杆菌BLCC1-0238的培养
解淀粉芽孢杆菌BLCC1-0238接种到LB液体培养基,37 ℃摇床(150 r/min)培养8~12 h至对数生长期。培养液5 000 r/min离心10 min,弃上清,无菌PBS洗涤3次后用紫外-可见分光光度计于600 nm处测定吸光度。根据解淀粉芽孢杆菌BLCC1-0238的标准生长曲线测定其浓度,然后分别调整至106CFU/100 μL和108CFU/100 μL用于后续试验。
1.3 试验设计和样品采集
试验小鼠经7 d适应性饲喂后随机分为4组,每组3个重复,每个重复4只。对照组(CON):正常饲料+饮用纯净水;NAFLD模型组:高脂饲料+饮用纯净水;低剂量干预组(BA-L):模型组+每天每只小鼠灌胃106CFU 解淀粉芽孢杆菌BLCC1-0238;高剂量干预组(BA-H):模型组+每天每只小鼠灌胃108CFU 解淀粉芽孢杆菌BLCC1-0238。试验持续16周,每天称小鼠体质量。饲养试验结束后禁食12 h (可自由饮水),麻醉处死小鼠,采集血液、肝脏组织和盲肠内容物。
1.4 血清指标与肝组织病理学检测
每组随机选择6只小鼠(每个重复2只)进行血清和肝组织采样。根据检测试剂盒说明书测定血清中AST、ALT、TG、TC、LDL-c和HDL-c水平。部分肝脏组织用10%多聚甲醛固定后,经石蜡包埋和切片(5 μm),进行苏木精和伊红(H&E)染色;另外,对部分肝脏组织经OCT包埋和冷冻器8 μm切片,进行油红O脂肪染色。染色后镜检分析。
1.5 肠道内容物基因组学分析
从NAFLD模型组和BA-H组分别随机选择6只小鼠(每个重复选择2只),采集盲肠内容物。使用QlAamp DNA Stool Mini试剂盒提取小鼠盲肠内容物的总DNA。PCR扩增16S rRNA的V3-V4高变区,引物和扩增条件参照文献[11]。PCR产物在Illumina HiSeq平台测序,通过UPARSE 7.1对序列进行操作分类单元(operational taxonomic unit,OTU)聚类分析,用RDP注释,并进行α多样性指数分析。
1.6 肝脏组织转录组学分析
从NAFLD模型组和BA-H组分别随机选择3只小鼠(每个重复选择1只),采集肝组织。使用RNeasy Mini试剂盒提取肝脏组织RNA,并用Agilent Bioanalyzer 2100进行质量检测。构建RNA文库,使用Illumina HiSeq平台进行双末端测序。将原始数据进行质控和整理后映射到参考基因组Ensembl GRCm38.91。用StringTie和Ballgown软件计算每个基因的表达量,以Fold change >2和P<0.05为标准筛选差异表达基因,最后对差异基因进行GO富集分析和基因集富集分析(gene-set enrichment analysis,GSEA)。
1.7 定量逆转录PCR
采用TRIzol法提取肝组织中RNA,使用SYBR Green 试剂盒在Applied Biosystems 7500 Fast Real-time PCR系统上进行qRT-PCR,检测肝组织中相关基因mRNA表达水平(引物见表1)。每个样品重复3次,以18S rRNA为内参,使用2-ΔΔCt方法评估相对表达水平。
1.8 统计分析
应用SPSS进行统计分析。采用非配对双尾t检验进行差异显著性分析;采用Kruskal-Wallis检验对肠道微生物菌群相对丰度进行LEfSe分析。P<0.05表示具有统计学意义。

表1 基因和引物列表 Table 1 Genes and primers used in this study
2 结果与分析
2.1 解淀粉芽孢杆菌BLCC1-0238对NAFLD小鼠体质量的影响
从图1可以看出,高脂饮食导致3组小鼠的体质量增加幅度均高于对照组,且NAFLD组的体质量增加显著高于对照组(P<0.01);但是,经BA-L和BA-H干预后的2组小鼠体质量显著低于NAFLD组(P<0.01)。此结果说明解淀粉芽孢杆菌BLCC1-0238减缓了NAFLD小鼠体质量的增加。

CON:对照组;NAFLD:高脂诱导的NAFLD模型组;BA-L:低剂量解淀粉芽孢杆菌BLCC1-0238干预组;BA-H:高剂量解淀粉芽孢杆菌BLCC1-0238干预组。#代表NAFLD组与对照组比较;*代表干预组与NAFLD组比较;#/* P<0.05,##/** P<0.01,###/*** P<0.001。下同。CON:Control group; NAFLD:NAFLD group induced by a high-fat diet; BA-L:Intervention group of low-dose B. amyloliquefaciens BLCC1-0238; BA-H:Intervention group of high-dose B. amyloliquefaciens BLCC1-0238. # represents comparison between NAFLD group and control group;*represents comparison between intervene groups and NAFLD group; #/*P<0.05,##/** P<0.01,###/*** P<0.001. The same as below.
2.2 解淀粉芽孢杆菌BLCC1-0238对NAFLD小鼠肝细胞脂肪变性的影响
经组织病理学分析(图2)发现,NAFLD组出现肝脏实质细胞脂肪变性和脂肪蓄积的特征,而BA-L和BA-H干预组可以减轻这些症状。油红O染色和HE染色结果显示,与对照组相比,NAFLD组小鼠肝细胞中脂肪含量显著增加;与NAFLD组相比,BA-L组和BA-H组中肝脏细胞脂肪含量显著降低,且呈现剂量依赖趋势。此结果说明解淀粉芽孢杆菌BLCC1-0238减轻了NAFLD小鼠的肝细胞脂肪变性和脂质沉积。
2.3 解淀粉芽孢杆菌BLCC1-0238对NAFLD小鼠血脂水平和肝脏损伤的影响
通过血清指标检测,发现解淀粉芽孢杆菌BLCC1-0238可有效降低血脂水平(图3A-D),缓解肝脏炎症(图3E和F)。与对照组相比,NAFLD组小鼠血清中TC、TG、LDL-c的水平显著增加(P<0.05);与NAFLD组相比,BA-L和BA-H的干预能显著降低血清TC、TG、LDL-c水平(P<0.05)。另外,与对照组相比,NAFLD组小鼠血清中ALT和AST水平显著上升(P<0.01);而BA-L和BA-H干预组显著降低了血清ALT和AST水平(P<0.05)。此结果说明解淀粉芽孢杆菌BLCC1-0238降低了NAFLD小鼠的血脂水平和肝脏损伤。

图2 小鼠肝脏组织病理切片(200×)Fig.2 The histopathological sections of the mouse liver(200×)

图3 解淀粉芽孢杆菌BLCC1-0238处理下NAFLD小鼠血清中脂质含量(A~D)、ALT(E)和AST(F)水平的变化Fig.3 Serum level changes of lipid(A-D),ALT(E) and AST(F) in NAFLD mice under B. amyloliquefaciens BLCC1-0238 treatment
2.4 解淀粉芽孢杆菌BLCC1-0238对NAFLD小鼠肠道菌群多样性的影响
基于16S rRNA基因测序,评估解淀粉芽孢杆菌BLCC1-0238对NAFLD小鼠肠道微生物菌群多样性的影响。稀释曲线结果(图4A)显示,每个样本都有足够的测序深度,说明样本多样性的分析指标达到稳定。在OUT水平(图4B和C),BA-H组的Shannon指数(P<0.05)和Ace指数(P<0.001)显著低于NAFLD组,说明解淀粉芽孢杆菌BLCC1-0238干预降低了肠道微生物菌群多样性。
2.5 解淀粉芽孢杆菌BLCC1-0238对NAFLD小鼠肠道菌群结构的影响
由图5可知,解淀粉芽孢杆菌BLCC1-0238改变了肠道微生物菌群结构且增加了有益菌相对丰度。经PCoA分析(图5A),BA-H组与NAFLD组之间在分布上明显分离,说明解淀粉芽孢杆菌BLCC1-0238干预改变了NAFLD小鼠的肠道微生物菌群结构。在门水平(图5B),与NAFLD组相比,BA-H组增加了放线菌门(Actinobacte)和变形杆菌门(Proteobacteria)相对丰度,减少了厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)相对丰度。在属水平(图5C和5D),相较于NAFLD组,BA-H组显著增加了产短链脂肪酸的双歧杆菌(Bifidobacterium)相对丰度,且差异极显著(P<0.001)。
LEfSe分析显示(图6),在属水平上NAFLD组的毛螺杆菌属(Lachnospiraceae_NK4A136_group)和拟杆菌属(Bacteroides)相对丰度较高。相比之下,BA-H干预组主要增加了双歧杆菌属、Curvibacter菌属、亚硝化单胞菌属(Nitrosomonas)、Faecalibaculum属、Faecalibacterium属的相对丰度,与上述分析结果一致。

A:稀释曲线 Rarefaction curve; B:Shannon指数 Shannon index; C:Ace指数 Ace index.图4 解淀粉芽孢杆菌BLCC1-0238处理下NAFLD小鼠肠道菌群多样性变化Fig.4 Diversity changes of gut microbiota in NAFLD mice under B. amyloliquefaciens BLCC1-0238 treatment

A.PCoA分析 PCoA analysis; B.门水平 Phylum level; C. 属水平 Genus level; D. 双歧杆菌相对丰度 Relative abundance of Bifidobacterium.
2.6 解淀粉芽孢杆菌BLCC1-0238对NAFLD小鼠肝脏组织转录组的影响
应用转录组学分析小鼠肝脏基因表达谱发现,NAFLD组与BA-H组之间明显分离(图7A),表明两组的小鼠肝脏基因表达谱相似性非常低。NAFLD组与BA-H组之间共有730个差异表达基因(图7B),BA-H组显著上调337个基因,显著下调393个基因。
2.7 肝脏组织差异表达基因的功能富集分析
将差异表达基因进行GO功能富集,分析解淀粉芽孢杆菌BLCC1-0238缓解NAFLD的潜在作用通路。结果(图8)发现,BA-H组下调基因主要富集在氧化还原过程、脂质代谢过程、凋亡过程、胆固醇代谢过程、甘油三酯代谢过程、糖皮质激素反应、细胞对胰岛素刺激的反应、甾醇生物合成、类固醇生物合成、脂肪细胞分化、脂质存储、白色脂肪细胞分化、脂肪酸生物合成正调控等生物学过程。BA-H组上调基因主要富集在磷酸化作用、免疫反应、细胞增殖调节、MAPK级联调控、异型生物质的代谢、镉离子响应、toll样受体信号通路正调控、内皮细胞凋亡过程负调控、粘多糖代谢、γ-干扰素生物合成等生物学过程。从GO分析结果可以看出,解淀粉芽孢杆菌BLCC1-0238主要抑制了脂肪酸合成、胆固醇合成等脂质代谢生物过程,从而来缓解高脂饮食导致的体质量增加和肝细胞脂肪变性和脂质沉积。
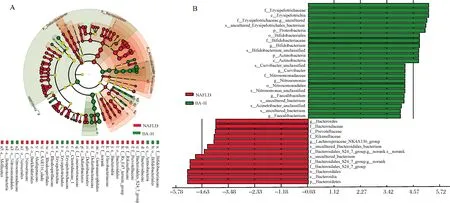
A:进化分支图; B:LDA分布柱状图(LDA分数绝对值大于4,LDA分数越高说明丰度差异越大)。A:Cladogram. B:Histogram of LDA discrimination (The absolute value of LDA score was more than 4. The higher the LDA score,the greater the difference in abundance).

图7 肝脏组织转录组的PCoA分析(A)和差异基因火山图(B)Fig.7 PCoA analysis of hepatic transcriptome (A) and volcano plot of differantially expressed genes (B)
结合GO富集结果和基因表型相关性,进一步对差异基因进行GSEA,结果(图9)发现,BA-H组的大多数差异基因参与脂肪代谢过程的负调控,包括碳水化合物代谢、脂肪酸β-氧化、脂质分解、脂滴、类固醇代谢和甾醇生物合成过程,这与GO富集结果一致。
2.8 qRT-PCR对肝脏脂质代谢相关基因表达的验证
qRT-PCR结果(图10)显示,与NAFLD相比,BA-H组显著下调了羟辅酶A脱氢酶a(Hadha),中链酰基辅酶A脱氢酶(Acadm)、磷脂酶A2-IVA(Pla2g4a)等与脂肪酸合成和沉积有关基因的mRNA表达;显著下调了肉毒碱棕榈酰基转移酶1a(Cpt1a)、ATP-结合盒D亚组膜1(Abcd1)等与脂肪酸运输相关基因的mRNA表达;显著下调了中性胆固醇酯水解酶1(Nceh1)、溶酶体酸性脂肪酶A(Lipa)、二酰基甘油脂肪酶(Dagla)等参与调控胆固醇合成和甘油三酯合成的mRNA表达。qRT-PCR结果说明解淀粉芽孢杆菌BLCC1-0238缓解NAFLD作用确实与调控脂肪酸、胆固醇、甘油三酯等脂质合成有关,验证了转录组学分析结果的正确性。

图8 差异表达基因的GO富集分析Fig.8 GO enrichment analysis of differentially expressed genes

图9 差异表达基因的GSEAFig.9 GSEA of differentially expressed genes

图10 脂质代谢相关基因mRNA表达的qRT-PCR验证Fig.10 qRT-PCR verification of mRNA expression levels of genes related to lipid metabolism
3 讨 论
益生菌调节肠道微生物菌群已成为治疗代谢疾病的一种新方法[12-14]。本研究中解淀粉芽孢杆菌BLCC1-0238干预可有效减缓高脂诱导的NAFLD小鼠的体质量增加,减少肝脏细胞脂肪变性和沉积,降低血清中胆固醇水平以及AST和ALT水平,说明解淀粉芽孢杆菌BLCC1-0238对NAFLD具有明显的缓解作用。这与 Shobharani等[15]饲喂弯曲芽孢杆菌和地衣芽孢杆菌后降低了大鼠血清胆固醇水平的研究结果一致。
双歧杆菌是肠道中主要益生菌,可产生短链脂肪酸(在脂质稳态和减少炎症中发挥重要作用),对代谢类疾病有缓解作用。临床中口服双歧杆菌可降低NAFLD患者的肝脏脂肪沉积、转氨酶活性以及炎症指标水平[16]。在本研究中,解淀粉芽孢杆菌BLCC1-0238改变了NAFLD小鼠肠道微生物菌群的多样性,显著增加了肠道中双歧杆菌的相对丰度,表明解淀粉芽孢杆菌BLCC1-0238可通过调节肠道微生物菌群结构,增加有益菌数量,影响机体脂质代谢等过程来缓解NAFLD。
肝细胞内脂质过度沉积是NAFLD发生的重要因素[17]。本研究中肝组织转录组学分析显示,解淀粉芽孢杆菌BLCC1-0238抑制了许多NAFLD引起的基因表达活性,显著下调了脂质代谢、胆固醇代谢、甘油三酯代谢、甾醇生物合成、类固醇生物合成、脂肪酸生物合成等脂质合成和代谢生物过程,说明解淀粉芽孢杆菌BLCC1-0238可有效降低NAFLD小鼠肝细胞内的脂肪变性和脂质沉积。研究发现,5种芽孢杆菌混合物能够显著降低高脂饮食导致的小鼠肠道通透性增加,明显逆转肝脂肪变性,保护小鼠免受高脂饮食诱导的肥胖、NAFLD的影响[18];鼠李糖乳杆菌LV108发酵乳能够通过改变过氧化物酶、乙酰基-CoA羧化酶复合体等蛋白质表达,来调控胆固醇合成、脂肪酸β-氧化等代谢过程[19]。这些研究结果均与本研究一致,再次说明解淀粉芽孢杆菌能够成为候选益生菌,通过调节肠道微生物菌群和脂质代谢平衡来缓解NAFLD。
综上,解淀粉芽孢杆菌BLCC1-0238可以有效减轻高脂饮食诱导NAFLD小鼠的体质量增加并降低肝脏和血清中脂质水平。经肠道基因组学和肝脏转录组学分析,解淀粉芽孢杆菌BLCC1-0238通过调节肠道微生物菌群结构,增加双歧杆菌相对丰度,以及调控肝脏脂质代谢通路来缓解NAFLD。我们的研究表明,芽孢杆菌是一种很有前景的益生菌,可改善高脂饮食导致的NAFLD。

