人参皂苷Rg3通过活性氧/c-Jun氨基末端激酶对骨肉瘤细胞凋亡与自噬影响
李曼玲, 白曼莫, 吴海波
三亚市中医院 骨科,海南 三亚 572000
骨肉瘤是一种多基因改变疾病,好发于儿童和青少年。骨肉瘤的恶性程度较高,容易发生转移,临床上约80%患者在确诊时已经发生转移[1]。有研究显示,转移性骨肉瘤患者5年存活率仅10%~20%[1]。目前,临床采用手术、新辅助化疗等综合方案治疗骨肉瘤,极大提高了患者的5年存活率,但仍有27%接受化疗患者3年内出现局部复发;另外,化疗药的不良反应较大,严重影响了患者的生活质量[2]。寻找新型、安全的治疗药物是临床亟待解决的问题。人参皂苷Rg3(ginsenoside Rg3,G-Rg3)是人参中的主要活性成分,具有强大的药理学活性,具有抗氧化、抗炎、神经保护和抗肿瘤等作用[3]。有研究表明,G-Rg3可作用于肿瘤发生的不同环节,如增殖、侵袭、凋亡和自噬等,通过多种生物学机制发挥抗癌作用[4-5]。关于G-Rg3治疗骨肉瘤疗效的研究较少。活性氧(reactive oxygen species,ROS)是生物有氧代谢的副产物,正常生理状态下,ROS可以促进细胞的增殖和分化,但过量ROS可造成细胞氧化应激损伤。ROS可以激活下游丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)诱导细胞发生凋亡和自噬。c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)是MAPK家族的重要成员之一,ROS/JNK通路可能是治疗骨肉瘤的潜在靶点[6-7]。本研究通过分析G-Rg3对骨肉瘤细胞凋亡、自噬的影响,及其对ROS/JNK通路的作用,旨在为G-Rg3的应用提供依据。现报道如下。
1 材料与方法
1.1 主要试剂 G-Rg3购于山东维奇生物科技有限公司;ROS清除剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)、JNK特异性抑制剂SP600125均购自北京百奥莱博科技有限公司;PRMI 1640培养基、Opti-MEM培养液、胎牛血清、胰蛋白酶、青霉素链霉素双抗均购于上海语纯生物科技有限公司;MTT检测试剂盒、流式细胞分析试剂盒、LipofectionTM3000转染试剂、EGFP-LC3质粒、BAX抗体、Bcl-2抗体、Beclin1抗体、P62抗体、p-JNK抗体和GAPDH内参抗体均购于生工生物工程(上海)股份有限公司; ROS检测试剂盒购于上海齐源生物科技有限公司。
1.2 细胞培养 人骨肉瘤细胞(MG63)购于上海中科院细胞库,将细胞培养于含1%青霉素链霉素双抗、10%胎牛血清的PRMI 1640培养基中,37℃、5%CO2条件下培养,每3 d传代1次。本研究所用细胞为对数生长期细胞。
1.3 G-Rg3对MG63细胞活力、凋亡和自噬的影响
1.3.1 MTT 检测肿瘤细胞活力 96孔板中接种MG63细胞,每孔100 μl,加入不同剂量的G-Rg3(0、40、80、160 μmol/L)[8],在37℃、5%CO2条件下培养24 h,每个培养孔加入MTT溶液50 μl,温室孵育4 h,随后吸出上清液,加入二甲基亚砜(dimethyl sulfoxide,DMSO)溶液,150 μl。用酶标仪在570 nm处检测光密度值(optical density,OD)值。本研究重复4次。
1.3.2 流式细胞术检测细胞凋亡 将MG63细胞以5×105个细胞密度接种于6孔板中,每孔加入2 ml无双抗培养基,24 h后分别加入不同剂量的G-Rg3(0、40、80、160 μmol/L[8]),24 h后用胰酶消化收集细胞,加入400 μl结合液重悬细胞,随后再加入5 μl Anexin V-FITC,4℃孵育15 min。用流式细胞仪和Flowjo V7软件检和分析测凋亡率。本研究重复4次。
1.3.3 激光共聚焦显微镜观察细胞自噬 将MG63细胞接种于激光共聚焦培养皿中,细胞贴壁后用LipofectionTM3000进行转染。转染前用Opti-MEM培养液将EGFP-LC3质粒(500 ng)和转染试剂(5 μl)配置成对应的溶液,二者混匀后室温放置15 min。随后将混合液加入6孔板,37℃培养6 h,更换培养液为含1%胎牛血清的PRMI 1640培养液,培养24 h后倒置激光共聚焦显微镜观察LC3 puncta数目。
1.3.4 蛋白免疫印迹法检测凋亡和自噬蛋白表达水平 RAPI裂解液提取细胞中的总蛋白,用BCA试剂盒检测蛋白浓度,10% SDS-PAGE电泳分离蛋白,用半干转移法将蛋白转至PVDF膜上。随后用5%脱脂奶粉封闭2 h,加入BAX抗体(1∶500)、Bcl-2抗体(1∶500)、Beclin1抗体(1∶1 000)或P62抗体(1∶500),4℃过夜孵育,次日除去一抗,用TBST缓冲液洗涤3次后加入二抗,封闭1 h。ECL发光仪进行蛋白成像,Image J软件分析灰度值。本研究重复4次。
1.4 G-Rg3通过ROS/JNK通路诱导MG63细胞凋亡和自噬
将细胞分为对照组(CON)组,向细胞中加入等量培养液;G-Rg3组,向细胞中加入160 μmol/L G-Rg3;G-Rg3+NAC组,向细胞中同时加入160 μmol/L G-Rg3、ROS清除剂NAC;G-Rg3+SP600125组,同时加入160 μmol/L G-Rg3、JNK特异性抑制剂SP600125。
1.4.1 ROS检测 细胞培养48 h后,用生理盐水洗涤2次,随后加入5 μmol/L二氢乙啶,4℃孵育15 min,用流式细胞术检测细胞中ROS的产生,阳性细胞发射红色荧光。细胞ROS水平用ROS阳性细胞数与总细胞数比值表示。本研究重复4次。
1.4.2 细胞凋亡和细胞自噬检测 方法同1.3.2和1.3.3。
1.4.3 蛋白免疫印迹法检测蛋白表达水平 方法同1.3.4。
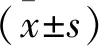
2 结果
2.1 G-Rg3对MG63细胞活力的抑制作用 应用40、80、160 μmol/L的G-Rg3对MG63细胞进行干预,细胞活力均受到抑制,并且存在剂量依赖性(F=15.908,P<0.05),其中,160 μmol/L的抑制效应最显著(图1)。
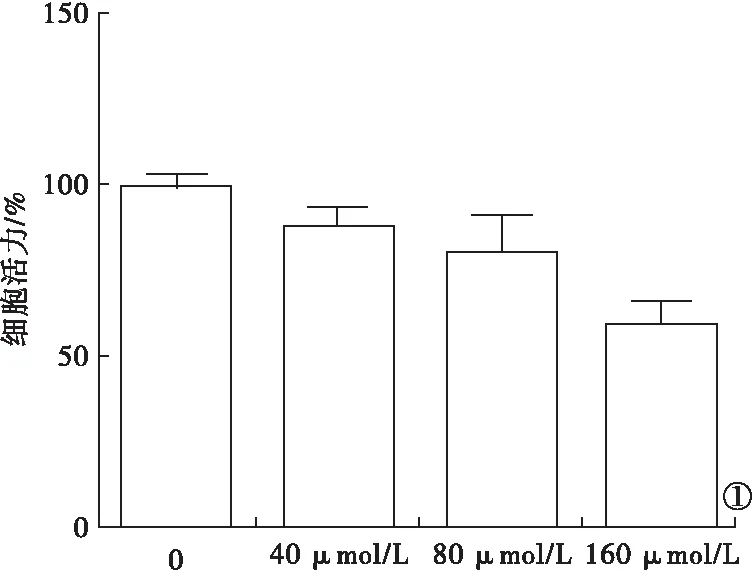
图1 G-Rg3对MG63细胞活力的抑制作用
2.2 G-Rg3诱导MG63细胞发生凋亡和自噬 不同浓度的G-Rg3均可诱导MG63细胞发生凋亡(F=19.003,P<0.05),使BAX蛋白表达水平升高(F=36.120,P<0.05),Bcl-2蛋白表达水平下降(F=40.002,P<0.05),且存在剂量依赖性(图2)。激光共聚焦显微镜观察到不同浓度G-Rg3均可诱导MG63细胞发生自噬,LC3 puncta数目形成增加(F=21.542,P<0.05),使Beclin1蛋白表达水平升高(F=18.334,P<0.05),P62蛋白水平下降(F=17.281,P<0.05),且存在剂量依赖性(图3)。
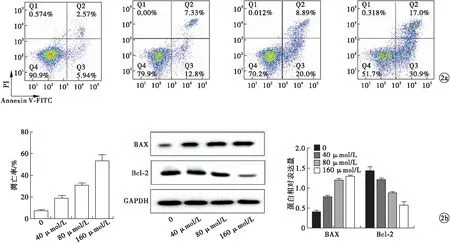
图2 不同浓度G-Rg3对MG63细胞凋亡的影响(a.流式细胞术检测细胞凋亡;b.蛋白免疫印迹法检测凋亡蛋白表达)
图3 不同浓度G-Rg3对MG63细胞自噬的影响[a.激光共聚焦显微镜观察细胞自噬(400倍);b.蛋白免疫印迹法检测凋亡蛋白表达]
2.3 G-Rg3通过ROS/JNK通路诱导MG63细胞凋亡和自噬 G-Rg3(160 μmol/L)可以明显诱导MG63细胞ROS的产生(P<0.05)和JNK的活化(P<0.05),使细胞发生凋亡(P<0.05)和自噬(P<0.05)。NAC可以抵消G-Rg3诱导细胞凋亡(P=0.004)、自噬(P=0.009)、ROS(P<0.001)和JNK(P<0.001)活化的效应。在细胞中加入SP600125后,G-Rg3无法诱导细胞凋亡(P<0.001)、自噬(P<0.001)和JNK活化(P<0.001),但是对ROS(P=0.201)产生无影响(图4)。G-Rg3使MG63细胞BAX(P<0.001)和Beclin1(P=0.002)蛋白表达水平升高,使Bcl-2(P<0.001)和P62(P<0.001)蛋白水平降低。NAC可以抵消G-Rg3引起的BAX(P<0.001)和Beclin1(P=0.006)蛋白表达水平升高,抵消Bcl-2(P<0.001)和P62(P<0.001)蛋白水平降低。在细胞中加入SP600125后,G-Rg3无法引起BAX(P<0.001)和Beclin1水平升高(P<0.001),Bcl-2(P=0.002)和P62(P=0.001)水平下降(图5)。以上说明,G-Rg3诱导MG63细胞凋亡和自噬的信号通路为ROS/JNK途径。
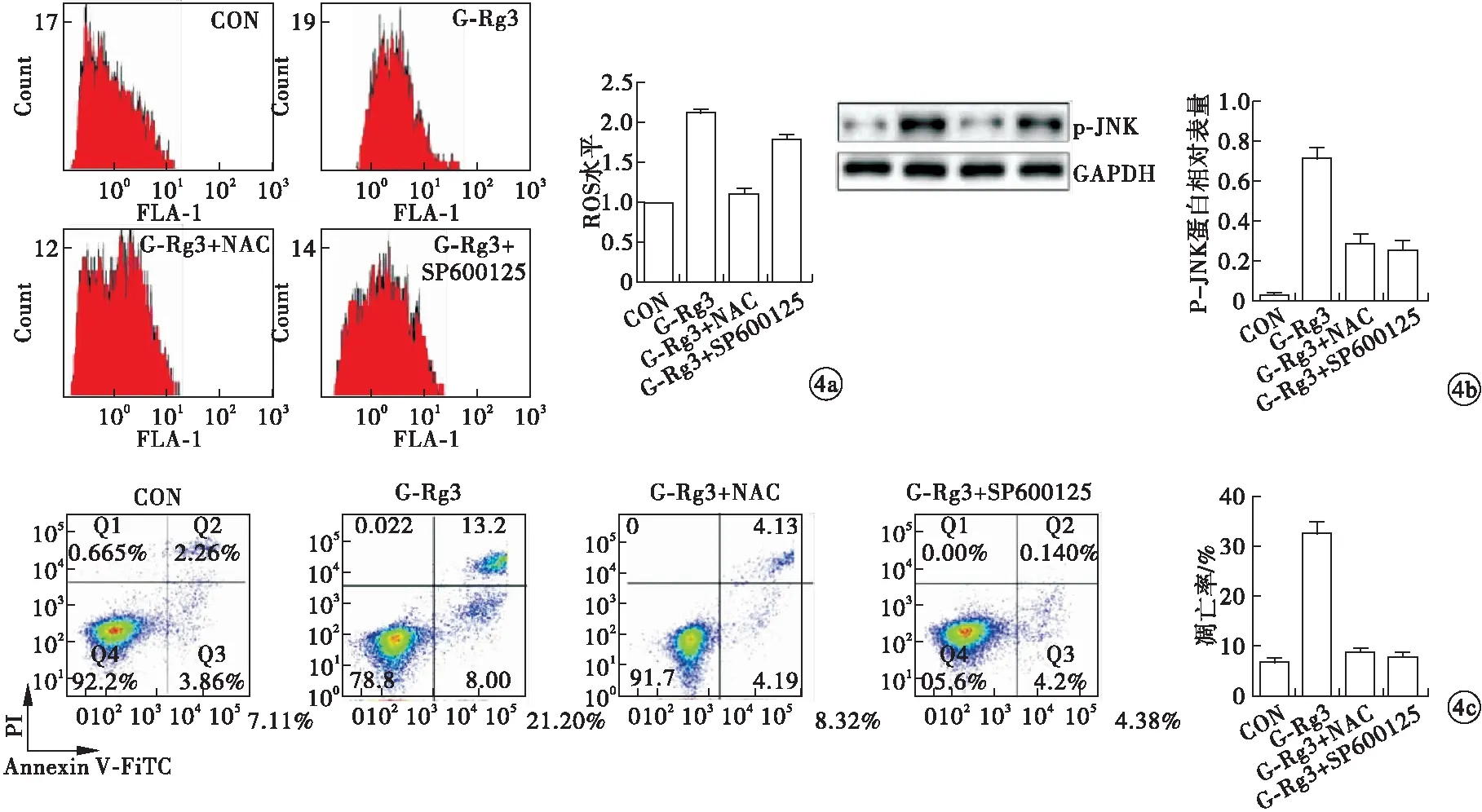
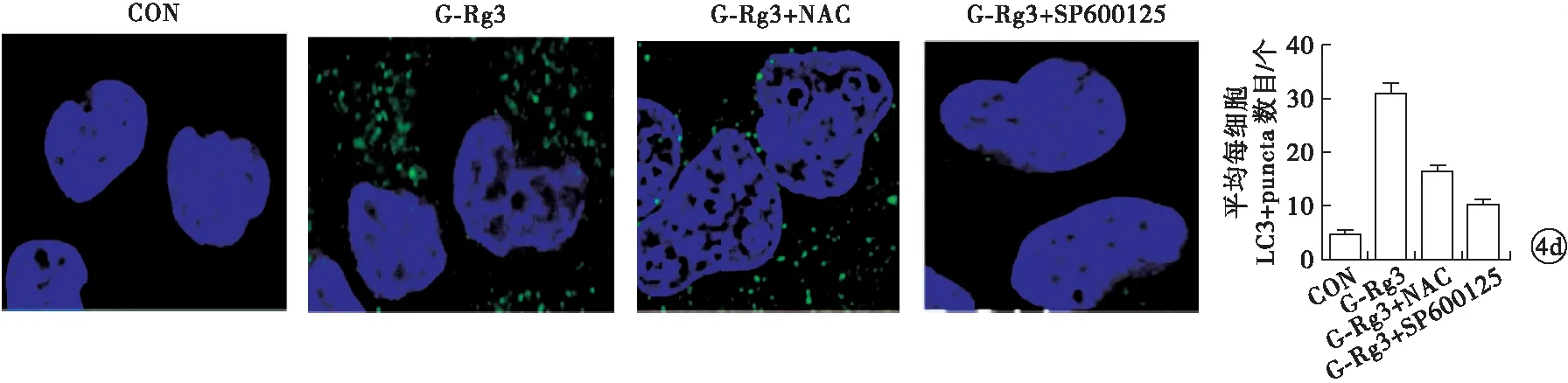
图4 G-Rg3(160 μmol/L)通过ROS/JNK通路诱导MG63细胞凋亡和自噬[a.流式细胞术检测ROS水平(与CON比值);b.蛋白免疫印迹法检测p-JNK蛋白表达水平;c.流式细胞术检测细胞凋亡;d.免疫荧光观察细胞自噬]
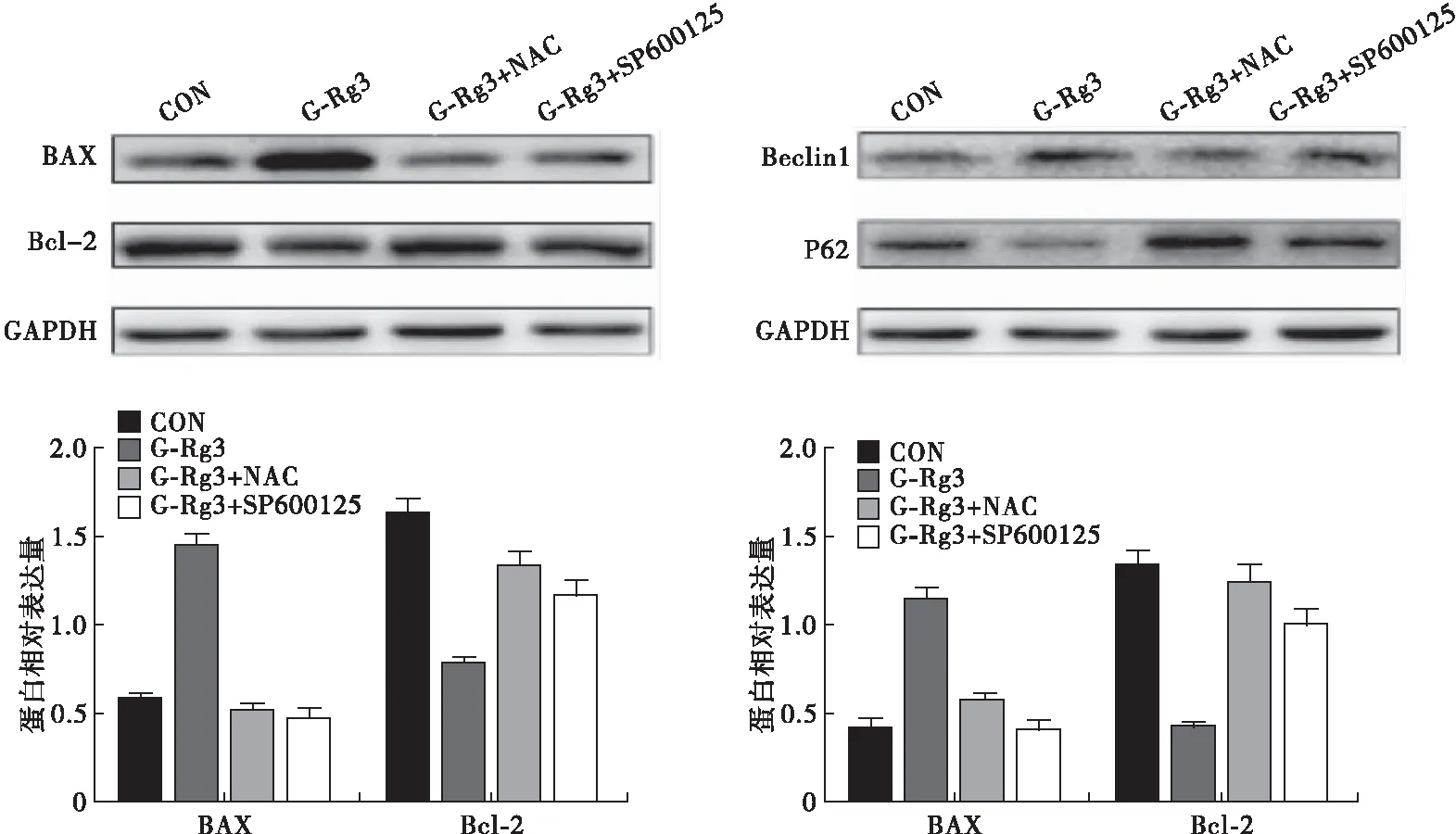
图5 蛋白免疫印迹法检测蛋白表达水平
3 讨论
骨肉瘤预后较差,寻找新的治疗药物势在必行[9]。人参是传统中药材,其活性成分G-Rg3近年来备受关注。G-Rg3属于人参二醇型四环三萜类皂苷,具有抗肿瘤活性,其机制可能为:诱导凋亡和抑制增殖、抑制上皮间质转化、抑制肿瘤细胞干性、激活内质网应激、调节表观遗传修饰、促进DNA损伤修复、抑制糖酵解[10]。本研究通过体外研究发现,不同浓度G-Rg3均能有效抑制骨肉瘤细胞MG63细胞活力,诱导细胞发生凋亡和自噬,且存在剂量依赖性。类似的,既往研究亦发现,G-Rg3能抑制结直肠癌、乳腺癌、肝细胞癌等细胞增殖[11-13]。
ROS是细胞代谢的副产物,少量ROS可以促进细胞的增殖、分化,而过量的ROS可造成细胞氧化应激损伤[14]。有研究显示,ROS可以激活下游MAPK信号通路,抑制细胞增殖[14]。JNK是MAPK信号通路的重要分支,在细胞氧化应激损伤和免疫炎症损伤过程中起重要作用[15]。有研究表明,JNK激活能明显诱导骨肉瘤细胞的凋亡和自噬,抑制增殖[16]。通过ROS/JNK信号通路可能开发出骨肉瘤的潜在治疗药物[17-19]。
本研究采用160 μmol/L G-Rg3进行后续机制研究。本研究结果显示,ROS清除剂可以抵消G-Rg3诱导细胞凋亡、自噬、ROS和JNK活化效应。在细胞中加入JNK特异性抑制剂SP600125后,G-Rg3无法诱导细胞凋亡、自噬和JNK活化,但对ROS产生无影响。BAX和Bcl-2是细胞凋亡标志物,Beclin1和P62是细胞自噬标志物。NAC可以抵消G-Rg3引起的BAX和Beclin1蛋白表达水平升高,抵消Bcl-2和P62蛋白水平降低。在细胞中加入SP600125后,G-Rg3无法引起BAX和Beclin1水平升高,Bcl-2和P62水平下降。以上结果说明,G-Rg3诱导MG63细胞凋亡和自噬的信号通路为ROS/JNK途径。
综上所述,G-Rg3可能通过ROS/JNK通路诱导骨肉瘤MG63细胞发生凋亡和自噬。G-Rg3可能成为治疗骨肉瘤的潜在药物。本研究亦存在一定局限性,如本研究仅选择了一种骨肉瘤细胞系进行研究;本研究仅进行了体外细胞研究,未在体内进行验证。本研究未分析G-Rg3对骨肉瘤细胞周期的影响,有研究发现,G-Rg3可能通过ROS影响前列腺癌细胞周期,进而抑制细胞增殖[20]。G-Rg3对骨肉瘤细胞的作用机制需要未来深入分析。

