胃底腺型胃癌1 例并文献复习
寇梦佳 宫宇澄 王志斌
1.北京中医药大学第二临床医学院,北京 100078;2.北京中医药大学东方医院脾胃肝胆科,北京 100078
胃底腺型胃癌(gastric adenocarcinoma of the fundic gland type,GA-FG)是一种新的胃癌组织分型,有别于以往Lauren 分型弥漫型和肠型的胃癌,肿瘤多见于无肠上皮化生和萎缩的正常黏膜深层。2007 年日本学家Takemoto 等[1]报道了第一例GA-FG 患者。2010 年Ueyama 等[2]提出将GA-FG 作为一个新的实体。2019 年世界卫生组织正式在消化肿瘤分类中将GA-FG 纳入胃腺癌的亚型之一[3]。GA-FG 患者的报道主要来自日本和韩国[4],我国的报道较少,但其发病例数可能被低估。现选取1 例就诊于北京中医药大学东方医院脾胃肝胆科的GA-FG 患者,梳理其诊治过程,并结合文献分析,总结其临床表现,内镜及病理特征、诊断与治疗,以期提高临床对本病的认识,减少漏诊误诊。
1 病例资料
患者,女,65 岁,无明显诱因出现反酸烧心,无腹胀腹痛,质子泵抑制剂用药物史,既往高血压病史,否认肿瘤家族遗传病史,于2020 年7 月30 日北京中医药大学东方医院脾胃肝胆科门诊行普通电子胃镜检查,检查结果显示:胃体中部胃小弯侧可见一处黏膜发红,周围伴有一枚胃底腺息肉(fundic gland polyp,FGP)(图1A),于胃体中部取2 例胃黏膜组织病理活检,1 例病变符合FGP,1 例活检为GA-FG 可能。周边胃黏膜组织显示慢性非萎缩性胃炎。2020 年9 月17 日,患者因间断反酸烧心于北京中医药大学东方医院西院区脾胃肝胆科住院治疗,并于当日行胃镜下黏膜剥离术(endoscopic submucosal dissection,ESD)治疗,内镜下可见胃体中部胃小弯侧一处黏膜发红,平坦(图1B)。内镜电子分光图像处理(Fuji intelligent chromo endoscopy,FICE)观察,可见腺管开口整齐,血管完整,可见血管增粗,部分血管迂曲(图1C~D)。病变的边缘可见一活检瘢痕。ESD 送检标本病理显示(图2A):胃黏膜组织可见一灶主细胞为主的结节,最大直径为0.3 cm,结合免疫组化符合GA-FG,免疫组化及切片提示肿瘤侵黏膜下层,侵袭黏膜下层深度约为100 μm(镜下见黏膜下层厚度约200 μm),未见明确脉管瘤栓及神经侵袭。免疫组化结果显示:MUC6(+)(图2C),MUC5AC(-),CD10(-),黏膜肌层断裂(SMA)(图2B),Ki67(+,5%)(图2D),P53(-),EMA(+),CDX-2(-),CD56(±),Syn(-),CgA(-),黏膜肌层断裂(Desmin)。术后3 个月复查胃镜,未见明显异常,目前仍在随访中。
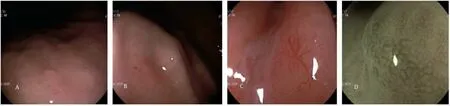
图1 内镜下表现
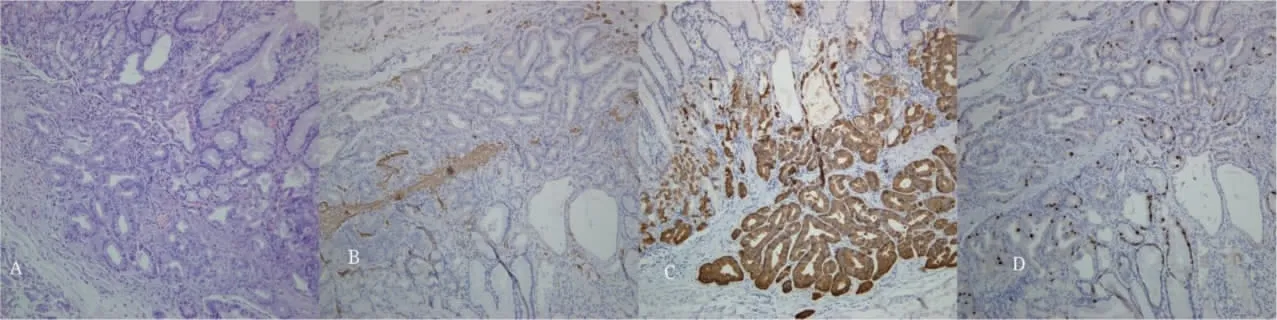
图2 术后病理结果
2 讨论
GA-FG 是一种罕见的高分化腺癌[5],患者平均年龄为66 岁,男性的发病率是女性的2.2 倍[4]。与传统胃癌不同,肿瘤多发生在正常的黏膜,与幽门螺杆菌(Helicobacter pylori,Hp)感染,肠上皮化生及胃黏膜萎缩等常规胃癌发生因素并无明显相关[4,6]。本例患者年龄为65 岁,胃黏膜为慢性非萎缩性胃炎。肿瘤体积小、浸润率高,但进展缓慢、恶性低,预后较一般的胃癌好[7]。因其临床症状不典型,内镜下诊断具有局限性,容易误诊漏诊,需结合组织病理学诊断。
2.1 临床特点
GA-FG 临床表现无特异性,多数患者无任何症状或仅有轻微上腹部不适,或体检中偶然发现[8]。本病例患者有较明显的临床表现,主因反酸烧心就诊。既往Singhi 等[9]报道的12 例GA-FG 中有10 例表现为胃食管反流症状,Li 等[10]报道的8 例患者中5 例有反酸烧心。可以推测胃食管反流症状可能为GA-FG 较为常见的症状,但还需要更多的数据支持。
GA-FG 的病因及发病机制尚不明确,现有报道认为Wnt-β-catenin 信号通路或ERK1/2MAPK 通路的激活及GNAS 的激活突变在GA-FG 的发生中起了重要作用[11-12]。众所周知离子泵抑制剂(proton pump inhibitor,PPI)的使用会引起组织学变化,即主细胞和壁细胞的增生,而其增生可表现为FPG 和胃底腺异常增生[13-14]。结合本文,患者有胃食管反流的症状,PPI用药史,且在病变周围伴有一枚FGP,可以推测GA-FG的发生可能与PPI 及胃酸相关。一些既往GA-FG 报道中亦有胃食管反流症状,有PPI 及其他抑酸治疗史,证实这一假说。但是大部分文献并没有服药史,需要更多的报道来探究GA-FG 的发病机制。
2.2 诊断
GA-FG 的发病部位多在胃体上部,其次是中部,下部较为少见。病灶较小,平均直径<10 mm,最大的直径为85 mm[4]。GA-FG常见的内镜下特征为[2,15]:①形态多为黏膜下肿瘤SMT 样隆起型,其次是平坦型,凹陷型较为少见;②表面的颜色多为正常或发白呈褪色调;③GA-FG 周围黏膜背景多为无黏膜萎缩及肠上皮化生的正常黏膜;④肿瘤表面有迂曲扩张的血管及分支血管。然而本病灶颜色为红色,与大多数GA-FG 患者不太一致,既往患者中也有红色的报道,具体原因尚不明确。关于发白的颜色,Miyazawa 等[16]认为可能由于肿瘤位于黏膜深层,黏膜下血管透明性降低,从而使黏膜表面变暗而产生的。另外越来越多的证据显示,“GA-FG 周围黏膜背景无萎缩” 已经不能成为GA-FG 的显著特征,在Hp 根除术后的萎缩性黏膜上也可以产生GA-FG[17]。Ishibashi 等[18]将4 例未感染Hp 的GA-FG 及HP 根除后萎缩性黏膜上产生的GA-FG 进行内镜及病理特征比较,发现HP 根除后的GA-FG 黏膜肿瘤的覆盖层变薄,胃底腺细胞减少。GA-FG 的内镜下诊断并未形成统一的标准,利用内镜窄成像技术在诊断GA-FG 时有局限性,运用VS 分类方法,易诊断为非癌。Yao 等[19]提出的早期胃癌的VS 分系统为病变有边界线,表面微血管(microvascular pattern,MVP)或是表面微结构(microsurface pattern,MSP)异常。而GA-FG 肿瘤来源于黏膜深层,从黏膜深层侵入到表浅层,部分到黏膜下层,表层覆盖正常的上皮细胞,缺乏清晰的边界线,MVP 及MSP也未见明显异常,所以易诊断为非癌[20]。因此GA-FG还需形态学及免疫表型来明确诊断。
GA-FG 由类似于胃底腺形态的轻度异型柱状上皮细胞组成。通常分为主细胞主型、壁细胞主型及主、壁细胞混合型。免疫组织化学标志物在诊断中有着重要作用[4,8,21]。特征性指标为MUC6 呈强阳性,主细胞主型胃蛋白酶原-1 染色阳性,壁细胞主型Hk/kk-ATP酶强阳性。小凹上皮标记MUC5C 阴性,肠上皮标记CD10 阴性,P53 无过度表达,Ki67 指数通常<10%,增殖活性较低。本例患者肿瘤腺体MUC6 阳性,MUC5AC 阴性,CD 阴性,Ki67(+,5%),P53(-),SMA,Desmin,黏膜下浸润200 μm,可明确诊断为GA-FG。
GA-FG 应与以下疾病进行鉴别:①神经内分泌瘤:隆起型GA-FG 应该与神经内分泌瘤进行鉴别,内镜下GA-FG 大多数为白色,肿瘤表面血管扩张。神经内分泌瘤则为淡黄色,肿瘤表面几乎没有扩张的血管。组织学特征也较为相似都是小而圆的肿瘤细胞,都在黏膜深层。免疫组织化学检查是主要的鉴别方法。本文中患者病变部位发红,且肿瘤表面有扩张的血管,可以初步鉴别。②扁平或凹陷型GA-FG 则需要与早期胃癌,黏膜相关淋巴样组织淋巴瘤,局部萎缩的慢性胃炎和慢性非萎缩胃炎进行比较,主要靠组织学,腺体的结构,黏膜下是否有浸润,以及免疫表型进行区分。③FGP 的异常增生和腺癌:FGP 类似于正常的胃底腺细胞,且具有轻度的核异型性,容易误诊为GA-FG。FGP 的异常增生主要是来源于小叶上皮,来源于黏膜表面而非黏膜深层的胃底腺。本例患者病变处伴有一枚FGP,应仔细鉴别。
2.3 治疗及预后
GA-FG 为低风险的癌症,黏膜下的侵袭率高,但生物恶性程度不高,Ki67 指数较低,增殖活性不强,较少有血管、淋巴管及胃外转移。Benedict 等[4]整理报道的111 例GA-FG 患者中,63 例(57%)是黏膜下侵犯,7 例(6%)为血管淋巴管侵犯。这并不意味着GAFG 可以不做任何治疗[21],日本科学家Okumura 等[22]报道了首例GA-FG 淋巴结转移的患者,提示GA-FG虽然进展缓慢,仍可成为具有转移潜力的侵袭性癌症。目前GA-FG 尚未形成统一的治疗方案,对于浅表的黏膜下浸润多采用ESD 治疗,黏膜下浸润深度>500 μm 或伴有血管、淋巴管转移的肿瘤,则需手术治疗[23]。本例患者黏膜下浸润深度约为100 μm,未出现脉管侵袭,采用内镜治疗即可。GA-FG 的预后较好,Li 等[24]对5 例ESD 治疗术后的GA-FG 患者进行36 个月以上的随访,结果发现ESD 切除术后并未出现肿瘤复发,周围黏膜组织无萎缩及肠上皮化生。本例患者3 个月后复查胃镜未见明显异常,与文献所述一致,但仍需要长期随访,患者目前随访中。
3 小结
GA-FG 是一种新的胃癌的组织分型,但其恶度低,发展十分缓慢,内镜治疗为主要的治疗方法。虽然预后较好,但仍需长期随访。目前该病报道的患者数量较少,内镜下诊断有局限性,尚未形成明确共识,需结合临床病理学明确诊断。临床上要加深对本病的认识,提高警惕,进行仔细的内镜检查,避免误诊漏诊,做到早发现早治疗。至于本病的发病原因是否与PPI服用及胃酸有关,临床表现是否为胃食管反流,需更多的病例报道进行研究论证。
——访北京中医药大学东直门医院大内科副主任、中医内科教研室主任赵进喜教授

