基于Akt/ mTOR 信号通路探讨药熨疗法对神经根型颈椎病大鼠神经细胞结构及自噬因子表达的影响
赵玉玲 黄 沂 周艳琼 蒋菲菲 陈海燕
广西中医药大学第一附属医院护理部,广西南宁 530023
神经根型颈椎病(cervical spondylotic radiculopathy,CSR)是临床上最常见的颈椎病,神经病理性疼痛系其主要症状。神经根受压导致的神经根损伤是CSR患者疼痛的主要原因[1],神经根损伤导致神经细胞凋亡增多。如何降低细胞凋亡,修复神经根损伤是治疗CSR 关键。细胞自噬与神经病理性疼痛显著相关,调节细胞自噬可改善疼痛[2]。PI3K/Akt/mTOR 通路在细胞增殖与凋亡中起关键作用,是经典的抗凋亡通路,Akt/mTOR 通路是细胞自噬重要的负性调控路径[3],激活该通路能减少细胞凋亡,促进受损神经恢复,发挥对细胞的保护作用。前期实验证实药熨疗法可降低CSR 大鼠自发性疼痛评分,提高机械痛阈值[4],本研究基于Akt/mTOR 通路探讨药熨疗法调节细胞自噬、减少细胞凋亡的机制,为药熨疗法的临床应用提供理论基础。
1 材料与方法
1.1 实验动物与分组
选取体重150~200 g 的4 周龄SPF 级SD 大鼠18 只(斯贝福生物技术有限公司),许可证号:SCXK(京)2019-0010,予温度(23±2)℃、湿度60%、12 h 循环灯光、标准饲料、自由饮水,饲养7 d 适应环境,稳定机能。随机选取其中6 只作为空白组,其余建立CSR 模型。造模成功后,将其按随机数字表法分为模型组、药熨组,每组各6 只。对大鼠处置遵从实验动物福利相关规定进行。
1.2 试剂与仪器
1.2.1 主要试剂 RIPA 裂解液(北京索来宝公司,货号:R0020);ECL 发光试剂盒(北京中杉金桥生物技术有限公司,货号:sc-2048);PVDF 膜(Millipore 公司,货号:IPVH00010);山羊抗兔二抗、山羊抗鼠二抗(北京中杉金桥生物技术有限公司,货号:ZB2301、ZB2305);p-Akt、p-mTOR、Beclin-1、LC3A/B 抗体、β-actin(Affinity公司,货号:AF0016、AF3308、AF5128、AF5402、AF7018)。
1.2.2 实验仪器 低温高速离心机(Eppendorf 公司,centrifuge5417R);核酸蛋白定量仪DS-11(美国丹诺尔Denovix 超微量紫外可见分光光度计);半干转膜仪系统(ATTO 公司,WSE-4040、AE6675L);透射电子显微镜(HITACHI公司,HT7700);成像系统(日本OLYMPUS 公司,UC90)。
1.3 造模方法
手术造模,造模大鼠禁食禁水12 h。采用10%水合氯醛(0.35 ml/100 g)麻醉后手术,将无毒、性质稳定的0.5 mm 直径尼龙鱼线插入SD 大鼠C6-T1 位置,建立CSR 模型,术后取颈部患处神经根节进行HE染色,根据组织神经元细胞核、胞质及细胞形态结构判断是否造模成功[5]。
1.4 干预方法
造模7 d 后,药熨组开始药熨治疗,连续药熨7 d后处死。药熨包制备:乳香、没药、红花、桂枝、千年健、鸡血藤、牛大力、飞龙掌血各30 g,打碎置于瓦罐,50 度米酒浸泡,泡制6 个月后取出滤过,滤过后的药渣密封在陶罐。药熨包加热:药渣装入纯棉药熨包,将药熨包置入玻璃器皿,淋米酒,药熨包湿透但无液体滴出为宜,然后置于微波炉中火加热5~6 min,挤出多余药液,干燥棉纱布包裹。药熨操作:刮除大鼠局部毛发,取膀胱经、督脉、胆经[6],止血钳持药熨包以适当力度沿大鼠背部督脉风府穴自上而下烫至身柱穴,然后药熨督脉两侧膀胱经(天柱穴至膈俞穴),最后沿胆经风池穴经过肩井穴药熨到肩端,每条经脉药熨20 次,连续药熨7 d,动作轻柔连贯,以大鼠皮肤出现潮红为宜。每次药熨结束,喂大鼠适量温水。空白组、模型组不予任何处理,正常饲养,与药熨组同时处死。
1.5 评价指标及检测方法
1.5.1 石蜡切片HE 染色实验 将三组固定的神经组织样本流水冲洗,依次梯度酒精脱水后包埋成蜡块。切片、烤片后用苏木精染液、伊红染液染色,后依次在无水乙醇、二甲苯中脱色透明,中性树胶封片。光学显微镜下观察、拍照、分析。
1.5.2 透射电子显微镜观察神经细胞溶酶体、自噬小体及超微结构改变 神经组织样本取材投入透射电子显微镜固定液固定2~4 h,神经组织采用磷酸盐缓冲液漂洗3 次去上清,1%锇酸固定后再次磷酸盐缓冲液漂洗。系列梯度酒精、丙酮脱水后渗透,加入包埋剂包埋固化后超薄切片,铀铅双染色后于透射电子显微镜下观察。
1.5.3 Western blot 检测蛋白p-Akt、p-mTOR、Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表达量 取样品,加入300 μl 的RIPA 裂解液,充分混匀,4℃冰箱裂解2 h。4℃,12 000 r/min 离心10 min(离心半径5 cm),取上清,检测蛋白浓度。制备SDS-PAGE 凝胶,样品变性电泳,将分离的蛋白条带用半干转的转膜方式转印至PVDF 膜后对其孵育、检测。用磷酸盐缓冲液稀释一抗;将封闭后的膜直接放入一抗工作液,4℃反应过夜。根据最后的条带亮度再次确定一抗的稀释比例(Beclin-1、LC3A/B、p-Akt、p-mTOR 均为1∶1000),洗膜后,将二抗稀释3000 倍;将洗涤后的一抗反应膜放入二抗工作液,作用90 min 再次洗膜。根据条带亮度适当选择曝光时间。用Image Pro Plus 5.0 图像分析软件进行灰度分析,蛋白相对表达量用目标灰度与β-actin 灰度值比值表示。
1.6 统计学方法
采用GraphPad Prism 5 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,多组计量资料比较采用单因素方差分析,组间两两比较采用LSD-t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 三组HE 染色结果分析
空白组神经根组织形态基本正常,神经根外膜包裹完整,神经纤维和胞体排列较整齐,纤维轴突和髓鞘完整,胞体数量较多。模型组神经根组织受损较严重,神经根外膜包裹不完整,纤维排列紊乱,部分纤维轴突消失;胞体数量明显减少,核仁不明显。药熨组神经根组织形态部分受损,神经根外膜包裹较完整,纤维排列较整齐,胞体数量较空白组减少但比模型组多,间质有轻度炎症细胞浸润。见图1。
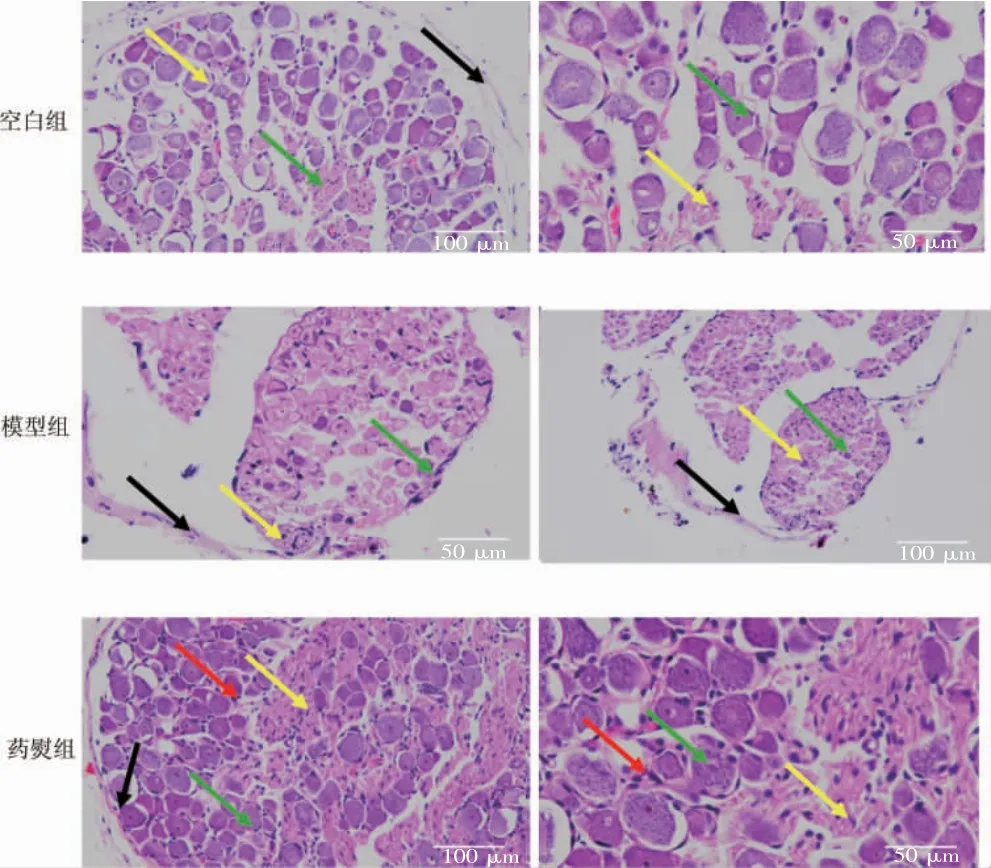
图1 三组HE 染色结果
2.2 三组透射电子显微镜
空白组细胞胞质丰富,线粒体丰富,嵴排列清晰。粗面内质网核糖体密集,可见少量溶酶体与自噬小体。模型组细胞核有空洞,线粒体膜模糊,部分嵴断裂,膜破裂。粗面内质网丰富,胞质内见大量溶酶体与自噬小体。药熨组细胞质丰富,线粒体部分膜破裂,部分嵴断裂溶解。粗面内质网丰富,胞质内的溶酶体与自噬小体数量均较模型组显著减少。见图2。
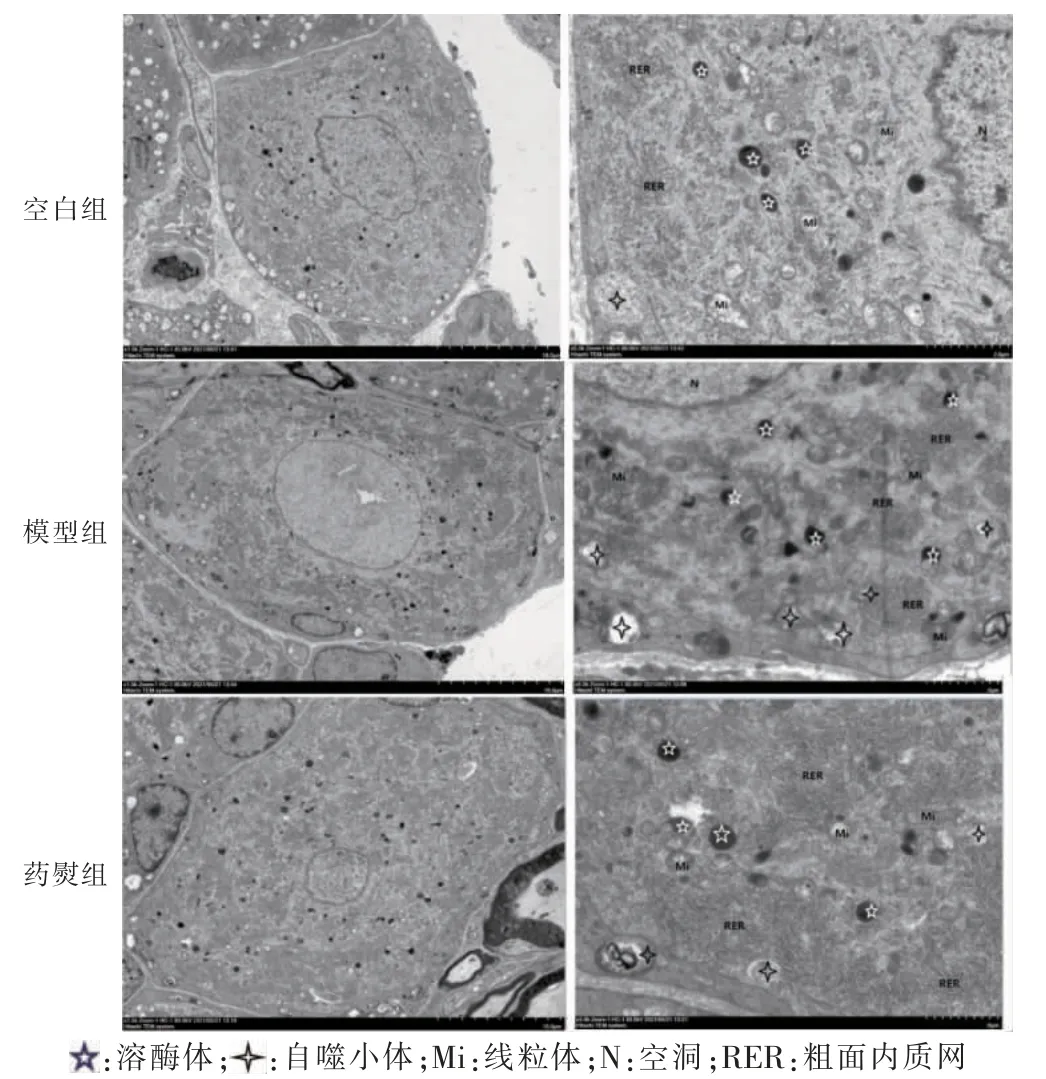
图2 三组透射电子显微镜下表现
2.3 三组p-Akt、p-mTOR、Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表达比较
模型组p-Akt、p-mTOR 蛋白表达低于空白组,LC3-Ⅱ/LC3-Ⅰ、Beclin-1 高于空白组,差异有高度统计学意义(P <0.01)。药熨组p-Akt、p-mTOR 蛋白表达高于模型组,LC3-Ⅱ/LC3-Ⅰ、Beclin-1 低于模型组,差异有高度统计学意义(P <0.01)。见图3。
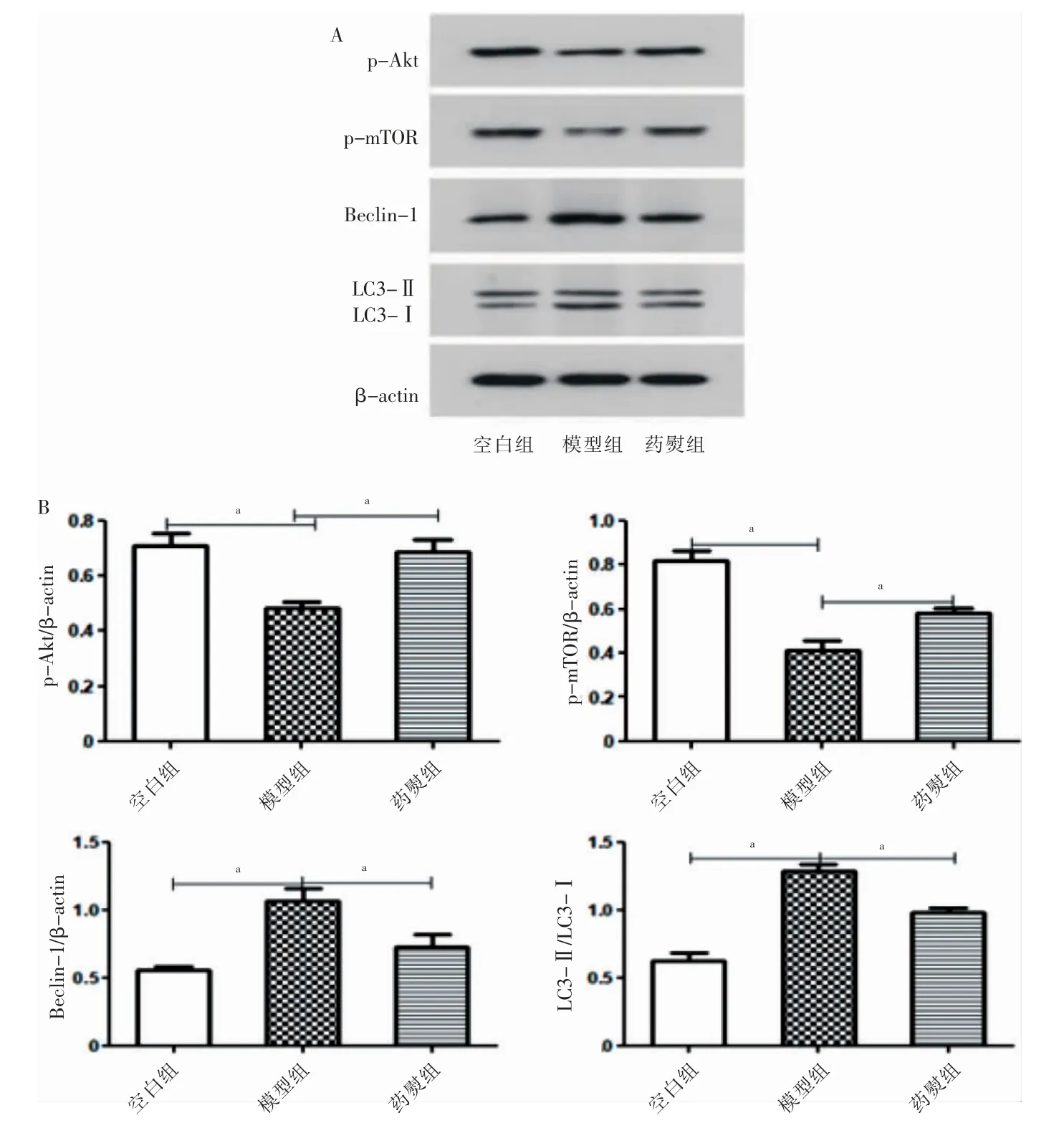
图3 三组p-Akt、p-mTOR、Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表达比较(n=6)
3 讨论
CSR 是由于颈部“阳化气”功能衰弱[7],风寒湿邪侵袭致营卫失和,湿性黏滞,造成寒凝瘀血痰湿等“阴翳”聚集。组织充血水肿、炎症细胞浸润,血液黏稠,阻滞脉络,经气不通而痛[8]。前期研究显示,循经药熨可显著改善CSR 患者神经病理性疼痛[4],下调血清肿瘤坏死因子-α、白细胞介素-1L 的水平。自噬在神经性疼痛发展中起重要作用[2]。过度自噬诱导细胞凋亡,自噬程度越高,细胞凋亡越多,两者呈正相关[9]。PI3K/Akt/mTOR 通路是目前已知调控细胞自噬的抑制性通路[10],Akt/mTOR 通路是自噬重要负性调控路径[3]。自噬之后继发凋亡是Akt/mTOR 通路被抑制的结果,激活Akt/mTOR 通路可抑制细胞凋亡。Akt 是重要的细胞凋亡抑制剂,是PI3K 下游主要靶因子,信号激活后被磷酸化为p-Akt,其表达量可反映磷酸化Akt 整体量[11-12],是信号通路正向激活标志[13]。mTOR 是Akt 下游重要转导分子,p-Akt 可直接激活其底物mTOR[14],mTOR 可调控细胞自噬抑制基因,mTOR 磷酸化为pmTOR 后介导PI3K/Akt/mTOR 通路下游分子降低自噬活性,抑制细胞凋亡,促进细胞周期进程[15-18]。结果显示,模型组p-Akt、p-mTOR 表达低于空白组,药熨组p-Akt、p-mTOR 表达高于模型组,提示药熨组可上调p-Akt、p-mTOR 蛋白表达量,并激活Akt/mTOR通路,该路径激活可抑制自噬蛋白活性,降低细胞自噬能力,并在抑制细胞凋亡中起关键作用[19-20]。
Akt/mTOR 通路可作用于众多靶分子调节自噬,如自噬关键基因Beclin-1、LC3[21]。Beclin-1 及LC3 是自噬标志性蛋白。Beclin-1 可调控自噬体形成,促进自噬小体起始囊泡形成,与自噬活性密切相关[22]。LC3是公认自噬体特异性标志分子,其蛋白表达量与自噬泡数量呈正相关[23]。LC3 分Ⅰ型、Ⅱ型,细胞自噬时,LC3-Ⅰ经泛素样加工修饰生成其蛋白水解衍生物LC3-Ⅱ[23]。LC3-Ⅱ/LC3-Ⅰ可评价自噬水平[24],本研究模型组自噬因子Beclin-1、LC3-Ⅱ/LC3-Ⅰ水平显著提升,即应激状态下,神经根损伤初期自噬较活跃,即细胞凋亡较多。HE 染色显示造模后细胞有局部炎症水肿、充血、浸润改变。透射电子显微镜检查也提示模型组细胞核出现空洞,线粒体的外膜模糊,部分存在嵴断裂及膜破裂现象,粗面内质网丰富,胞质内可见大量溶酶体和自噬小体。药熨组细胞质丰富,溶酶体和自噬小体均较模型组显著减少。自噬因子Beclin-1及LC3-Ⅱ/LC3-Ⅰ蛋白表达均下调,亦提示细胞自噬活性下降。细胞自噬活性下降,可在一定范围内降低细胞过度凋亡,保护受损神经细胞[25]。
药熨疗法通过对体表热刺激,加以传统中药乳香、没药、红花、桂枝、千年健、鸡血藤、牛大力、飞龙掌血,具有温经活络、散瘀镇痛、祛风除湿等功效[26]。通过加热使药物通透表里,深达脉络以畅通气血。药熨镇痛机制可能与激活Akt/mTOR 通路,适度下调神经细胞的自噬因子Beclin-1、LC3-Ⅱ/LC3-Ⅰ表达,降低细胞凋亡有关。

