一种新型双曼尼希碱酸化缓蚀剂的研制及其作用机理
陈安德,刘 峰,马建东,王 亮,田 力,赵太萍,吴 亚,张科良
(1.长庆油田分公司 技术检测中心,陕西 西安 710018;2.陕西蓝法电子智能科技有限公司,陕西 西安 710016;3.西安石油大学 化学化工学院,陕西 西安 710065)
引 言
在石油开采当中,酸化压裂是一种提高采收率的有效措施。然而,酸化会引起套管等金属管道的腐蚀。添加酸化缓蚀剂是控制金属腐蚀的有效手段。对N80钢在酸性溶液中起防腐作用的缓蚀剂大多为含氮、氧或硫原子的有机缓蚀剂,如曼尼希碱缓蚀剂等[1-2],也有部分无机缓蚀剂,如毒性低、污染小的钨酸盐。一般认为,有机缓蚀剂分子通常吸附在金属-溶液界面[3-4]。
本文制备了一种双曼尼希碱缓蚀剂(MM-1),采用静态失重法优化了双曼尼希碱的最佳制备条件,通过复配确定了最佳配方。采用电化学法、吸附热力学、电子扫描电镜、电子能谱等现代分析手段,进一步探究缓蚀剂的抗腐蚀机理。
1 实验部分
1.1 实验主要仪器与药品
37%甲醛,乙醇胺,均为分析纯试剂;添加剂2-苯甲酰基-3-羟基-1-丙烯(BAA)按文献方法自制[5];OP-10,炔醇A,工业品;4,4′-二乙酰基二苯醚自制;挂片N80,山东省阳信县晟鑫科技有限公司产品。
CS350型电化学工作站,武汉科思特仪器有限公司;JSM-6090A扫描电子显微镜,日本电子公司;217-1参比电极,上海仪电科学股份有限公司;213铂电极,上海仪电科学股份有限公司。
1.2 酸化缓蚀剂的制备
1.2.1 酸化缓蚀剂的制备原理
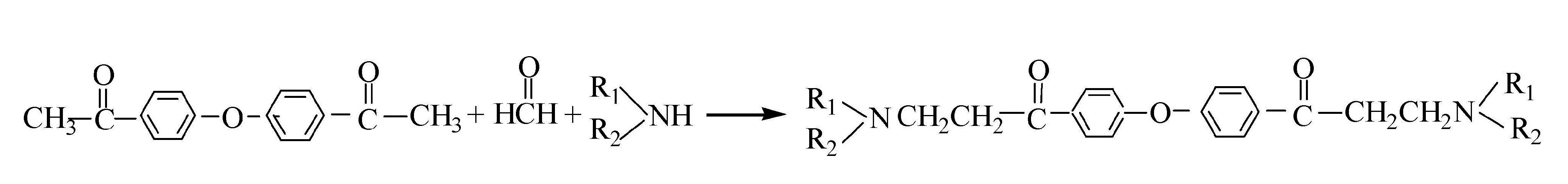
其中:R1为HOCH2CH2—;R2为H。
1.2.2 MM-1的制备
在三口瓶中安装机械搅拌器,回流冷凝器,恒压滴液漏斗。按反应计量比n(甲醛)∶n(4,4′-二乙酰基二苯醚)∶n(乙醇胺)=1.1∶0.5∶1.2加入乙醇胺与4,4′-二乙酰基二苯醚反应,搅拌条件下用等体积的无水乙醇稀释,再用1∶1的盐酸-乙醇调节pH=2,后加入37%的甲醛。加热至75 ℃,反应8 h。在90 ℃、15%盐酸、4 h、缓蚀剂投加量为1%的条件下进行抗腐蚀评价。
1.2.3 缓蚀剂配方研究
参考SY/T 5405-1996《酸化用缓蚀剂性能试验方法及评价指标》中的静态失重法,以Mannich化合物作为酸化缓蚀剂主剂,OP为分散剂,BAA与炔醇A为增效剂,通过正交实验研究各组分的缓蚀协同作用,确定缓蚀剂配方。实验条件:温度为90 ℃,时间为4 h,腐蚀介质为15%盐酸,腐蚀钢材为N80,缓蚀剂质量分数为1%。
1.3 扫描电镜分析
采用Quanta.450环境扫描电子显微镜观察N80钢片在未加和加有缓蚀剂的15%盐酸中腐蚀前后的表面微观形貌。实验所使用的扫描电子显微镜加速电压为20 kV,考虑到内表面N80钢的腐蚀形态特征,所选择的扫描放大倍数为150~5 000倍。
测试钢片样品的处理方法:将N80试片分别置于加有和未加有酸化缓蚀剂的15%盐酸中,于90 ℃下腐蚀4 h,取出试片,用纯水清洗试片表面的酸液,室温下自然晾干;然后,选择具有代表性的表面作分析面进行腐蚀形貌分析。
1.4 电子能谱分析
采用EDAX XM2 L X-射线能谱仪对扫描电镜测试样品表面的组成成分进行分析,通过对比腐蚀前后N80试片表面的元素种类以及元素含量的变化,探讨它们对N80钢的抗腐蚀作用机理。
2 结果与讨论
2.1 MM-1的制备条件优化
依据单因素研究结果(表1),选取醛酮胺摩尔比、反应温度、反应时间、介质pH值的合理范围并进行4因素3水平正交实验,以腐蚀速率作为考察指标,对缓蚀剂主剂的合成条件进行优化(表2)。
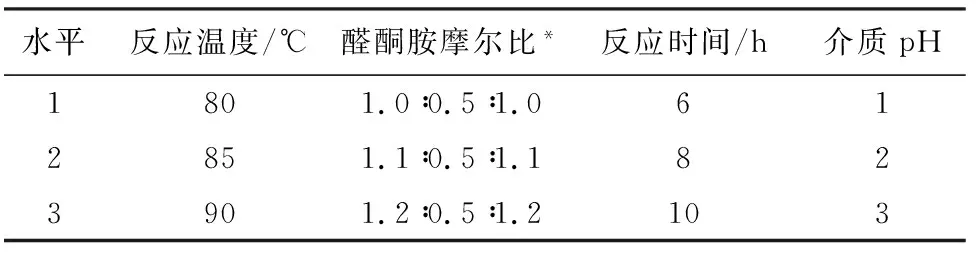
表1 因素水平表
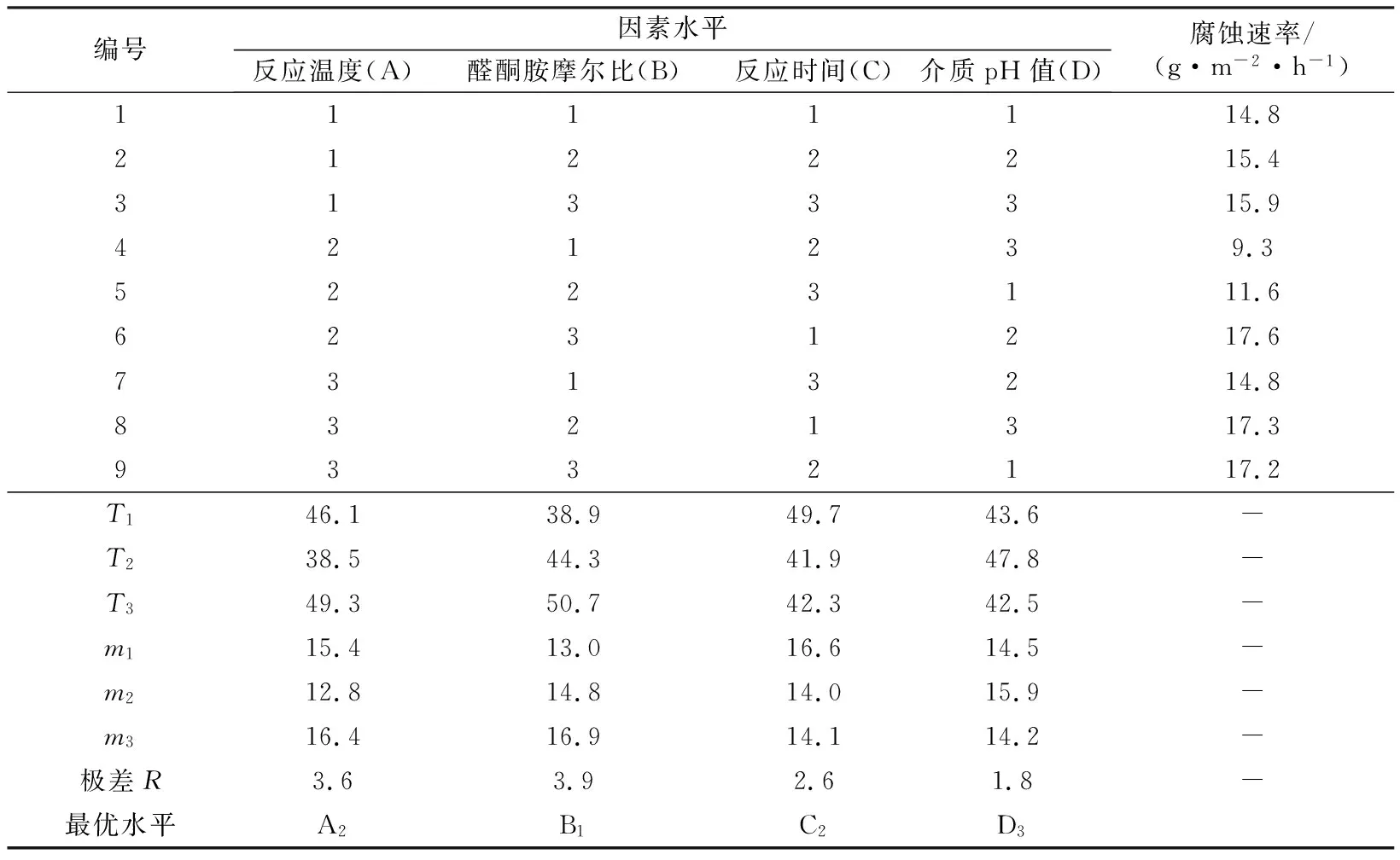
表2 MM-1制备工艺优化结果
由表2可知,制备酸化缓蚀剂的最佳条件:反应温度为85 ℃,醛酮胺摩尔配比为1.0∶0.5∶1.0,最佳制备工艺条件下的缓蚀剂,反应时间为8 h,介质pH=3。在此最佳工艺条件下制备的酸化缓蚀剂于90 ℃、15%的盐酸、4 h、投加量为1%的腐蚀速率为9.1 g/(m2·h)。
2.2 MM-1的分子结构表征
提纯后的MM-1的红外谱如图1所示。
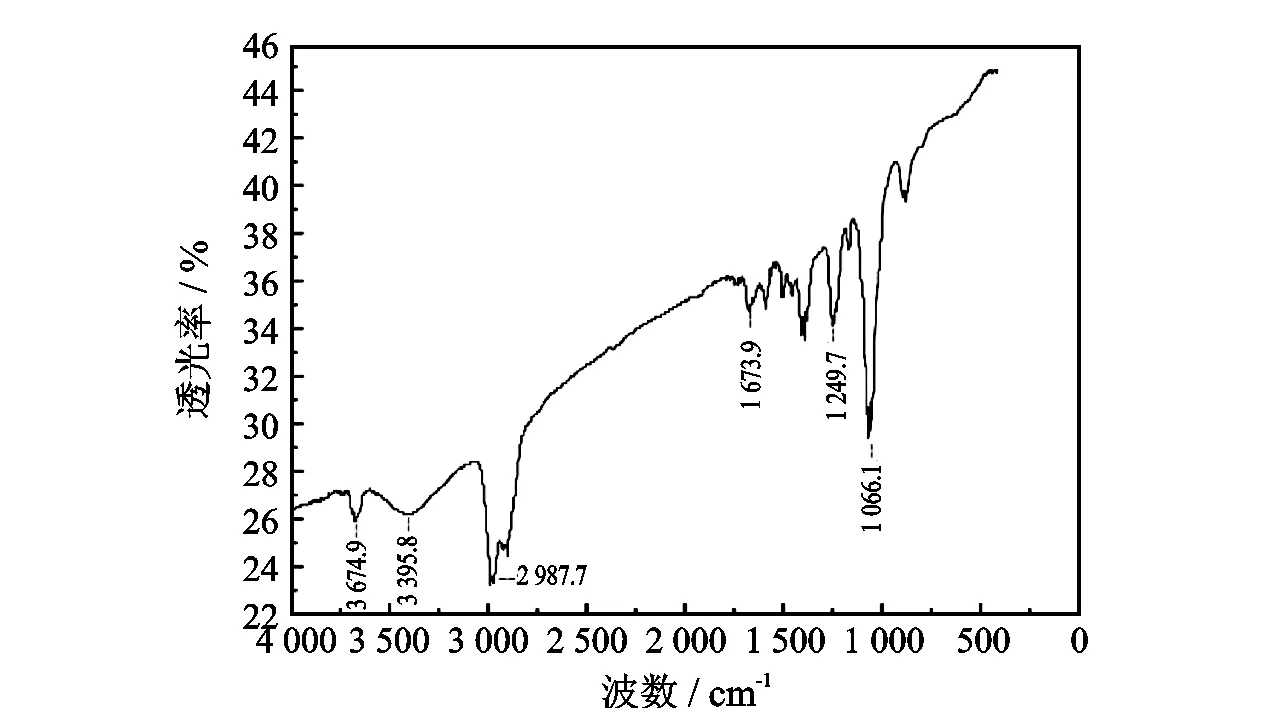
图1 MM-1的红外表征
由图1可以得出,3 395.8 cm-1是—NH伸缩振动吸收,表明醛酮胺缩合反应已经发生;在3 000 cm-1附近有较强吸收峰,峰较宽,出现肩峰的情况。此处可能为多个饱和烃基—CH2—的C—H的伸缩振动与苯环的C—H伸缩振动吸收峰叠加的结果;1 673.9 cm-1处为—C=O振动峰,说明4,4′-二乙酰基二苯醚分子中的活泼氢原子被氨甲基化;约1 500 cm-1处的吸收峰,可能为与N相连的—CH2—的C—H的弯曲振动吸收峰;1 406 cm-1处的吸收峰为羰基相连的—CH2—的吸收峰,其特征峰由原来的1 465 cm-1处移向低频率处;1 030~1 203 cm-1为C—N伸缩谱带,说明发生了氨甲基反应;1 249.7 cm-1与1 066.1 cm-1处分别为 C—O—C的非对称与对称伸缩振动吸收。综上所述,产物分子结构谱图中出现的谱峰与缓蚀剂的分子结构相对应。
1H-NMR(300 MHz,DMSO-d6)的测试结果如下:δ4.81(s,2H,OH),δ3.7(s,2H,CH2),δ7.14(m,4H,ArH),δ7.90(m,4H,ArH),δ3.10(t,4H,CH2),δ2.74(t,8H,CH2),δ3.48(t,4H,CH2)。其中δ介于(7~8)×10-6出现了2组苯环上H的特征峰,δ介于(2.7~3.5)×10-6出现了2组不同环境的—CH2—中的H的特征峰,谱图中杂峰较少,说明产物纯度较高。结合红外谱图和1H-NMR,可以推测提纯后的物质为MM-1。
2.3 缓蚀剂配方研究结果
通过单因素筛选实验确定了主剂、分散剂和增效剂比例的大致范围,设计4因素3水平的正交表L9(34)对缓蚀剂配方进行优化,实验结果见表3。
由表3可知,缓蚀剂主剂的加量对缓蚀效果影响最大。主剂的抗腐蚀效果优于以甲醛、环己酮和二乙烯三胺为原料制备的双曼尼希碱酸化缓蚀剂[6]。BAA与OP-10对其抗腐蚀结果影响次之,炔醇A加量对钢片抗腐蚀作用影响最小。正交实验中最佳水平组合条件为20%MM-1缓蚀剂主剂,7%BAA,3%OP-10,8%炔醇A。9次实验中最优水平为 A3B2C1D3,加入8号缓蚀剂后碳钢腐蚀速率小于实验中的其他组,仅为6.4 g/(m2·h)。配制的 MM-1复合缓蚀剂具有良好的抗腐蚀效果,完全达到行业要求二级标准,因此,选取8号实验配方作为最优缓蚀剂复配方案。
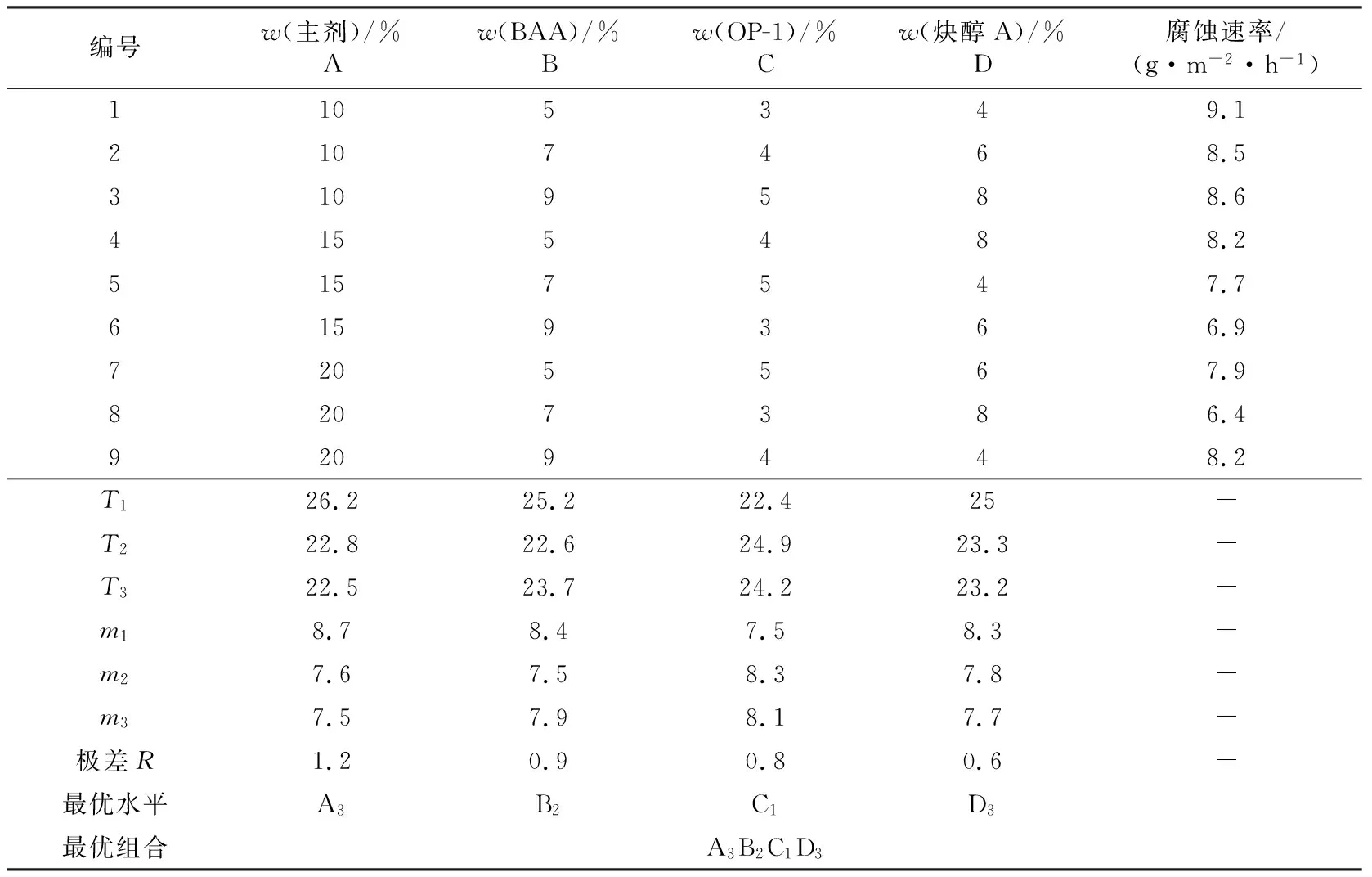
表3 产品MM-1复配结果
2.4 作用机理研究
2.4.1 极化曲线测试
电化学测试采用 CS350 电化学工作站,参比电极为饱和甘汞电极(SCE),辅助电极为铂片电极,工作电极为将N80 钢片工作电极嵌入聚四氟乙烯(PTFE)套筒中制成,以上三者组成传统的三电极体系。在一定温度下将三电极(工作电极在无水乙醇和丙酮溶液中用脱脂棉擦洗,置于滤纸上擦干待用)放置于装有15%盐酸的三口瓶中,再将三电极与电化学分析仪连接,待开路电位稳定后进行极化曲线测试。在添加量分别为0%(a)、0.3%(b)、0.5%(c)、0.7%(d)、1.0%(e)、1.3%(f)条件下测定酸化缓蚀剂主剂MM-1极化曲线,结果如图2所示。
依据极化曲线数据,应用软件对其进行拟合。在极化曲线的阴阳极Tafel区间各选取线性段做切线,求得自腐蚀电位、自腐蚀电流密度对数,经拟合计算后得到的极化曲线参数见表4。
由图2和表4可知,对比空白极化曲线,加入MM-1缓蚀剂后的极化曲线整体左移,腐蚀电流密度皆减小,阴、阳极Tafel曲线斜率明显增大,自腐蚀电位相对空白腐蚀电位下移,ΔE>0,由此可知MM-1缓蚀剂属于抑制阳极的混合型缓蚀剂。
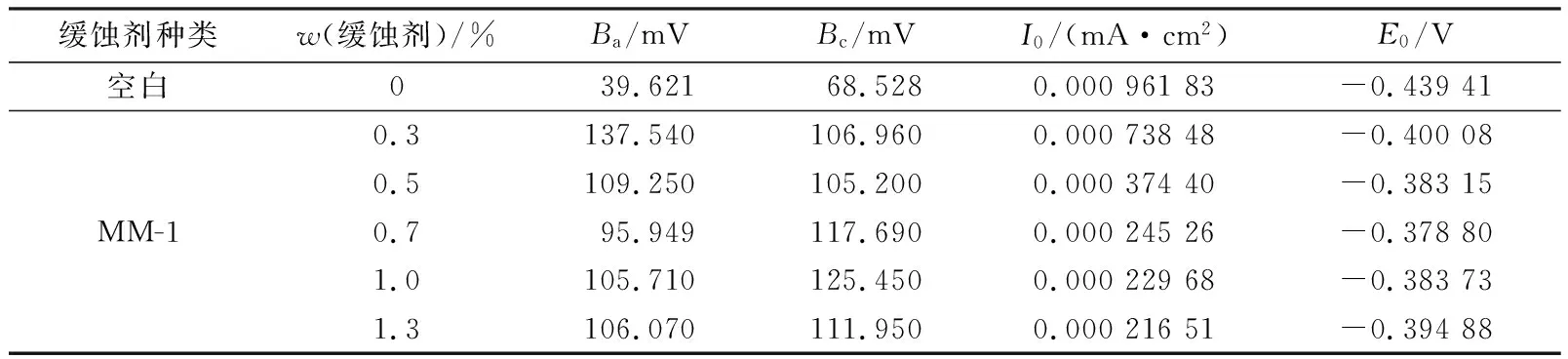
表4 缓蚀剂MM-1极化曲线相关参数
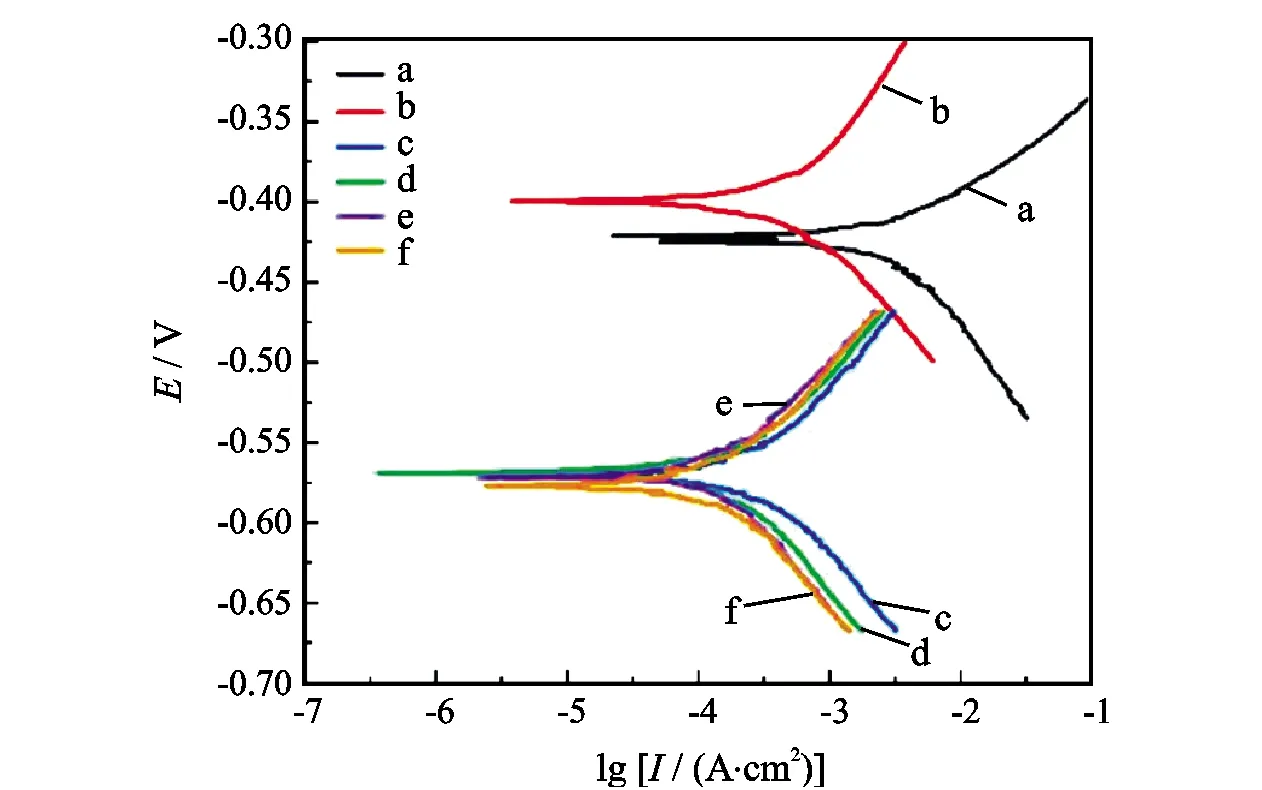
图2 MM-1缓蚀主剂极化曲线
2.4.2 交流阻抗测试
采用CS310型电化学工作站测试酸化缓蚀剂主剂MM-1,3种电极体系由饱和甘汞电极(SCE)、铂片电极和N80 钢片电极依次组成。腐蚀介质为15%的盐酸。测试N80钢片在未加缓蚀剂和加入不同浓度缓蚀剂后的电化学参数和交流阻抗图谱。采用对数扫频,用Zview 软件解析阻抗谱图。
缓蚀剂质量分数依次为0%、0.3%、0.5%、0.7%、1.0%、1.3%,测试结果如图3所示。其等效电路图如图4所示。缓蚀剂MM-1交流阻抗图谱相关参数见表5。
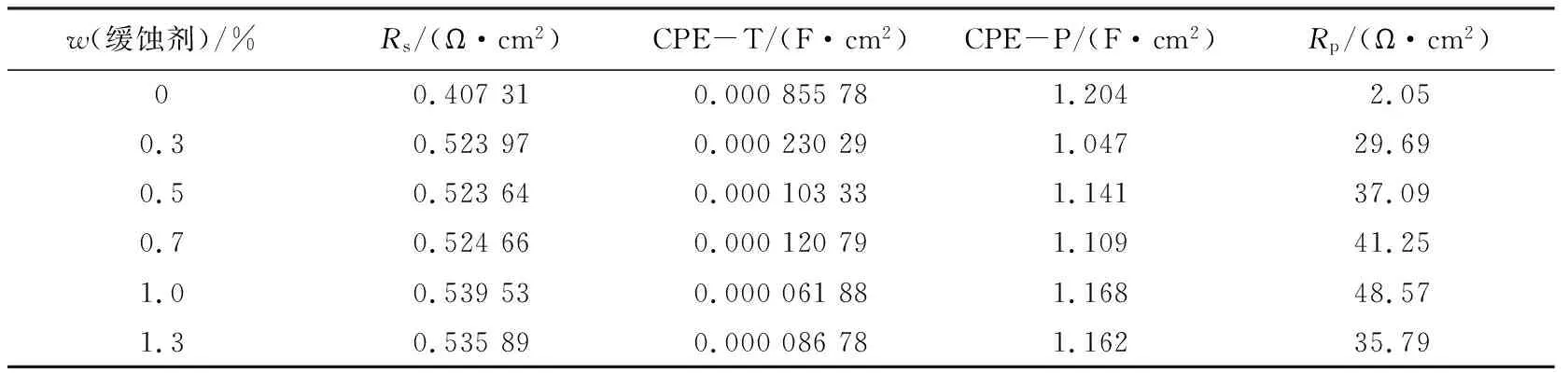
表5 缓蚀剂MM-1交流阻抗图谱相关参数
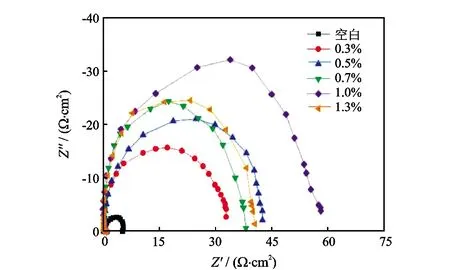
图3 MM-1主剂不同加量下的交流阻抗图谱
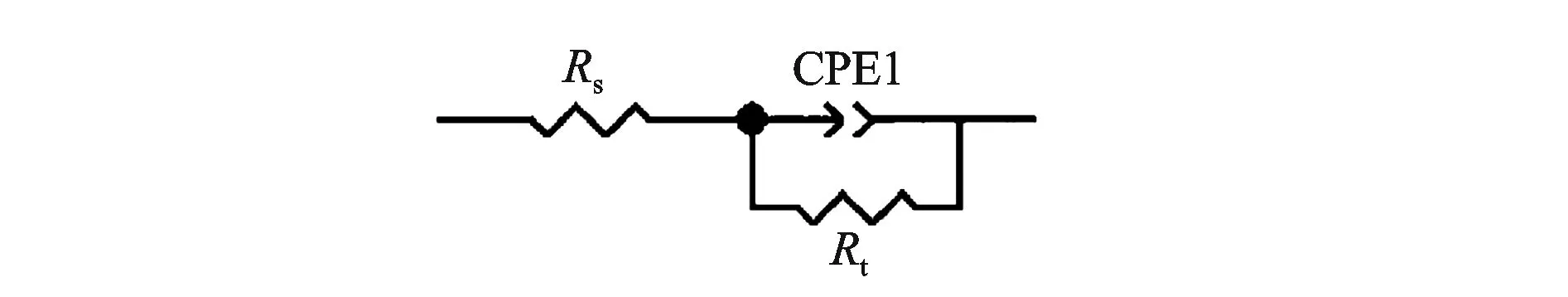
图4 等效电路
从图3可知,单一时间常数的半圆容抗弧是阻抗谱图的最大特征之一。相较于空白试验,随着缓蚀剂浓度不断增大,交流阻抗谱半圆容抗弧直径(即极化电阻)增大,说明腐蚀速率减小,钢片腐蚀得以减缓。缓蚀剂溶液中的容抗弧在高频端与实轴都基本交于一点,说明加入双曼尼希碱后不会改变溶液的性质。当继续增大缓蚀剂浓度时,容抗弧直径却有所减小,表明在酸液体系中,双曼尼希碱的抗腐蚀作用存在浓度极值现象。电极表面形成的饱和吸附膜会发生脱附过程,使得电极无法形成均匀的保护膜,缓蚀率有所降低。但当缓蚀剂质量分数达Rs为溶液中电阻;Rp为体系极化电阻。
2.4.3 缓蚀剂吸附热力学研究
分别在50、60、70、80、90 ℃进行静态失重实验。在复合缓蚀剂质量分数分别为0.5%、1.0%、1.5%、2.0%、2.5%时,测定N80钢片的腐蚀速率及缓蚀性能。将依次测得的缓蚀率及对应的缓蚀剂浓度代入吸附等温式,发现双曼尼希碱复合缓蚀剂在N80钢表面吸附服从Langmuir吸附等温式
(1)
式中:c为缓蚀剂质量分数,%;θ为表面覆盖率,%;Kads为吸附平衡常数。其中:
(2)
式中:Kads为吸附平衡常数,L/mol;55.5为水分子浓度,mol/L;ΔG为吸附自由能,kJ/mol;R为气体摩尔常数,J/(mol·K);T为绝对温度,K。
图5为MM-1双曼尼希碱在温度323.15Kads时的Langmuir吸附等温线。
由图5得出线性关系式,通过其截距可计算出双曼尼希碱在15%盐酸介质中的吸附平衡常数Kads=1.0×106L/mol,表明双曼尼希碱分子可很牢固地吸附在N80钢表面。吸附分子与金属表面相互作用的吸附自由能可按照式(2)进行计算。
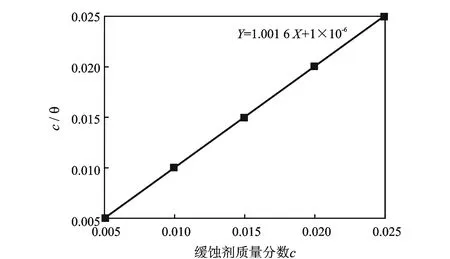
图5 MM-1双曼尼希碱在温度323.15 K时的Langmuir吸附等温线
表6为不同温度下,酸化缓蚀剂MM-1在金属表面的吸附平衡常数与吸附自由能计算值。
由表6可知,在不同温度下得到的线性关系式的斜率均大于1.0,所得相关系数R2=1,表明所制备的这种双曼尼希碱缓蚀剂的吸附行为服从Langmuir吸附等温式,在N80钢表面可吸附形成致密的单分子吸附层。计算可得双曼尼希碱在N80钢表面的吸附自由能ΔG在-35~-50 kJ/mol之间,表明在实验条件下自制的这种双曼尼希碱缓蚀剂在N80钢表面的吸附过程为自发过程;其吸附类型为化学吸附,缓蚀剂分子与金属通过化学键吸附[8-9]。
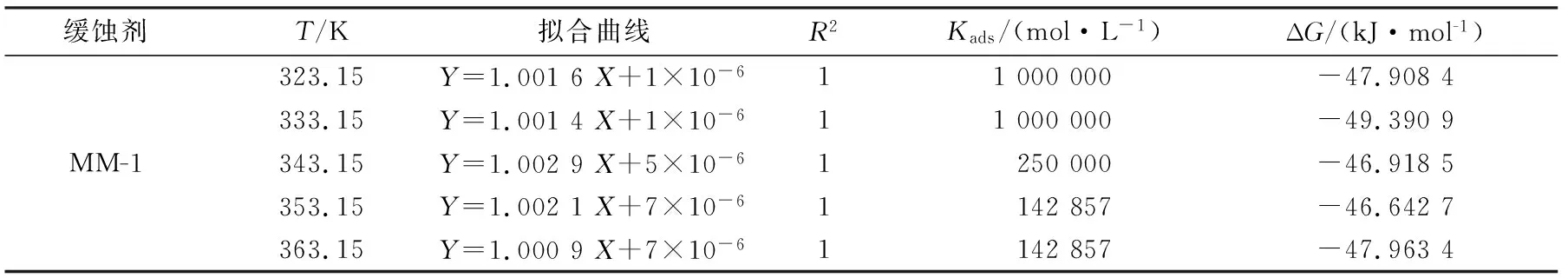
表6 线性拟合数据
2.4.4 扫描电镜分析
本文对N80钢片在不同缓蚀剂浓度下进行扫描电镜(SEM)分析:(a)为原始N80钢片,(b)为空白酸液(未加缓蚀剂)中腐蚀过的N80钢片,(c)为在酸液中加1%MM-1缓蚀剂主剂后的N80钢片,(d)为在酸液中加1%MM-1复合缓蚀剂主剂后的N80钢片。对以上所用N80钢片使用蒸馏水清洗干净,然后冷风吹干对N80钢片表面放大200倍进行扫描电镜(SEM)分析,如图6所示。
从图6可以看出,原始钢片由于受到砂纸打磨加工的影响而出现规则的划痕区域;由图6(b)可知,在同等盐酸腐蚀环境条件下,整体试片表面存在腐蚀严重的坑蚀现象,金属基体遭到严重破坏。

图6 缓蚀剂加入前后的N80挂片SEM形貌
加入缓蚀剂产品后,由于缓蚀剂分子吸附在N80钢表面的活性位点,形成有效的屏蔽保护膜,阻碍腐蚀介质向金属表面迁移[10]。图6(c)为加入MM-1缓蚀剂主剂后基体表面,或多或少出现轻微的腐蚀现象,但仍能明显观察到缓蚀剂分子残留附着在钢片表面。与空白样相比,腐蚀速率还是大大减缓,这与前文中利用静态失重法所测得的腐蚀速率数据规律相吻合。
在酸液中加入复配后的复合缓蚀剂,图6(d)所显示出的钢片基本都未见明显的腐蚀纹路。表明复合缓蚀剂在钢片表面生成完整的保护膜,提供了强有力保护。由于钢片未得到彻底完全的蒸馏水冲洗,少部分缓蚀剂分子残留在钢片表面,因而显现出点(条)斑黑影。与未加入缓蚀剂的空白样试片(图6(b))相比,无论是加入主剂产品还是复配缓蚀剂,钢片表面都光滑很多,整体上呈现出的吸附膜紧密从而抑制了金属腐蚀,这说明所制备的酸化缓蚀剂均具有良好的抗腐蚀效果[11]。炔醇A与BAA可在金属表面发生化学吸附,弥补主剂在金属表面吸附存在的空隙。曼尼希碱主剂与增效剂BAA的协同作用与文献[5]相一致。炔醇分子具有不饱和三键,其π电子易与金属表面形成π-d化学键而吸附在电极表面;随着丙炔醇浓度的升高,缓蚀作用由吸附反应变为以聚合反应为主[12]。
2.4.5 电子能谱分析
电子能谱是分析物体表面元素含量的一种方法,通过测定N80钢片表面腐蚀情况,分析钢片表面腐蚀程度,判定缓蚀剂的抗腐蚀效果。将不同的腐蚀作用下的N80钢片进行了X射线能谱分析(图7)。测试条件:温度90 ℃,挂片4 h。
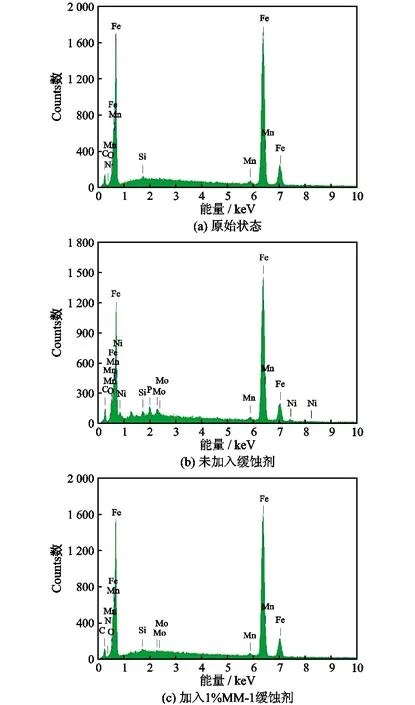
图7 缓蚀剂加入前后的N80挂片EDS图谱
试片N80表面元素含量测试结果见表7。
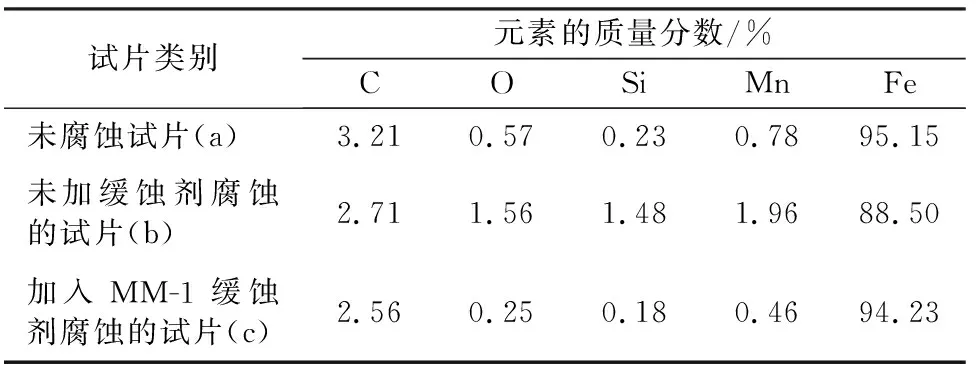
表7 试片N80表面元素含量测试结果
由表7可知,空白钢片(b)的铁元素含量88.50%与原始钢片(a)铁元素含量95.15%相比大幅降低。这是因为空白钢片中铁元素被盐酸大量溶解,以铁离子的形式进入腐蚀介质中。加入缓蚀剂主剂后钢片(c)铁元素含量与原始钢片的铁元素含量相比,变化幅度较小,说明加入的缓蚀剂主剂能有效减缓钢片腐蚀程度,达到抗腐蚀目的。试片(c)与空白样(b)相比较,产品在N80钢片表面形成以碳、氧元素为主的吸附,氧元素含量下降明显,碳元素含量略有下降。故扫描结果中碳、氧含量不同程度下降,与原始N80钢片相比,铁元素含量略有降低。
2.4.6 双曼尼希碱缓蚀作用机理探讨
本文使用的曼尼希碱缓蚀剂分子是由不饱和芳酮及甲醛为原料合成的。其抗腐蚀机理可以通过吸附理论来解释。缓蚀剂分子由以负电性O、N 等原子为中心的极性基团和以 C、H为中心的非极性基团组成。分子中的非极性基团远离金属表面作定向排列,使得溶液中的氢离子向金属腐蚀的反应过程迁移减缓。从而在酸液与金属间形成一道屏障,阻止了腐蚀产物铁离子向溶液中扩散[13]。保护金属免受酸液的腐蚀,达到了金属抗腐蚀的目的[14]。
酸化缓蚀剂MM-1的极性基团吸附在钢片表面,环上的大π键以化学吸附的形式吸附在金属表面,形成致密的吸附层。加入BAA与炔醇A后,它们可填充在酸化缓蚀剂MM-1在金属表面吸附膜的空隙,使得在表面的吸附层更加致密。这是由于BAA缓蚀剂分子不仅含有大苯环结构,而且还具有孤对电子对的氧原子和碳碳双键的缘故。另外,炔醇由于分子体积小,更能填充吸附层中的空隙。在曼尼希碱分子作用的基础上,BAA分子中的羰基基团同样与金属表面的空d轨道形成配位键而被吸附,达到进一步阻碍氢离子腐蚀金属表面的目的。
3 结 论
(1)确定了MM-1缓蚀剂主剂最佳合成工艺:n(醛)∶n(酮)∶n(乙醇胺)=1.0∶0.5∶1.0;最佳反应温度为85 ℃;最佳pH=3;最佳反应时间为8 h。最佳工艺条件下制备酸化缓蚀剂的腐蚀速率为9.1 g/(m2·h);通过正交实验得到主剂MM-1的最优复配配方:20%MM-1缓蚀剂主剂,7%BAA,3%OP-10,8%炔醇A。该配方使钢片腐蚀速率降至 6.4 g/(m2·h)。
(2)MM-1缓蚀剂属于抑制阳极为主的混合型缓蚀剂;吸附热力学的研究表明双曼尼希碱缓蚀剂在N80钢表面吸附均符合Langmuir吸附等温式,吸附类型为化学吸附;通过扫描电镜和电子能谱分析发现大量缓蚀剂分子可吸附在N80钢片表面,起到保护金属免受腐蚀的作用。

