牦牛乳酪蛋白酶解产物抗氧化活性研究
李佳逸,阳辉蓉,陈炼红
(西南民族大学食品科学与技术学院,四川 成都 610041)
牦牛被誉为“高原之舟”,牦牛乳易被人体消化吸收,营养丰富,具有高蛋白、高乳脂率的特点。牦牛乳中蛋白质含量比荷斯坦牛乳高约2倍,氨基酸含量较普通荷斯坦牛乳高出近15%[1]。目前,国内关于牦牛乳及乳中成分抗氧化性的研究也日渐深入。杨静等[2]研究表明,牦牛乳硬质干酪中的抗氧化因子较荷斯坦牛乳硬质干酪高,使干酪在成熟后期的氧化速率变慢。宋雪梅等[3]研究发现,在不同温度和时间下成熟的牦牛干酪制备的水溶性肽均具有抗氧化、杀菌和降压的作用。
酪蛋白是乳蛋白中的主要蛋白质,约占乳蛋白含量的80%以上,营养价值高,功能性强,其独特的氨基酸序列具有很高的研究价值,因此被广泛应用于食药医疗领域[4]。酪蛋白可以通过不同的酶解产生不同的生物活性肽,如抑菌肽[5]、抗氧化肽[6]、血管紧张素转换酶抑制肽[7]。其中抗氧化肽能够清除体内过多的自由基,抑制脂肪氧合酶活性,分解氧化物,增强人体的抗衰老和抗病能力[8-9]。
为进一步研究牦牛乳酪蛋白酶解液在体内及体外的抗氧化性,根据实验室前期研究的最佳酶解工艺条件,采用复合酶解(中性蛋白酶∶胰蛋白酶=1∶2)制备牦牛乳酪蛋白酶解液,以1,1-二苯-2-苦肼基自由基(DPPH·)、超氧阴离子自由基(O2·)、羟自由基(·OH)清除率及还原力为体外抗氧化活性测定指标,并设置小鼠试验对酶解液在体内的抗氧化活性进行研究,测定小鼠血液中超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)活力,旨在为抗氧化功能性产品的研发奠定基础,开发出更天然、更安全的抗氧化产品。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
牦牛乳采自四川省阿坝藏族羌族自治州红原牧区,现场将样品装入灭菌的采样瓶中,置于保温盒内当日带回实验室,于4℃条件下冷藏待用;五周龄SPF级昆明系小鼠:体重(25±2)g,生产许可证号为SZXK(川)2020-030,购于四川达硕公司;试验用鼠普通维持饲料,购于江苏省协同医药生物工程有限责任公司。
中性蛋白酶(最适反应pH为7.0,温度为55℃,蛋白酶活力60 000 U/g)、胰蛋白酶(最适反应pH为8.0,温度为50℃,蛋白酶活力250 U/mg)、水杨酸、无水乙醇、硫酸亚铁、过氧化氢、Tris、冰乙酸等,成都瑞普信生物技术有限公司;1,1-二苯基-2-苦肼基(DPPH),美国Sigma公司;谷胱甘肽过氧化物酶(GSH-PX)测试盒、总超氧化物歧化酶(SOD)测试盒、丙二醛(MDA)测试盒,南京建成生物工程研究所。
1.1.2 仪器与设备
HC-2062型高速离心机,安徽中科中佳科学仪器有限公司;PL303型分析天平,梅特勒托利多仪器有限公司;UV-2100型分光光度计,尤尼柯仪器有限公司;PHS-3C型pH计,上海雷磁仪器厂;DZG-303A型纯水仪,成都唐氏康宁艾柯科技有限公司。
1.2 方法
1.2.1 牦牛乳酪蛋白酶解液的制备
参考本实验室马宇骥等[10]的工艺制备牦牛乳酪蛋白酶解液。
取鲜牦牛乳,经离心脱脂后加入一定量的去离子水,配制成蛋白浓度为50 mg/mL的溶液。调节pH至7.5,42.5℃水浴锅中预热10 min,加入3%复合蛋白酶(中性蛋白酶∶胰蛋白酶=1∶2),酶解150 min,酶解过程中每隔20 min用1 mol/L NaOH调节1次pH值,酶解结束后将pH值调至7.0,并在沸水浴中灭酶10 min,冷却至室温,6 000 r/min离心取上清液,冷冻干燥后置于4℃冰箱中备用。
1.2.2 体外抗氧化活性研究
取牦牛乳酪蛋白酶解液冻干粉,分别用蒸馏水配制浓度为0、5、10、15、20、25、30、35、40、45、50 mg/mL的蛋白溶液,测定其DPPH·、O2·、·OH清除率及还原力。
1.2.2.1 DPPH·自由基清除率测定
参照You等[11]的方法测定。配制0.1 mmol/L DPPH乙醇溶液,加入2.5 mL样品和2.0 mL DPPH溶液,充分摇匀,用锡纸包裹避光反应30 min,待反应完毕后10 000 r/min离心15 min,以2.0 mL样品加入2.0 mL无水乙醇为对照组,2.0 mL无水乙醇加入等量DPPH溶液为空白组,在517 nm处测定吸光度。同时以同浓度VC溶液代替样品为阳性对照。
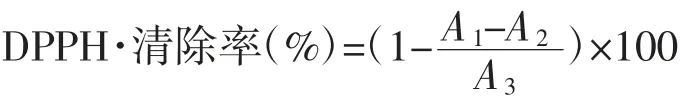
式中:A1为样品组吸光度;A2为对照组吸光度;A3为空白组吸光度。
参照刘静等[12]的方法测定。将邻苯三酚和样液在25℃条件下水浴15 min,依次加入2.8 mL Tris-HCl、0.2 mL邻苯三酚和1 mL样品后迅速混匀,用蒸馏水代替样品溶液为对照组,在325 nm处测定吸光度,反应时间为5 min,每30 s测定1次,反应结束后加入0.1 mL蒸馏水和2.8 mL Tris-HCl缓冲液调零。横坐标设为时间,纵坐标为OD值,斜率即为邻苯三酚自氧化速率。同时以同浓度VC溶液代替样品作为阳性对照。
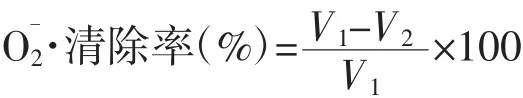
式中:V1为对照组邻苯三酚自氧化的速率;V2为样品组邻苯三酚氧化的速率。
1.2.2.3 ·OH清除率测定
参照董玉玮等[13]的方法稍作修改。依次加入2 mL 9 mmol/L水杨酸-乙醇、2 mL 9 mmol/L FeSO4、2 mL 8.8 mmol/L H2O2溶液和2 mL样品后充分摇匀,空白组样品取2 mL蒸馏水代替样品溶液,对照组加2 mL蒸馏水代替H2O2,37℃反应60 min,充分反应后于510 nm处测定吸光度。同时以同浓度VC溶液代替样品作为阳性对照。
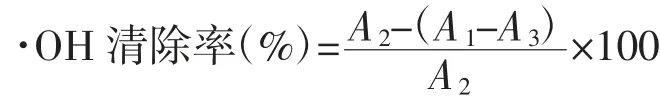
式中:A1为样品组吸光度值;A2为空白组吸光度值;A3为对照组吸光度值。
1.2.2.4 还原力测定
参照王颖颖等[14]的方法并略作修改。
精确量取2.5 mL样品,加入2.5 mL PBS缓冲液(0.2 mol/L,pH 6.6)和2.5 mL 1%铁氰化钾溶液后迅速混匀,50℃水浴保温30 min。反应结束后迅速冷却至室温,再加入2.5 mL 10%(m/V)三氯乙酸溶液,振荡混匀后以6 000 r/min离心50 min。吸取2.5 mL上清液,加入等量蒸馏水和0.5 mL 0.1%氯化铁,混匀后于25℃水浴保温10 min,在700 nm处测定OD值,以双蒸水为空白样。
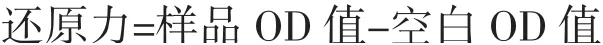
1.2.3 体内抗氧化活性研究
1.2.3.1 小鼠分组、饲喂及采样方法
SPF级昆明系小鼠40只,雌雄各半,预试3 d后进入正式期(排除小鼠因为运输造成应激反应影响试验结果),将小鼠随机分成4组,每组10只并进行编号(雌雄各半且分隔饲养),分笼饲养于环境温度22~26℃,相对湿度50%~60%的动物房中,每天光照12 h,自由进食进水,喂养普通维持饲料,每天更换饮水和垫料,分组情况见表1。

表1 小鼠灌胃分组Table 1 Mouse gavage grouping
每日上午9点对对照组和试验组小鼠经口灌胃0.25 mL蒸馏水和不同浓度酶解液[15],周期30 d,同时每组每日供应等量的颗粒饲料,自由进食进水。试验期间保持实验房温度为(24±2)℃,每日12 h灯光照明。
末次灌胃后禁食24 h,将小鼠称重并用乙醚麻醉后进行心脏采血,将血液置于1 mL EP管中,室温下静置30 min,于4℃下以3 000 r/min离心10 min,取上层血清,置于-80℃待检测。
取小鼠脾脏称重,计算脾脏指数。
脾脏指数=脏器质量(mg)/体重(g)
1.2.3.2 体内抗氧化分析
分别采用SOD、MDA、GSH-Px试剂盒进行检测,并按各说明书的公式进行计算。
1.2.4 数据处理
所有试验测定3次,结果取平均值,采用SPSS V22.0统计软件对试验数据进行统计分析。
2 结果与分析
2.1 牦牛乳酪蛋白酶解液体外抗氧化活性研究
2.1.1 酶解液对DPPH·清除能力的分析
如图1所示,蛋白浓度在0~30.0 mg/mL时,牦牛乳酪蛋白酶解液的DPPH·清除能力随着蛋白浓度的增加而显著升高,当浓度大于30.0 mg/mL后,DPPH·的清除能力虽仍继续增加,但不再显著提升。样品中的DPPH·清除率达到66.45%±1.59%时的蛋白浓度为50 mg/mL。VC的DPPH·清除率在浓度0~15.0 mg/mL时有显著提升,之后增长缓慢,浓度为50.0 mg/mL时,VC的DPPH·清除率达到89.02%±1.07%。结果表明,牦牛乳酪蛋白酶解液的DPPH·清除率始终低于VC,但仍具有一定强度的抗氧化活性,在蛋白浓度为50.0 mg/mL时,DPPH·的清除率达到同浓度VC的74.45%。
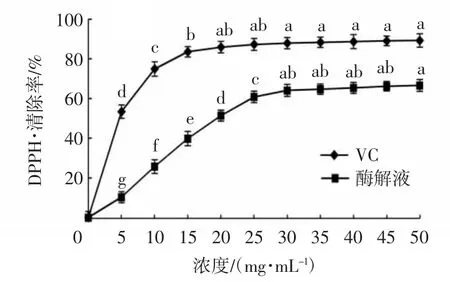
图1 不同浓度酶解液的DPPH·清除能力Fig.1 DPPH radical scavenging activity of enzymatic hydrolysates with different concentrations
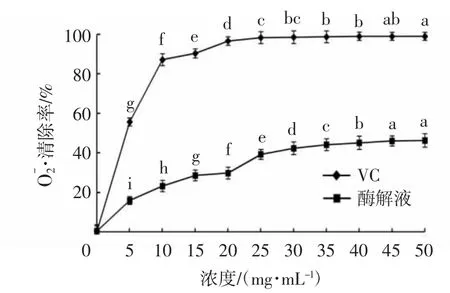
图2 不同浓度酶解液的O2·清除能力Fig.2 Superoxide radical scavenging activity of enzymatic hydrolysates with different concentrations
2.1.3 酶解液对·OH清除能力的分析
研究表明,·OH易与氨基酸、蛋白质和核酸等游离基团相结合,从而造成细胞损伤导致机体产生疾病甚至癌症等危害。由图3可以看出,牦牛乳酪蛋白的酶解液·OH清除能力在0~40.0 mg/mL时随着蛋白浓度的提高而显著增强,之后清除率基本保持不变。在蛋白浓度为5.0 mg/mL时,样品对·OH的清除率只有15.36%±0.68%,但当浓度升至50.0 mg/mL时,样品对·OH的清除率达到了60.40%±1.96%,是相同浓度下VC对·OH清除率的61.65%;样品与VC的·OH清除能力在浓度0~10.0 mg/mL时基本相同。但随着浓度的增加,酶解液的·OH清除能力增速低于VC,当浓度升至30.0 mg/mL时,VC对·OH清除率显著高于样品。
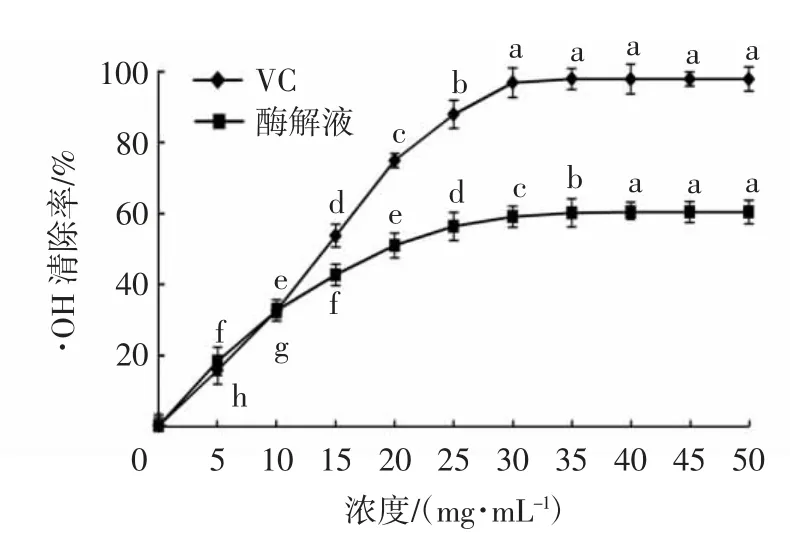
图3 不同浓度酶解液的·OH清除能力Fig.3 Hyroxyl radical scavenging activity of enzymatic hydrolysates with different concentrations
2.1.4 酶解液还原力分析
由图4可知,牦牛乳酪蛋白酶解液还原力整体随着蛋白浓度的增加而增强,但浓度在15.0~20.0 mg/mL时,蛋白浓度对牦牛乳酶解液的还原力影响并不显著。当浓度达到25.0 mg/mL后,继续增加浓度,VC的还原力不再显著增强。样品的还原力在蛋白浓度为50 mg/mL时是相同浓度下VC还原力的63.03%。随着浓度的增加,酶解液与VC的还原能力的差距逐渐缩小,但酶解液的还原力始终小于VC。
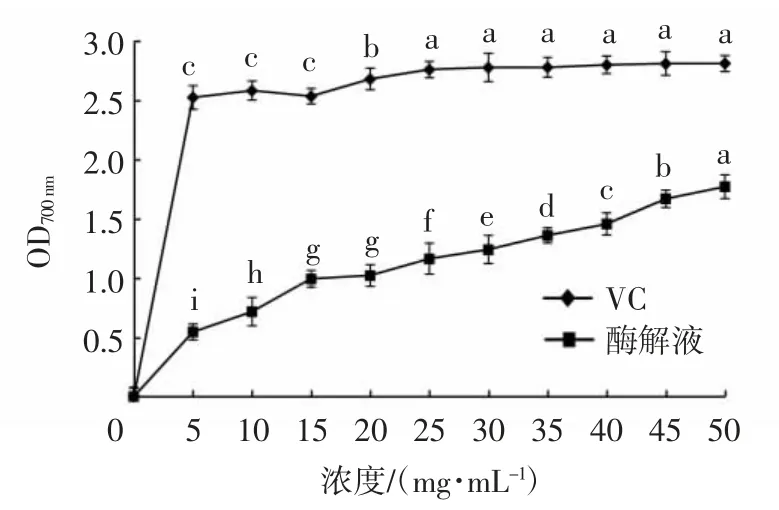
图4 不同浓度酶解液的还原力Fig.4 Reducing power of enzymatic hydrolysates with different concentrations
2.2 牦牛乳酪蛋白酶解液体内抗氧化活性研究
2.2.1 牦牛乳酪蛋白酶解液对小鼠体重及免疫功能的影响
由表2可见,饲喂30 d后,试验组小鼠体重均高于对照组。与对照组相比,低剂量组小鼠体重无显著变化,中剂量组和高剂量组的小鼠体重均显著增加(P<0.05),且高剂量组的体重增加最多。牦牛乳酪蛋白酶解液对小鼠脾脏指数的影响,与对照组相比,低、中和高剂量组均有显著增加(P<0.05),且中剂量组与高剂量组之间无显著性差异。
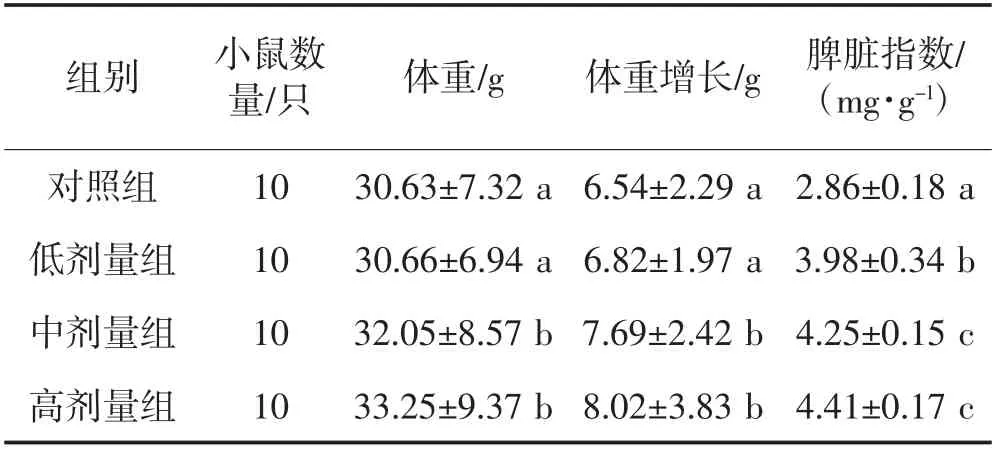
表2 牦牛乳酪蛋白酶解液对小鼠体重增重及脾脏指数的影响Table 2 Effect of yak casein hydrolysate on weight gain and spleen index of mice
酪蛋白酶解释放的酪蛋白活性肽可增加小鼠的钙吸收率及储留率。除此之外,酪蛋白水解物还含有小分子肽及各类游离氨基酸,小分子肽对动物的生长有促进作用[16],但具体成分及机制有待进一步的研究。在之前的研究中,郑华等[17]研究发现:用酪蛋白饲喂小鼠24 d后,小鼠体重显著高于对照组;饲喂36 d后,小鼠体重极显著高于对照组,与本试验结果一致,说明酪蛋白可促进小鼠的生长。
机体的非特异性免疫情况可由脾脏指数体现。有研究指出,免疫与抗氧化存在着相辅相成的关系[17]。在本试验中,脾脏指数与牦牛乳酪蛋白酶解液剂量成正比,表明牦牛乳酪蛋白酶解液可以促进小鼠的非特异性免疫。在陈东平等[18]的研究中发现,用不同分子量的酪蛋白肽饲喂小鼠30 d后,饲喂大于3 ku酪蛋白肽的分组,小鼠脾脏指数显著高于对照组,1~3 ku及小于1 ku的分组,小鼠脾脏指数极显著高于对照组,与本试验的结果基本一致,说明牦牛乳酪蛋白酶解液在30 d时可显著提高小鼠的脾脏指数,表明酶解液对小鼠具有显著抗氧化作用。
2.2.2 牦牛乳酪蛋白酶解液对小鼠血清中SOD活力的影响
如表3所示,饲喂牦牛乳酪蛋白酶解液30 d后,与对照组相比,低剂量组、中剂量组及高剂量组的小鼠血清对SOD活力影响均有显著提高(P<0.05),低、中、高剂量组的SOD活力分别提高约5.65%、12.34%和16.22%,且各组间差异显著(P<0.05)。
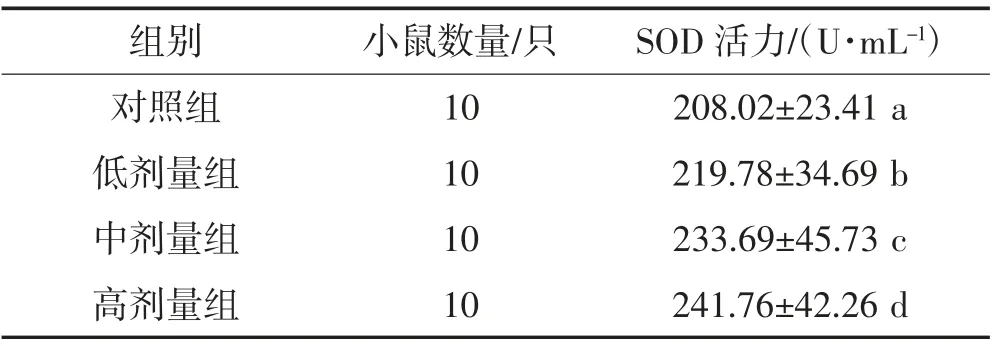
表3 牦牛乳酪蛋白酶解液对小鼠血清中SOD活力的影响Table 3 Effect of yak casein hydrolysate on SOD activity in serum of mice
研究证明:人体衰老、心脑血管等疾病均与人体内SOD活力的降低有关[19];同时,生物的致死率上升与机体内的SOD活性下降呈正相关[20-21]。Lee等[22]在研究鸭皮组织时发现,提高SOD活性可抑制抗氧化系统损伤,增强机体的抗氧化能力。在本试验中,用不同剂量的酪蛋白酶解液饲喂小鼠30 d后发现,试验组的小鼠血清中SOD活力明显高于对照组,且低、中、高剂量组的SOD活力呈梯度性变化,说明牦牛乳酪蛋白酶解液对小鼠SOD活力的提高有显著影响,进而提升小鼠的抗氧化能力。
2.2.3 牦牛乳酪蛋白酶解液对小鼠血清中MDA含量的影响
由表4可见,经30 d饲喂牦牛乳蛋白酶解液后,低、中、高剂量组小鼠血清中MDA含量与对照组之间差异显著(P<0.05),但试验组间差异不显著,低、中、高剂量组的MDA含量相较于对照组分别下降了约17.96%、19.39%和23.67%,呈逐渐下降的趋势。

表4 牦牛乳酪蛋白酶解液对小鼠血清中MDA含量的影响Table 4 Effect of yak casein hydrolysate on MDA content in serum of mice
机体通过酶系统与非酶系统产生氧自由基,非酶系统能攻击生物膜中的多不饱和脂肪酸,由此引发脂质过氧化作用,最终形成脂质的过氧化物(酮基、羰基、醛基等)。MDA作为其中主要的毒性产物,不仅可导致细胞内环境紊乱,致使细胞凋亡,而且也可改变DNA及RNA序列的转录翻译工作,使细胞环境失衡[23]。因此,MDA含量能间接地反映出细胞氧化损伤的程度,其与机体受损程度呈正相关。
本试验中,小鼠在饲喂酪蛋白酶解液30 d后,血清中的MDA含量明显下降,说明酪蛋白酶解液可有效减少机体内脂质过氧化物,降低细胞的损伤程度,提高机体的抗氧化作用。
2.2.4 牦牛乳酪蛋白酶解液对小鼠血清中GSH-Px活力的影响
由表5可以看出,低、中、高剂量组小鼠血清中GSH-Px活力均显著高于对照组(P<0.05),但试验组之间差异不显著。低、中、高剂量组的GSH-Px活力较对照组分别升高了约30.89%、37.72%和48.98%,呈逐渐上升的趋势。
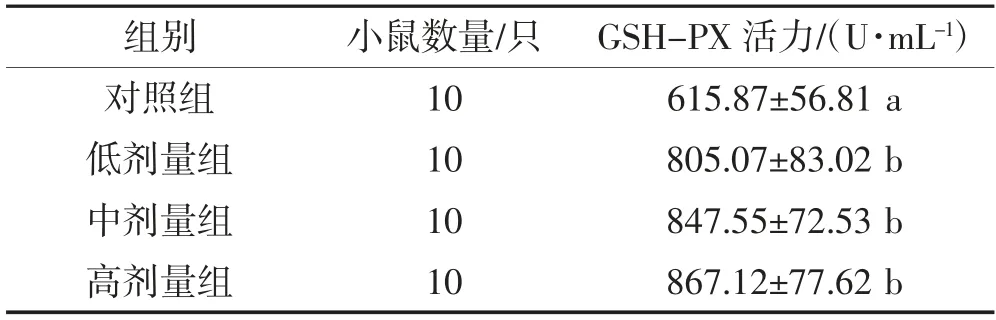
表5 牦牛乳酪蛋白酶解液对小鼠血清中GSH-Px活力的影响Table 5 Effect of yak casein hydrolysate on GSH-Px activity in serum of mice
GSH-Px能将还原性谷胱甘肽(Glutathione,GSH)催化为氧化型谷胱甘肽,是测定GSH活性水平的指标之一[24],其浓度可影响GSH对毒性物质的降解效果以及清除超氧阴离子自由基的效率,起到保护细胞膜结构和功能完整的作用。因此,测定GSH-Px活力可用来作为判别机体抗氧化性能的指标。本试验中可以看出,牦牛乳酪蛋白酶解液可以提高机体GSH-Px活力,从而提高机体的抗氧化能力。
3 结论
体外试验通过在最优酶解条件下制备牦牛乳酪蛋白酶解液,测定其抗氧化活性指标。结果表明:酶解液在蛋白浓度为50 mg/mL时对DPPH·、·OH、O2·均具有一定的清除能力,蛋白浓度在0~30.0 mg/mL时的DPPH·清除率和·OH清除率均随着浓度的增加而显著增强,二者在浓度为50.0 mg/mL时的清除率分别达到66.45%±1.59%和60.40%±1.96%,相当于相同浓度下VC对其清除率的74.45%和61.65%。还原能力除15.0~20.0 mg/mL外,整体均随着蛋白浓度的增加而显著增强,当浓度升至50.0 mg/mL时,还原力达到了1.775±0.004,是相同浓度下VC还原力的63.03%。在蛋白浓度为0~45.0 mg/mL时,牦牛乳酪蛋白酶解液对O2·的清除率随着蛋白浓度的增加而显著增强,浓度升至50.0 mg/mL时,酶解液的清除能力达到了46.02%±2.26%。
体内试验结果表明:经灌胃30 d后,试验组小鼠体重及脾脏指数均高于对照组;试验组小鼠血清中的SOD活力、MDA含量、GSH-Px活力与对照组之间差异均显著(P<0.05);试验组组间的SOD活力差异显著(P<0.05),MDA含量、GSH-Px活力差异不显著。以上数据表明,试验组小鼠较对照组而言,体重及脾脏指数均有增加,说明牦牛乳酪蛋白酶解液对小鼠的生长及非特异性免疫有促进作用;与对照组相比,试验组小鼠血清中SOD活力与GSH-Px活力均有提升,MDA含量有一定程度的下降。
本试验结果表明:牦牛乳酪蛋白酶解产物在体外和体内均表现出较好的抗氧化活性,为牦牛乳抗氧化功能产品的研究提供了理论依据,在天然抗氧化剂应用中具有广阔前景。

