海立啮齿杆菌OmpA的原核表达及免疫效果
邢 进 冯育芳 高 强 张雪青 赵德明 岳秉飞
(1.中国食品药品检定研究院 实验动物资源研究所(国家啮齿类实验动物资源库),北京 102629)(2.中国农业大学动物医学院,北京 100193)
海立啮齿杆菌(Rodentibacterheylii,Rh)和嗜肺啮齿杆菌(Rodentibacterpneumotropica, Rp)原为嗜肺巴斯德杆菌(Pasteurellapneumotropica,Pp)的Heyl和Jawetz生物型[1-2],是啮齿类实验动物中最常检出的条件致病菌,在我国SPF级啮齿类实验动物中必须排除[3]。Rh和Rp主要经由呼吸道侵袭动物,环境和种群中一旦发生感染非常难以清除。当环境或其他病原导致带菌动物抵抗力下降时,可能引发全身性感染,对动物实验及科研数据造成较大影响。
根据北京地区以往检测的统计结果,Pp是检出率最高的呼吸道病原菌,其中Rh的感染率超过90%,远高于Rp[10-11]。对Rh的控制是防控Pp的关键,有效抑制Rh的感染能够大幅度降低SPF级啮齿类实验动物的不符合率。Rh和Rp不仅是实验动物感染的重要病原,也常作为模式菌用于诸多研究[4]。但由于Rp的致病力更强[5],此前多以Rp研究Pp,如形态学[6]、毒力基因[7]、感染模型[8]、免疫学[9]等方面,对Rh的研究相对较少。
外膜蛋白A(OmpA)在大部分革兰阴性细菌中具有很好的免疫原性,通过免疫斑点实验和质谱测定已经发现OmpA是Rp最主要的免疫蛋白[12]。有研究[13]曾采用与Rp OmpA同源的流感嗜血杆菌(Haemophilusinfluenzae)P4、P6蛋白免疫小鼠,证实能够对小鼠产生保护作用,减少Pp感染[14]。本研究旨在对Rh的OmpA蛋白进行原核表达和纯化,制备重组表达蛋白。通过免疫-攻击实验,评价其对小鼠的保护效力。为减少Rh和Rp对实验啮齿类动物的污染,为阐明其感染机制提供参考。
1 材料和方法
1.1 材料
1.1.1实验动物:132只SPF级4~5周龄雄性ICR小鼠,由中国食品药品检定研究院实验动物资源研究所提供,实验动物生产许可证号【SCXK(京)2017-0005】,使用许可证号【SYXK(京)2017-0013】。通过动物福利伦理审查,伦理审批号:中检动(福)第2019(B)023号。所有受试动物经定量PCR(qPCR)和培养法检测,Rh和Rp阴性。
1.1.2菌株:海立啮齿杆菌小鼠分离株PP320,本实验室分离保存;海立啮齿杆菌ATCC12555和嗜肺啮齿杆菌ATCC35149(ATCC公司)。BL21(DE3)感受态细胞(生工生物有限公司),pET-32α载体由本实验室保存。
1.1.3小鼠血清样品:2019年40只小鼠检品,依据国家标准[15]检测为Pp阳性。检测时采集、分离的血清,由本实验室保存。
1.1.4主要试剂:哥伦比亚血琼脂培养基(Oxiod);无菌脱纤维羊血(北京路桥);LB液体和LB琼脂培养基(Difco);质粒大提试剂盒(Qiagen);限制性内切酶BamHI和XhoI(NEB);TritonX-100、T4 DNA连接酶、弗氏完全佐剂和弗氏不完全佐剂(Sigma);硫酸链霉素、氨苄青霉素、咪唑、12%Precast-GLgel Tris-Glycine电泳预制胶、非预染蛋白Marker IV、RealBand 蛋白预染 Marker、兔抗6×His多克隆抗体、HRP标记的羊抗兔IgG和考马斯亮蓝染色液(BBI);Pfu DNA 聚合酶、IPTG、蛋白浓度测定试剂盒、蛋白质加样缓冲液和W-TMB显色试剂盒(生工生物);尿素(北京宝如亿);无菌PBS(Gibco);琼脂糖(Invitrogen);Tris和SDS(Sigma);Glycine(Diamond);邻苯二胺(Solarbio);HRP标记羊抗小鼠IgG(KPL);Tween-20(BBL);其他化学试剂分析纯(国药集团)。
1.2 方法
1.2.1根据Genbank中Rodentibacter:heyliistrain Ppn222全基因组序列中的OmpA基因序列(NZ_MLAF01000014.1∶7149-8219)设计引物,引物由生工生物工程有限公司合成,序列见表1。

表1 蛋白表达所用引物
1.2.2PP320OmpA基因的扩增:OmpA扩增反应体系为10× Pfu 缓冲液 5 μL,dNTP(各25 mmol/L)1 μL,Rh-OmpA-F/R各2 μL,Pfu酶(5 U/μL)0.4 μL,PP320 DNA(20 ng/μL)1 μL,补水至50 μL。扩增条件为95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸5 min。
1.2.3Rh OmpA蛋白结构分析及密码子优化:以PP320基因组DNA为模板,扩增OmpA基因。经测序后,使用Vector NTI Advance 11(Life Technologies Corporation,USA)PP320与Ppn222序列比对,使用ORF finder(https://www.ncbi.nlm.nih.gov/orffinder)在线工具搜索PP320 OmpA的开放阅读框,使用DNAStar Lasergene 7.1软件(Bioinformatics,USA)中的Protean模块对两基因编码蛋白进行蛋白分析。使用在线密码优化工具(https://www.genscript.com/tools/rare-codon-analysis)对OmpA编码序列进行表达前的密码子优化,消除稀有密码子,调整GC含量,增加mRNA稳定性,调整mRNA二级结构稳定性,Motif分析。在载体pET-32a-c(+)两端分别加入酶切位点BamHI和XhoI。
1.2.4目的片断及载体连接:优化后的PP320 OmpA序列由上海生工进行人工合成,以人工合成的优化序列作为模板,用引物对Opt-OmpA-F/R扩增目的片断,扩增条件为95 ℃预变性3 min;95 ℃变性24 s,55 ℃退火20 s,72 ℃延伸40 s,22个循环;72 ℃延伸5 min。将OmpA目的片断胶回收纯化,经BamHI和XhoI双酶切后与载体pET-32a连接后转入Top10感受态细胞中,测序检测筛选出阳性克隆。
1.2.5蛋白诱导表达、纯化和检测:将重组表达质粒转化大肠杆菌BL21(DE3)感受态细胞中,IPTG诱导表达,参照参考文献[16]检测表达蛋白。使用HisTrap FF标记蛋白纯化柱/预装柱(GE)纯化目的蛋白,SDS-PAGE电泳检测蛋白分子质量及Western blot鉴定目的蛋白,最后用蛋白定量试剂盒测定纯化后的目的蛋白浓度。
1.2.6动物免疫和抗体消长曲线
1.2.6.1 腹腔肌肉注射:将表达纯化OmpA蛋白用无菌PBS分别稀释至200 μg/mL,分装1.5 mL离心管,-80 ℃保存备用;第一针将表达蛋白与弗氏完全佐剂等量混合乳化,腹腔注射SPF级ICR小鼠,每只0.4 mL,肌肉注射每只0.1 mL,共免疫25只。同时设5只注射PBS对照小鼠,另有20只小鼠作为空白对照,用于后续感染实验。第二针于首免后第20天,将弗氏不完全佐剂与表达蛋白等量混合,腹腔注射每只小鼠0.25 mL。于第二针免疫后第10天,取免疫后的小鼠(5只)和PBS对照小鼠(5只)采用安乐死,采血,分离血清。
1.2.6.2 滴鼻法:参照参考文献[13]的方法,每隔7 d对小鼠进行1次滴鼻免疫,共免疫4次。
取OmpA免疫组和对照组小鼠各5只,定期对采集的免疫前(0 d)和免疫后7、14、21和30 d的免疫血清从1∶20倍开始倍比稀释,用OmpA表达蛋白作为抗原的ELISA方法测定A492-A405的吸光度值,使用Microsoft Execl2010软件根据吸光度值的Log2值绘制抗体滴度消长曲线。
1.2.7半数致死量:将ATCC12555、ATCC35149和 PP320在血琼脂上的过夜新鲜培养物用无菌0.9%氯化钠溶液分别制成1×104、1×106、1×108和1×1010CFU/mL 4种浓度菌液。根据菌落总数测定国家标准[17],准确计算原始菌液浓度。
72只小鼠随机分为3组,每组24只,分别腹腔注射上述3种菌液;3种菌液组再各分为上述4个剂量组,注射剂量为每只0.5 mL。根据小鼠的死亡情况,使用改良寇氏法计算ATCC12555、ATCC35149和PP320的半数致死量(LD50)及标准误。根据LD50所需菌量,制备相应浓度的3种菌液,分别腹腔注射免疫小鼠和同日龄未免疫小鼠,每2 h观察动物状态至24 h。
1.2.8免疫效果实验:用分离株PP320的1×106CFU/mL浓度菌液,对OmpA免疫小鼠和未免疫对照小鼠各5只,用移液器吸取20 μL菌液滴鼻。饲养30 d后,采集咽拭子[18],用qPCR方法检测Rh拷贝数,扩增条件为50 ℃ 2 min;95 ℃ 10 min;95 ℃15 s,58 ℃ 1 min,共40个循环,引物和探针序列见表2。

表2 Rh 和Rp 的qPCR 引物和探针
1.2.9阳性血清样品中OmpA抗体的ELISA检测:参考实验动物酶联免疫吸附实验国家标准[19],将原核表达纯化后的OmpA蛋白用包被液稀释,浓度为1、3和5 μg/mL,分别包被聚苯乙烯酶标板,使用ELISA检测免疫小鼠血清,确定最佳包被浓度。选择最佳包被浓度,用建立的OmpA ELISA方法对40份Pp(Rh或Rp)阳性小鼠血清进行检测。
1.3 统计学方法
使用SPSS 19.0(IBM)对各实验组与对照组间的血清免疫抗体效价和抗体保护实验进行统计学分析,两两比较采用Student’st-检验。P<0.05表示差异有统计学意义。
2 结果
2.1 海立啮齿杆菌OmpA蛋白结构分析
在PP320的OmpA基因序列中,最大的开放阅读框位于1~1 071 bp,编码356个氨基酸,以此段蛋白作为目的蛋白,分子质量为37 553.36,等电点为9.01。OmpA二级结构和抗原表位分析见图1。

图1 PP320 OmpA蛋白二级结构和抗原表位分析
经Gamier-Robson和Chou-Fasman两种方法预测二级结构,此段氨基酸序列中α螺旋约占62.1%,β折叠占比约52.5%,β转角占比约27.8%,无规则卷曲约占9.6%。经Kyte-Doolittle和Hopp-Woods方法预测,OmpA的亲水性区域约占比66.0%,主要分布在20~29、36~64、88~130、136~160、180~256、248~256、278~299、314~338、343~356等大部分氨基酸残基。经Emini方法预测,表面可能性区域占比29.2%,主要集中在21~26、90~107、192~204和278~296等多个区域。Karplus-Schulz方法预测,柔韧性区域主要位于41~50、89~107、137~152等23个区域,占氨基酸序列的43.5%。经Jameson-Wolf方法及预测的OmpA蛋白的结构特性,综合得到潜在的B细胞优势抗原表位主要位于39~64、87~109、278~300等9个区域,共236个氨基酸,约占整个氨基酸序列的63.3%。综合AMPHI和Rothbard-Taylor两种方法预测,T细胞优势抗原表位占比较少,主要位于35~52、67~72等18个区域,共132个氨基酸,约占整个氨基酸序列的37.1%。
2.2 重组质粒的构建
表达载体pET-32a经BamHI和XhoI双酶切后,获得线性化载体。与OmpA目的片段经T4连接,重组质粒经BamHI和XhoI双酶切,见图2。用引物对T7/T7t扩增,经测序验证结果准确。
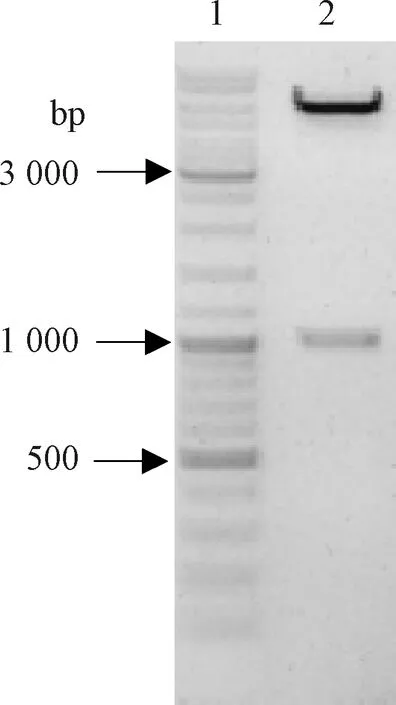
注:1.Marker SM0331;2.pET32a-OmpA重组质粒酶切片断
2.3 Western blot检测SDS-PAGE蛋白表达
SDS-PAGE电泳结果显示在相对分子质量53 000左右出现明显的目的条带,符合理论值,见图3。经镍离子亲和层析纯化,对SDS-PAGE凝胶进行转膜,TMB显色试剂盒显色,用Western blot方法对纯化蛋白进一步验证,见图4。确认所获得的蛋白为OmpA。

注:1.Protein Marker IV;2.诱导前总蛋白;3.20 ℃上清;4.20 ℃沉淀;5.37 ℃上清;6.37 ℃沉淀

注:1.Protein Marker;2.OmpA纯化融合蛋白
2.4 蛋白浓度测定结果
经蛋白定量试剂盒测定,待测体积20 μL时,表达蛋白在480 nm下的吸光度平均值为0.891 5。根据标准BSA测定值绘制出标准曲线方程为Y=-138.63X+127.03,可求得OmpA表达蛋白浓度为0.34 mg/mL,共收获17 mL。
2.5 蛋白免疫效价测定
取OmpA免疫组和对照组各5只小鼠,对免疫前(0 d)和免疫后7、14、21和30 d的血清做倍比稀释后,测定A492-A405的吸光度值,根据吸光度值的Log2绘制抗体滴度消长曲线,见图5。采用腹腔加肌肉免疫途径时,平均抗体滴度为19.84log2。
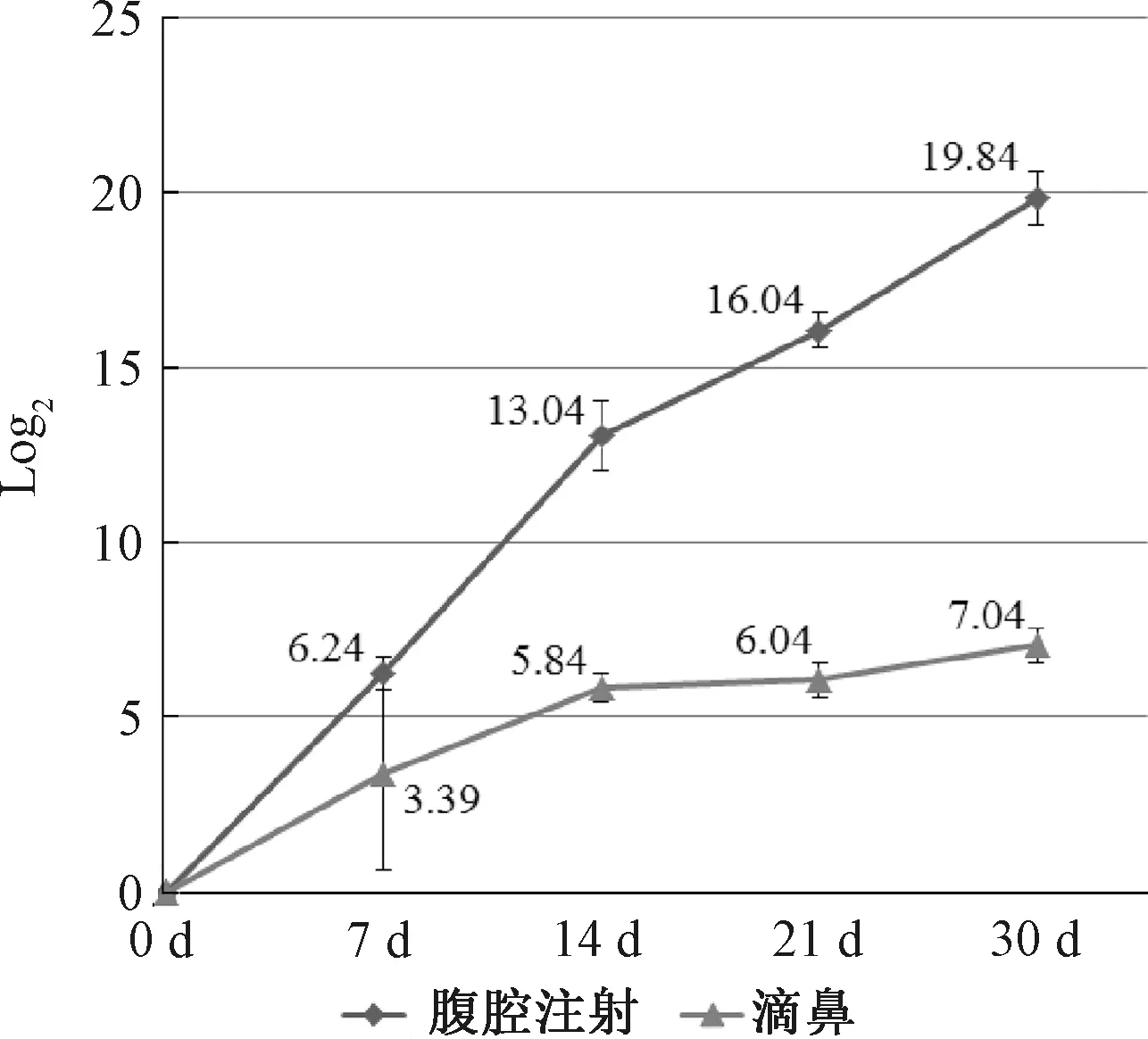
图5 抗体滴度消长曲线
2.6 嗜肺巴斯德杆菌阳性小鼠血清OmpA抗体检测
40份Pp(Rh或Rp)阳性小鼠血清经OmpA为抗原包被的ELISA方法检测,样品阳性判定标准为吸光度值0.317±0.104,阴性样品A值为0.069±0.078,阳性率为24/40(60%)。
2.7 LD50测定
用3种菌株的4个浓度菌液1×104、1×106、1×108和1×1010CFU/mL分别攻击小鼠,根据公式计算得出ATCC12555和PP320的LD50均为4.6×107CFU/mL,lgLD50的标准误为0.27;ATCC35149的LD50约为1×107CFU/mL,标准误为0。
2.8 免疫保护效果
2.8.1腹腔攻毒:根据LD50结果,配制1×109CFU/mL的 ATCC12555、ATCC35149和PP320三种菌液,分别对OmpA免疫和未免疫小鼠腹腔接种攻毒,致死率结果见表3。OmpA和对照组均差异显著(P<0.001)。攻毒后,未免疫小鼠表现为精神沉郁,被毛直立,卷卧。在4 h时开始出现死亡,濒死小鼠眼部红肿,呼吸急促,拉稀,肛门处沾有粪便,严重者表现为典型的侵肺症状,口鼻出血死亡。
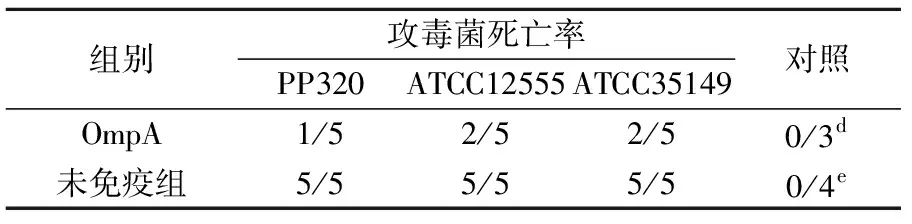
表3 免疫保护实验结果
2.8.2qPCR检测滴鼻感染:感染30 d后,取所有15只小鼠的咽拭子,用前述方法提取基因组DNA,并用qPCR方法检测,CT值结果见图6。未免疫组小鼠的Rh核酸拷贝数为1 128.82±625.08,OmpA免疫组小鼠中Rh核酸拷贝数为41.99±35.38,OmpA免疫组与未免疫组均差异显著(P<0.01)。

图6 滴鼻感染小鼠咽拭子qPCR检测结果
3 讨论
Rh的OmpA蛋白推导氨基酸序列具有良好的亲水性和B细胞抗原表位。对密码子优化后再通过大肠杆菌原核表达,首次获得了Rh的OmpA重组表达蛋白。采用肌肉/腹腔联合注射的途径免疫ICR小鼠,可获得高滴度OmpA特异性抗体。使用Rh ATCC12555、Rp ATCC35149和Rh分离株PP320三种菌液攻毒分别对免疫小鼠腹腔攻毒,小鼠的死亡率显著降低(P<0.001),免疫小鼠对Rh的保护力明显高于Rp。结果表明,Rh与Rp的OmpA存在差异,Rh的OmpA不能有效抵抗Rp的感染。
Fingas等表达了位于外膜蛋白中的CARLO-1蛋白,对30只确定感染Rp的小鼠血清检测结果为53%,与Rh阳性血清无交叉反应[12]。本研究利用OmpA表达蛋白作为包被抗原,用ELISA对已知Pp阳性小鼠血清检测,阳性率为60%,略高于Fingas所获结果。不同的是,本研究中所用阳性血清并不确定是Rh或Rp感染。已知不同品系的小鼠感染Rp后,所产生的免疫应答也随之不同[12],因此Rh的OmpA为抗原的ELISA方法是否能够覆盖Rp抗体尚有待进一步验证。实验动物血清是微生物检测中主要采集的动物样品之一,利用动物血清对Rh或Rp开展监测是非常可行的补充方式。检测过程中一旦发现存在可疑样品,可以追溯到相应动物,再采用分子生物学方法进行验证确诊,减少对动物的反复操作造成的影响。
OmpA是OMPs家族在呼吸系统中起黏附素和侵袭素的作用。呼吸道上皮通过检测病原体和激活引起抗菌和促炎分子释放的信号传导途径,在肺部防御中起关键作用。细菌对呼吸道上皮的黏附是引发呼吸系统疾病和激活宿主抗性机制的第一步。OmpA可以帮助细菌逃避宿主的防御,具有高度的免疫原性,可作为先天免疫系统的靶点,达到增强杀菌效果和清除细菌的目的[20]。有研究[9]证明,经PnxIII重组毒素鼻内免疫的小鼠鼻腔,在气管、结膜和盲肠未发现Rp定殖。表明在无佐剂的情况下,黏附蛋白经鼻内免疫可预防Rp感染。此外,小鼠鼻内接种免疫Rh和Rp的两种外膜蛋白后,能够减缓或减轻Rh或Rp感染引起的肺炎症状[13]。相反,本研究中OmpA的滴鼻免疫效果不佳,抗体滴度无法达到腹腔/肌注的效果。可能是在滴鼻过程中,部分抗原被小鼠舔舐,未能足量吸收所致。
在实验动物的饲养管理中,Rh和Rp是非常重要的微生物控制指标,直接关系到种群健康和动物实验。随着生物医药产业的迅速发展,模式动物和实验动物新品种不断涌现,有效的净化措施和防控手段是确保科研工作顺利开展的关键。本研究根据病原菌的实际流行情况,制备了Rh的OmpA重组蛋白,该蛋白可以作为疫苗对珍贵的动物品种进行免疫,避免相关疾病的突然暴发。并且该蛋白能够用于Rh感染的血清学检测,为此类病原的日常监测提供新的手段。

