橄榄油与油茶籽油氧化过程中主要微量伴随物的变化
李 琪,周 笙,,魏 冰,高 媛,于修烛*
1.西北农林科技大学 食品科学与工程学院,陕西省“四主体一联合”功能油脂工程技术校企联合研究中心,陕西 杨凌 712100 2.中粮工科(西安)国际工程有限公司,陕西 西安 710082
橄榄油作为地中海饮食的主要油脂倍受关注,而油茶籽油作为“东方橄榄油”在市场上方兴未艾。油酸、棕榈酸、亚油酸和硬脂酸是2种油脂共有的脂肪酸,其中油酸和亚油酸含量相当[1]。它们均含有丰富的微量伴随物,主要包括甾醇、角鲨烯、生育酚等。这些物质具有良好的抗氧化、抗炎及预防心血管疾病等多种功效[2-5]。油脂中微量伴随物的含量与油脂的品质变化密切相关,然而,油脂在加工和储存过程中,常因氧化造成损失,导致品质降低。
橄榄油中含有丰富的角鲨烯,其含量为1 100~8 390 mg/kg,是核桃油、玉米胚芽油、芝麻油等的10倍以上;油茶籽油中角鲨烯含量则远低于橄榄油,约为160 mg/kg[6]。橄榄油中含有多种甾醇,含量较高的是菜油甾醇、豆甾醇和β-谷甾醇,欧盟规定初榨橄榄油中甾醇含量不能少于1 000 mg/kg[7];油茶籽油中甾醇种类与橄榄油不同,主要为羊毛甾醇、羽扇豆醇、β-谷甾醇和香树脂醇等,其中羊毛甾醇含量为934~1 654 mg/kg,羽扇豆醇含量为339~782 mg/kg,β-谷甾醇含量为189~820 mg/kg,香树脂醇含量为360~913 mg/kg[8]。除含有香草酸、咖啡酸、阿魏酸、丁香酸、芹黄素、木樨草素、芸香苷等酚类物质外,橄榄油中还有一种特有酚类物质——羟基酪醇,其在抗炎、抗肿瘤、减少骨质疏松以及防治心血管相关疾病等方面具有良好的作用[9-12]。油茶籽油中含有原儿茶酸、儿茶素、4-羟基苯甲酸、绿原酸、香草酸、表儿茶素没食子酸酯和对香豆酸等多种酚类物质[13]。橄榄油与油茶籽油中的生育酚组成十分相似,主要为α-生育酚,同时含有少量的γ-生育酚和δ-生育酚。橄榄油中α-生育酚含量可高达300 mg/kg,油茶籽油中的生育酚含量240~270 mg/kg[8]。相关研究已经证明,氧化是导致油脂中微量伴随物损失的主要原因之一[14]。
由于氧气、光照、温度等条件的影响,橄榄油微量伴随物会在储存过程中发生不同程度的降解,如光照可明显降低其中生育酚和类胡萝卜素的含量[15-16]。α-生育酚是橄榄油中重要的内源性抗氧化剂,在油品存储过程中首先被氧化,显著减缓不饱和脂肪酸的氧化进程,同时其对角鲨烯和邻二酚也具有一定的保护作用[17]。油茶籽毛油储藏过程中,酸值、过氧化值(PV)逐渐升高的同时,其中的生育酚、角鲨烯和多酚含量明显下降,甾醇含量损失相对较小,约10%。其中,温度和光照对油茶籽油中伴随物的降解影响显著[18]。在60 ℃加速氧化时,水剂法制备的油茶籽油中α-生育酚含量呈不断下降的趋势,氧化6 d后,相较于初始值,α-生育酚损失量高达52.49%[19]。橄榄油和油茶籽油中微量伴随物对油脂氧化起到重要的保护作用,然而,氧化过程中伴随物变化情况尚不够明确,需进一步研究。
以橄榄油和油茶籽油为原料,通过气相色谱质谱联用仪(GC-MS)、高效液相色谱(HPLC)和超高效液相色谱(UPLC)等探究2种油脂在加速和室温氧化过程中微量伴随物的变化情况,以期为2种油脂在氧化过程中微量伴随物与氧化关系研究奠定基础。
1 材料与方法
1.1 试验材料
橄榄油:特级初榨,购于甘肃陇南田园油橄榄科技有限公司;油茶籽油:一级,购于湖南大三湘茶油股份有限公司。
标准品(纯度≥ 98%):胆甾烷醇、角鲨烯、菜油甾醇、豆甾醇、β-谷甾醇、羽扇豆醇、羊毛甾醇、β-香树脂醇、α-生育酚、γ-生育酚、δ-生育酚、羟基酪醇。
试剂:氢氧化钾、乙醇、硅烷化试剂,均为分析纯;正己烷和异丙醇分别为分析纯和色谱纯。
其他材料:0.22 μm有机系滤膜、1 mL注射器、5 mL注射器等。
1.2 仪器与设备
1200L气相色谱质谱联用仪:美国瓦里安公司;1200高效液相色谱仪:安捷伦科技有限公司;超高效液相色谱仪:沃特世科技有限公司。
1.3 试验方法
1.3.1 样品制备
加速氧化:称取1 kg橄榄油和1 kg油茶籽油置于60 ℃烘箱内加速氧化20 d,每2 d定期取样,置于4 ℃冷藏保存用于后续分析。
室温氧化:称取1 kg橄榄油和1 kg油茶籽油置于室温条件下氧化100 d,每10 d定期取样,置于4 ℃冷藏保存用于后续分析。
1.3.2 甾醇和角鲨烯的测定
称取油样0.2~0.3 g(精确至0.001 g)于50 mL离心管中,加入0.1 mg/mL的内标(5α-胆甾烷醇)0.5 mL,加入2 mol/L KOH-乙醇溶液(5.6 g KOH溶于50 mL 95%乙醇,现用现配)5 mL,85 ℃水浴1 h。取出冷却后加入5 mL水和5 mL 正己烷,涡旋后离心(3 500 r/min,3 min),提取上层清液于另一个干净离心管中,下层用5 mL正己烷再提取2次,合并有机液。加入5 mL水,振荡后离心,提取上清液于10 mL离心管中,氮气吹干(分次加液),加入BSTFA+TMCS(99∶ 1)硅烷化试剂200 μL,放置于75 ℃水浴30 min。取出冷却后,过0.22 μm 有机膜,等待进样。
利用GC-MS进行甾醇分析。载气:99.99%氦气;进样量:1 μL;升温程序:180 ℃保持1 min,4 ℃/min 升温至350 ℃,保持5 min,检测器、进样口温度为280 ℃;分流比80∶ 1。通过标准品出峰时间与数据库相似度对比确定不同类型甾醇和角鲨烯的对应峰,采用GC-MS实时分析软件进行数据分析。
1.3.3 生育酚的测定
称取1.0 g油样,加入1 mL正己烷溶解,混匀,通过0.22 μm有机系滤膜过滤。
利用配置紫外检测器的HPLC进行分析。色谱柱:硅胶柱;柱温:25 ℃;流动相:正己烷-异丙醇(体积比98.5∶ 1.5);流速:1 mL/min;进样量:10 μL。通过测定峰面积,以外标法进行定量分析。建立生育酚标准物质的标准曲线(α-生育酚:y=24.091x-5.553 5,R2=0.999 2;β-生育酚:y=18.024x-0.540 6,R2=0.999 5;γ-生育酚:y=21.919x-4.557 8,R2=0.999 7;δ-生育酚:y=19.503x-0.860 5,R2=0.999 6。其中x为生育酚在295 nm处的吸收峰面积,y为生育酚标准品浓度)进行定量。
1.3.4 羟基酪醇的测定
称取50 g油,加入150 mL 70%乙醇(溶解乙醇的水用甲酸酸化至pH值为 2.5),然后加2 mL正己烷,将所得液体通过旋转蒸发仪减压干燥,旋蒸完全后复溶于2 mL的提取液中。
利用配置紫外检测器的UPLC进行分析。色谱柱:反向C18柱(2.1 mm×50 mm,1.7 μm);柱温:30 ℃;流动相:乙腈-水(体积比15∶ 85);流速0.1 mL/min;进样量1 μL。通过标准品出峰位置确定样品中的物质,采用外标法定量分析。
1.3.5 数据处理
每个样品测定3次,最终结果表示为平均值±标准偏差。使用Excel 2016和SPSS软件分析,通过Duncan极差法分析数据的显著性差异(P<0.05),使用Origin 2019绘图。
2 结果与分析
2.1 橄榄油和油茶籽油加速氧化过程的主要微量伴随物变化分析
2.1.1 加速氧化过程中2种油脂的甾醇和角鲨烯含量变化分析
甾醇和角鲨烯是橄榄油与油茶籽油中的重要微量活性物质,其在加速氧化条件下含量变化见表1和表2。
由表1可知,橄榄油中所含甾醇主要包括菜油甾醇、豆甾醇和β-谷甾醇,其中β-谷甾醇含量最高,是橄榄油中最主要的甾醇组分。在加速氧化20 d后,β-谷甾醇降低了34.97%,豆甾醇降低了34.44%,相比之下,菜油甾醇较为稳定,含量仅降低了15.81%。橄榄油中角鲨烯含量较高,高于核桃油、菜籽油等常见油脂[20],在加速氧化20 d后其含量降低了11.62%。由此可见,橄榄油中角鲨烯和甾醇含量均随着氧化时间的延长而逐渐降低,角鲨烯与菜油甾醇较为稳定,而豆甾醇和β-谷甾醇在60 ℃加速氧化时,会呈现较为明显的下降趋势。
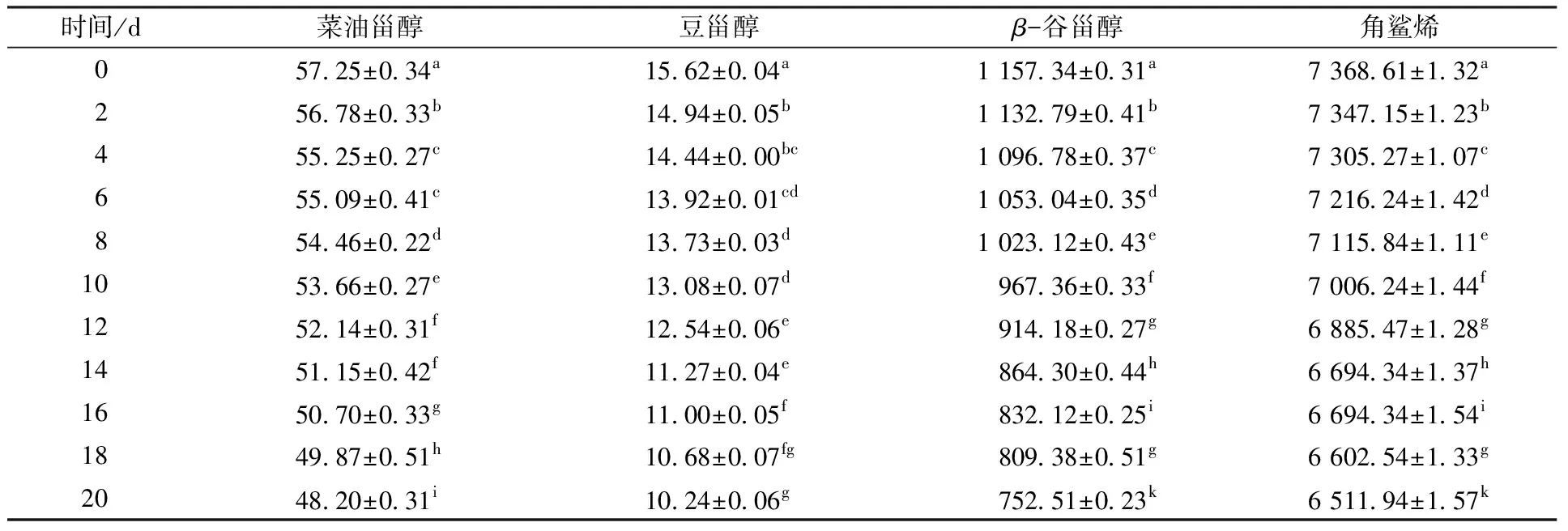
表1 橄榄油在加速氧化过程中甾醇和角鲨烯含量的变化Table 1 Changes of phytosterols and squalene content in olive oil during accelerated oxidation process mg/kg
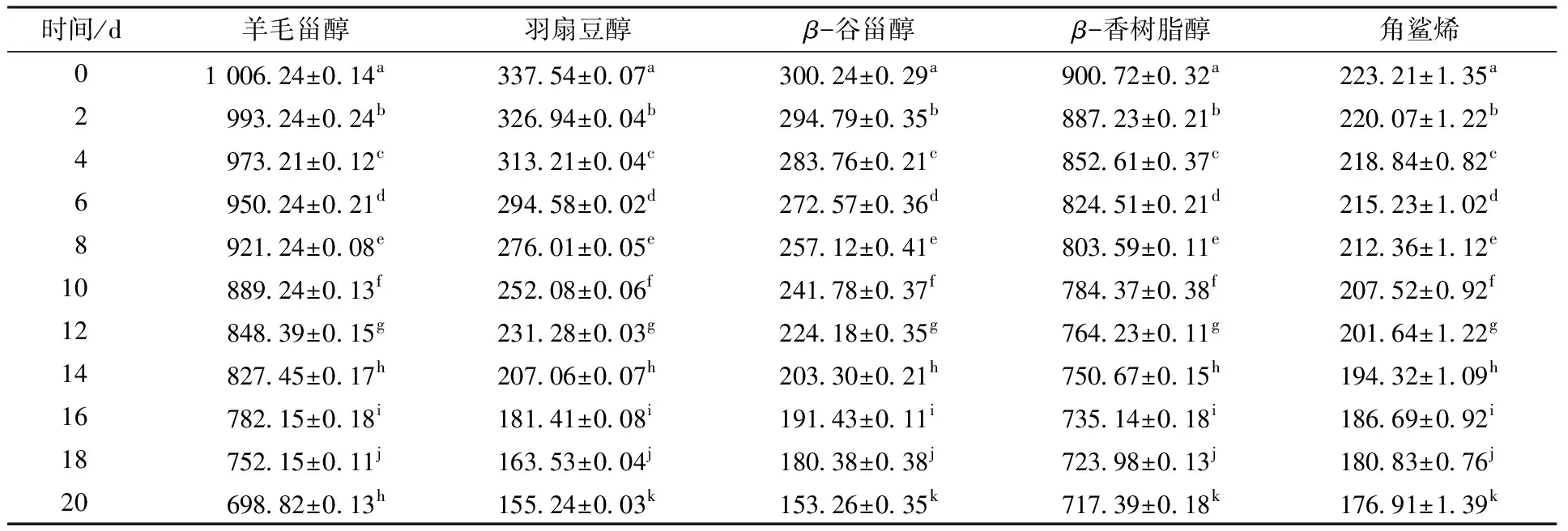
表2 油茶籽油在加速氧化过程中甾醇和角鲨烯含量的变化Table 2 Changes of phytosterols and squalene content in Camellia oleifera seed oil during accelerated oxidation mg/kg
由表2可知,油茶籽油所含甾醇主要为羊毛甾醇、羽扇豆醇、β-谷甾醇和β-香树脂醇。加速氧化20 d后,羽扇豆醇和β-谷甾醇含量下降较为明显,分别达到54.01%和48.95%,羊毛甾醇消耗了30.55%,β-香树脂醇消耗了20.33%。李文基[21]从绿玉树中分离得到羊毛甾醇和羽扇豆醇单体,并进行抗氧化活性测定,发现羽扇豆醇的自由基清除率较高,具有较强的抗氧化性,能延缓氧化反应的发生。由4种甾醇的结构式可知,这4种甾醇分子中均含有一个双键,而羊毛甾醇、β-谷甾醇和β-香树脂醇中所含双键均在苯环内部,而羽扇豆醇分子所含双键在苯环所连接的基团上,暴露的双键易使分子氧化,从而导致羽扇豆醇不稳定、易氧化。油茶籽油中的角鲨烯含量远低于橄榄油,仅为223.21 mg/kg,且在加速氧化20 d后降低了20.74%。角鲨烯分解后,可通过化学反应生成羊毛甾醇[22]。
橄榄油和油茶籽油中脂质伴随物含量丰富,角鲨烯含量高于多种常见食用油,如大豆油、核桃油、芝麻油和亚麻油等[23];所含甾醇为亚麻油的3倍以上,核桃油的10倍以上。2种油脂相比,橄榄油中含有较多的角鲨烯,其含量是油茶籽油的33倍。油茶籽油中甾醇总量高于橄榄油。橄榄油中的甾醇以β-谷甾醇为主,消耗速率较快。油茶籽油含量较高的甾醇为羊毛甾醇和β-香树脂醇,而羽扇豆醇和β-谷甾醇消耗率较高。由此可见,β-谷甾醇在油脂氧化过程中易先被消耗,而橄榄油中β-谷甾醇含量约为油茶籽油的3.85倍,这是橄榄油氧化稳定性较强的原因之一。
2.1.2 加速氧化过程中2种油脂的PV与生育酚含量变化分析
生育酚是一种脂溶性维生素,具有良好的抗氧化效果,常作为抗氧化剂添加到油脂中以增强油脂的氧化稳定性。加速氧化条件下橄榄油和油茶籽油中的过氧化值和生育酚含量的变化如图1所示。
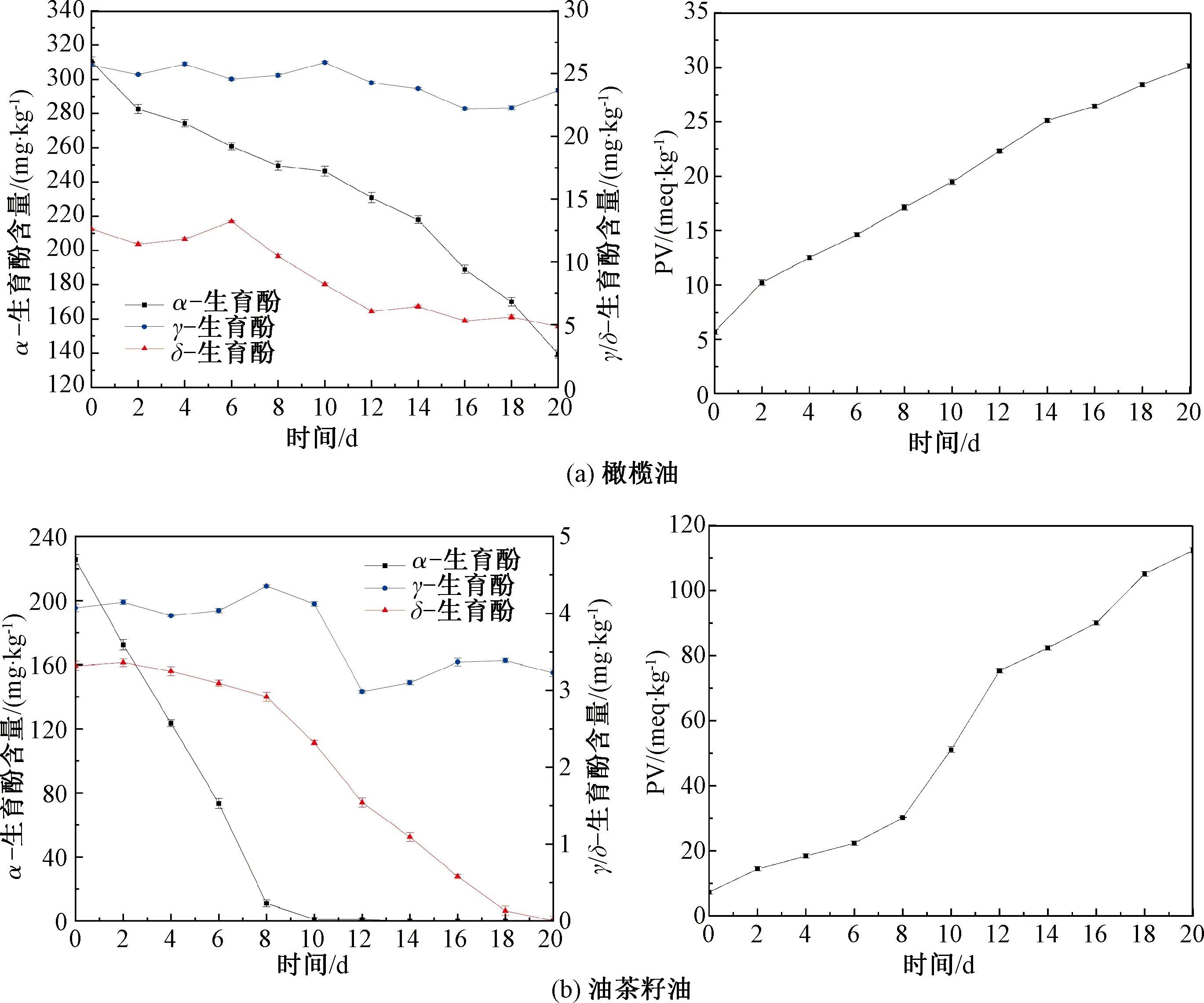
图1 橄榄油和油茶籽油加速氧化过程中PV与生育酚含量的变化Fig.1 Changes of PV and tocopherol content in olive oil and Camellia oleifera seed oil during accelerated oxidation process
由图1(a)可知,随着氧化时间的延长,橄榄油PV逐渐升高,α-生育酚含量始终呈现递减趋势,加速氧化20 d之后,整体降低了55.03%。其他2种生育酚含量变化程度较小,整体呈现波动下降的趋势,其中γ-生育酚未发生明显变化,只从25.66 mg/kg降到了23.65 mg/kg。这是由于在不同类型生育酚中α-生育酚抗氧化性最高,具体原因可能与它们的分子构型有关。α-生育酚分子的苯环邻位和对位上均存在除羟基外的其他基团,而当苯环的临位或者对位上含有基团时,易使苯环活化,使得分子结构的稳定性降低[24]。γ-生育酚分子结构中,在苯环的临位上存在基团,对位上没有,其稳定性高于α-生育酚。δ-生育酚中除羟基外只有一个基团,在临位和对位上均没有其他基团,其稳定性高于γ-生育酚和α-生育酚。这样的分子结构决定了α-生育酚最易被消耗,从而保护了其他2种生育酚。因此,随着油脂氧化程度的增大,α-生育酚呈现递减趋势。
由图1(b)可知,在油茶籽油的初始氧化阶段,PV缓慢增加,α-生育酚显著降低,其他生育酚含量处于波动状态,加速氧化至第10天,α-生育酚消耗殆尽,剩下的2种生育酚,尤其是γ-生育酚开始迅速减少。这与生育酚分子结构决定抗氧化性强弱有关。此外,当α-生育酚接近消耗完全时,即加速氧化8~10 d时,PV的增加速率也明显加快。可见,油脂加速氧化过程中,α-生育酚的损失对油茶籽油氧化速度影响显著。
橄榄油和油茶籽油生育酚组成相似,总含量均高于核桃油[25]。随着氧化程度的增加,油脂中的生育酚均以α-生育酚消耗最为迅速。2种油脂相比,油茶籽油中的α-生育酚下降速率较快,甚至在加速氧化10 d时消耗殆尽,而橄榄油中的α-生育酚相对而言较为稳定。油茶籽油与橄榄油的油基质组成相近,生育酚种类与含量也相差不大。然而,值得注意的是,在相同的加速氧化条件下,油茶籽油PV的升高速率远大于橄榄油。结合氧化过程中生育酚的变化趋势,橄榄油中较为缓慢的α-生育酚下降趋势对应较高的氧化稳定性,油茶籽油则相反。α-生育酚消耗与2种油脂氧化程度关系密切。
2.2 橄榄油和油茶籽油室温氧化过程的主要微量伴随物变化分析
2.2.1 室温氧化过程中2种油脂的甾醇和角鲨烯含量变化分析
在室温氧化条件下,橄榄油和油茶籽油中甾醇和角鲨烯含量的变化如表3和表4所示。
由表3可知,在室温氧化100 d过程中,橄榄油中角鲨烯含量降低了4.91%,甾醇类物质中豆甾醇和β-谷甾醇含量降低程度较大,分别为16.56%和11.93%。相比于加速氧化,在室温氧化条件下,微量伴随物的损失速率远低于加速氧化。由此可见,橄榄油在常温条件下保存时,微量伴随物损失率较低。
由表4可知,室温氧化条件下,油茶籽油中甾醇和角鲨烯的含量呈下降趋势。与加速氧化结果相似,β-谷甾醇和羽扇豆醇是分解速率较高的2种甾醇。室温氧化100 d后,β-谷甾醇降低约20.30%,羽扇豆醇降低约12.28%,羊毛甾醇和角鲨烯降低则不到10%。由此可见,在室温氧化条件下,油茶籽油中各类甾醇发生分解,但整体上其含量下降速率远低于加速氧化时的下降速率。这可能是由于在室温氧化条件下,油茶籽油中油基质的分解速率低于加速氧化时的分解速率,产生的自由基等较少,甾醇和角鲨烯的消耗速率随之降低。
在室温氧化100 d过程中,橄榄油和油茶籽油中甾醇含量分别降低了11.95%和10.85%,两者消耗程度相差不大;橄榄油和油茶籽油中角鲨烯降低程度分别为4.91%和2.85%,但是由于其在橄榄油中初始含量高,氧化一定时间时,橄榄油中的角鲨烯含量始终高于油茶籽油。这对于橄榄油较强的氧化稳定性的形成是有一定作用的。
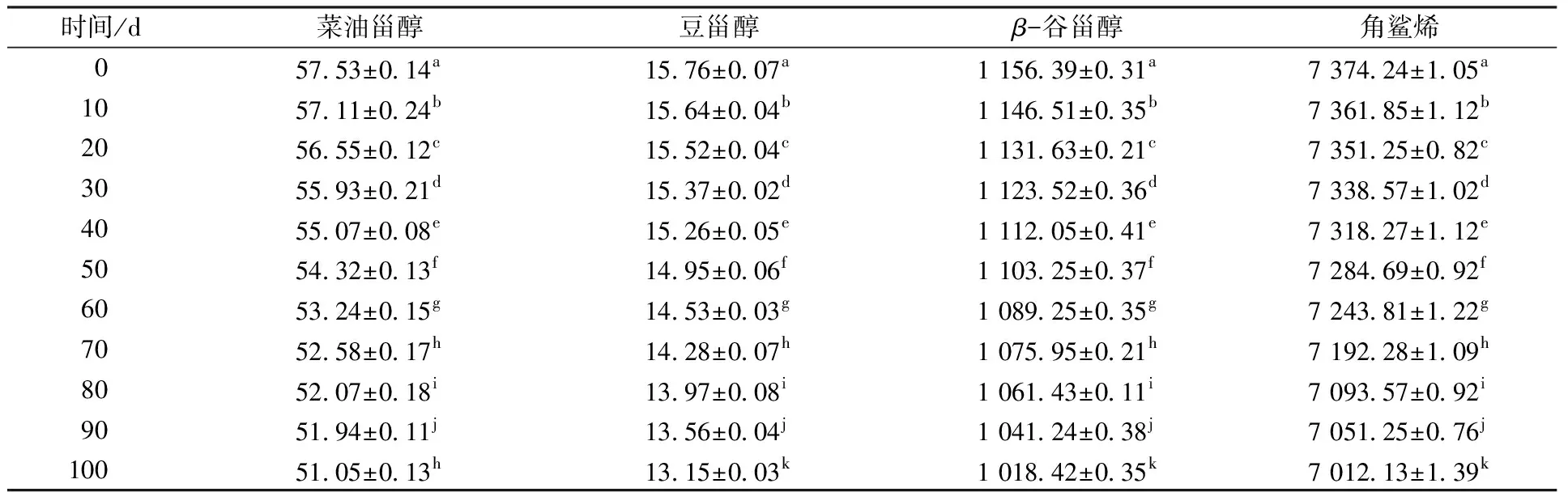
表3 橄榄油室温氧化过程中甾醇和角鲨烯含量的变化Table 3 Changes of phytosterols and squalene content in olive oil during oxidation process at room temperature mg/kg
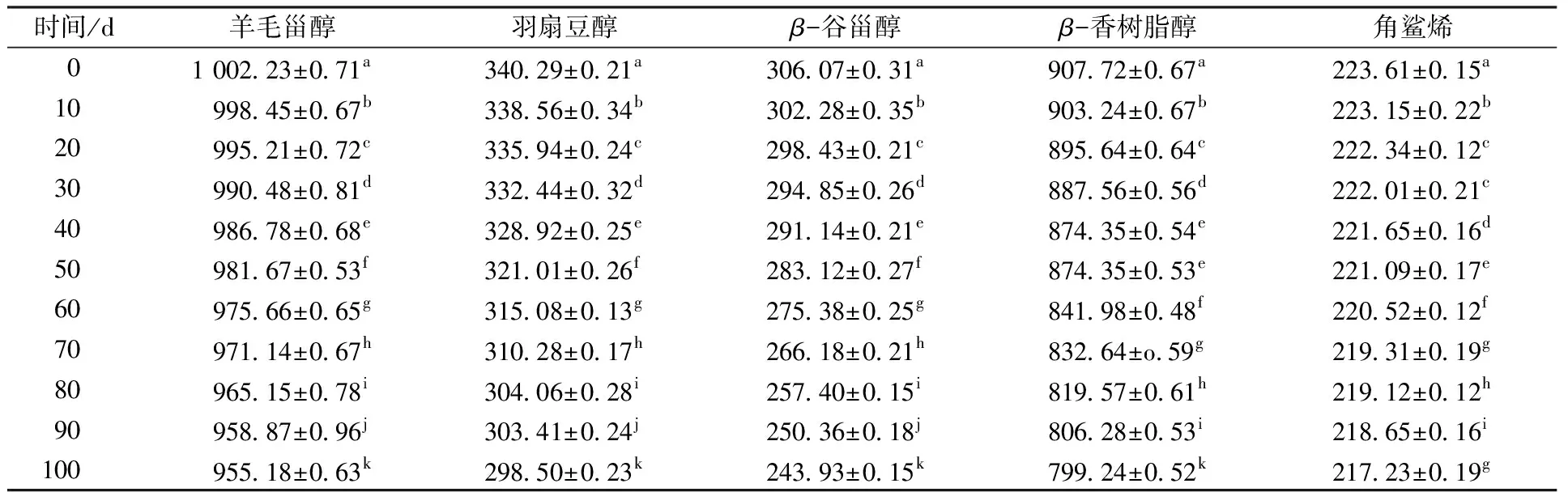
表4 油茶籽油室温氧化过程中甾醇和角鲨烯含量的变化Table 4 Changes of phytosterols and squalene content in Camellia oleifera seed oil during oxidation process at room temperature mg/kg
2.2.2 室温氧化过程中2种油脂的PV与生育酚含量变化分析
在室温氧化条件下,橄榄油和油茶籽油中的PV和生育酚含量的变化如图2所示。
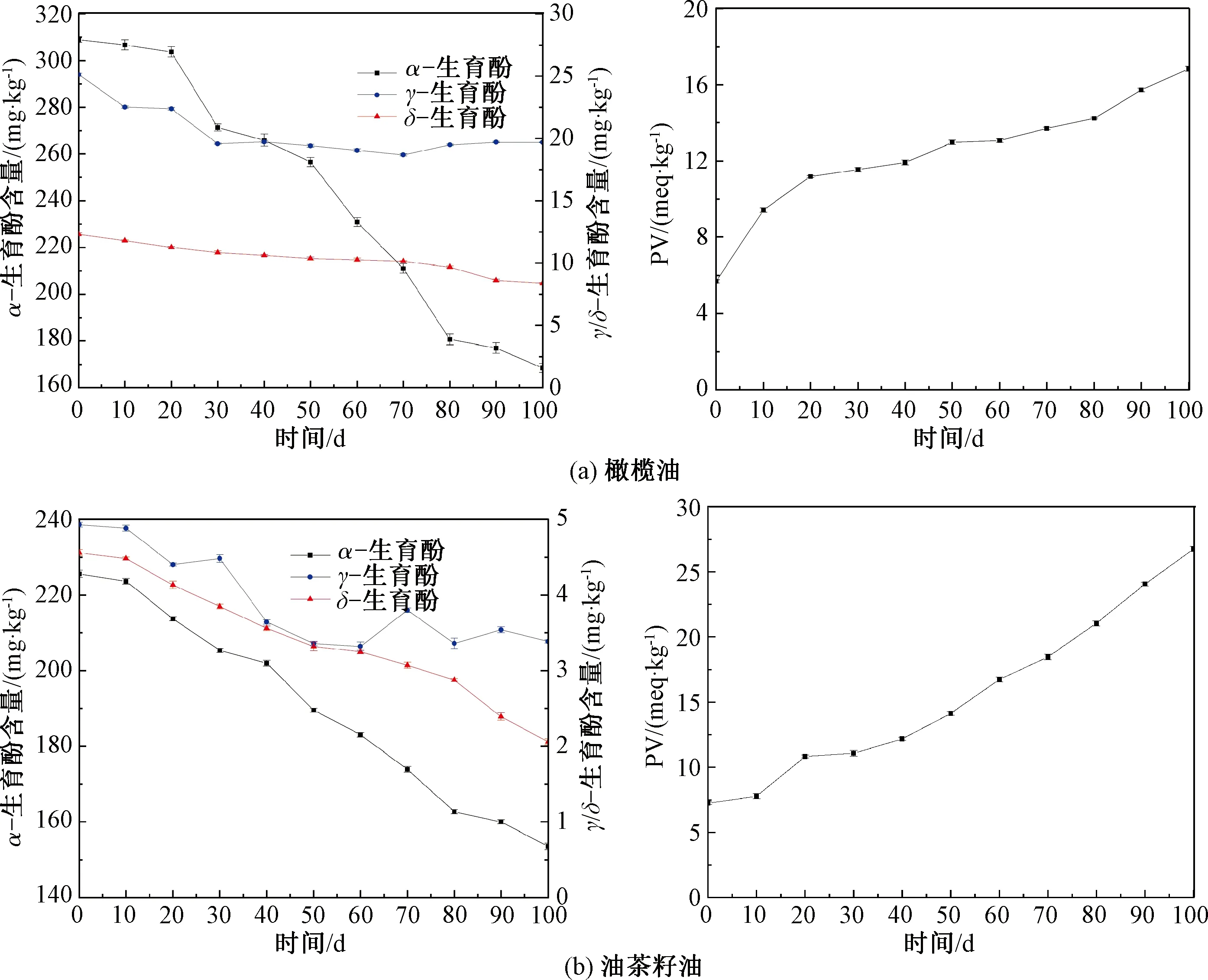
图2 橄榄油和油茶籽油室温氧化过程中PV与生育酚含量的变化Fig.2 Changes of PV and tocopherol content in olive oil and Camellia oleifera seed oil during oxidation process at room temperature
由图2(a)可知,与加速氧化类似,室温状态下橄榄油中α-生育酚含量随氧化时间延长呈下降趋势,在室温氧化100 d后降低了45.48%,但仍保持较高含量,它的保护使得γ-生育酚和δ-生育酚在整个过程中下降十分缓慢。此外,当油脂中存在α-生育酚时,不仅保护了其他类型生育酚,也减缓了PV的增加速率,延缓了橄榄油的氧化,在室温氧化100 d过程中PV始终未超过20 meq/kg,保证了橄榄油良好的品质。
由图2(b)可知,与加速氧化类似,油茶籽油中生育酚含量整体呈下降趋势,PV则在氧化过程中逐渐升高。然而,室温条件下,α-生育酚含量的降低速率明显低于加速氧化过程,室温氧化100 d后其含量降低了31.98%,其他2种生育酚初始含量远低于α-生育酚,下降程度分别为31.23%和54.82%。
综上,2种油脂中主要生育酚类型均为α-生育酚,在室温氧化100 d后降低程度超过40%,但是差别不明显;而相比于油茶籽油,橄榄油中的γ-生育酚和δ-生育酚则明显较为稳定。相应地,在室温条件下,橄榄油的PV增加较慢,氧化速率低于油茶籽油。
2.3 橄榄油中羟基酪醇含量变化分析
羟基酪醇是橄榄油中特有的微量伴随物,主要存在于特级初榨橄榄油中。加速和室温氧化过程中橄榄油中羟基酪醇含量的变化如图3所示。
由图3(a)可知,橄榄油中羟基酪醇初始含量为5.40 mg/kg,在加速氧化过程中含量持续下降,且在氧化6 d后下降较为显著,加速氧化20 d期间整体含量降低了43.52%,相比橄榄油中甾醇和角鲨烯等活性物质,羟基酪醇在加速氧化时下降速率较高,稳定性差。这可能是由于羟基酪醇分子结构中不仅同其他酚类物质一样具有酚羟基,而且在连有苯环的乙醇链上还具有醇羟基,熔点低且吸湿性强,在加速氧化条件下易作为供氢体与活性较高的自由基发生反应,生成活性较低的多酚自由基,打断自由基链式反应,降低油脂中自由基氧化速率,从而降低橄榄油的氧化速率。因此,在加速氧化条件下羟基酪醇消耗率高于其他伴随物。
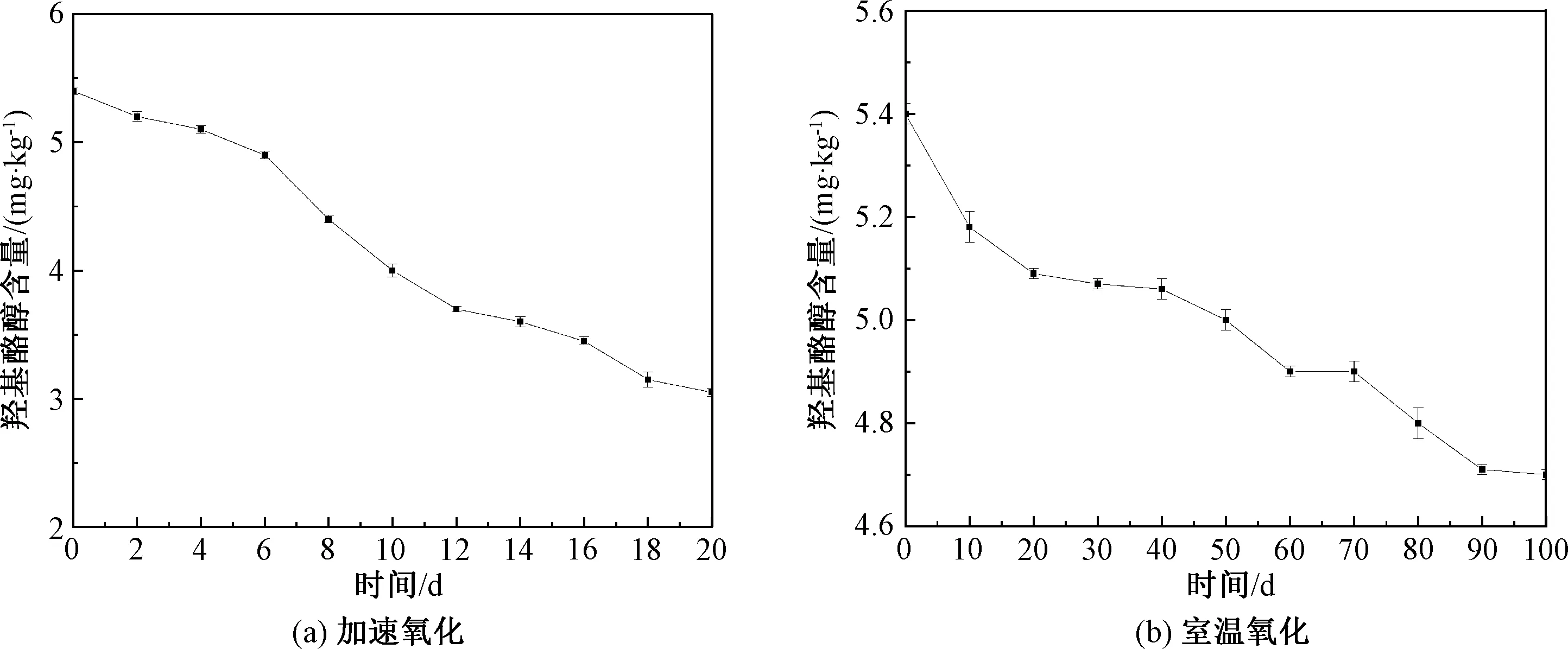
图3 加速和室温氧化条件下橄榄油中羟基酪醇含量的变化Fig.3 Changes of hydroxytyrosol content in olive oil during accelerated oxidation process and at room temperature
由图3(b)可知,在室温条件下,橄榄油中羟基酪醇含量呈现逐渐降低的趋势,相比于加速氧化时的快速下降,室温氧化100 d后仅降低了12.96%。可见羟基酪醇在室温氧化时的稳定性远高于加速氧化,分解速度缓慢,这可能是由于橄榄油在室温条件下,甘油三酯降解速度低,油脂中的游离脂肪酸和自由基含量少,不需要消耗过多的羟基酪醇便可完成与高活性自由基的相互结合,从而打断自由基链式反应,延缓了橄榄油的氧化,保护了更多羟基酪醇。因此,在室温条件下,羟基酪醇分解速率低,含量下降缓慢,有助于橄榄油的长期高品质保存。
3 结论
通过甾醇、角鲨烯、生育酚和羟基酪醇等微量伴随物的分析,考察了橄榄油和油茶籽油的氧化过程与微量伴随物含量变化之间的关系。结果表明:它们在氧化期间均呈下降趋势,且其降低速率随氧化温度的升高而增加。橄榄油中含有丰富的角鲨烯,其含量(7 368.61 mg/kg)是油茶籽油中角鲨烯含量(223.21 mg/kg)的33倍。在加速和室温氧化过程中,橄榄油中的角鲨烯含量始终高于油茶籽油。对于不同类型的甾醇,β-谷甾醇在这2种油脂氧化过程中均先被消耗,而橄榄油中β-谷甾醇含量(1 157.34 mg/kg)约为油茶籽油(300.24 mg/kg)的3.85倍。橄榄油和油茶籽油中的生育酚均以α-生育酚为主,其中,橄榄油的生育酚总量和α-生育酚含量又高于油茶籽油,且氧化过程中橄榄油的α-生育酚含量始终高于油茶籽油。此外,羟基酪醇是橄榄油中特有的一种酚类物质,虽然初始含量(5.40 mg/kg)不高,但其在室温氧化100 d过程中始终存在,未被完全消耗。因此,橄榄油的氧化速率明显低于油茶籽油,主要是微量伴随物组成和含量差异所致,尤其是其较高含量的角鲨烯、β-谷甾醇以及羟基酪醇等。

