南极磷虾油对硫酸葡聚糖钠盐诱导溃疡性结肠炎小鼠的抗氧化作用机制
周晓玲,相兴伟*,周宇芳,郑 斌,邓尚贵,廖妙飞,闻正顺
(1.浙江海洋大学食品与药学学院,浙江 舟山 316022;2.浙江省海洋开发研究院,浙江 舟山 316021;3.浙江工业大学食品科学与工程学院,浙江 杭州 310014)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性、易复发且非特异性的炎症性肠病(inflammatory bowel disease,IBD),病变区域主要发生在结肠至直肠的黏膜及黏膜下层[1]。UC患者主要病症包括体质量减轻、食欲下降、频繁腹痛腹泻、便血等状况[2]。每年全球UC的发病率和患病率不断上升,逐渐成为一项公共健康卫生问题,严重影响患者的生活[3]。目前,对于UC的发病机制尚存在争议,无法准确定义。
研究表明降低机体过度氧化应激对UC病理治疗具有重要意义[4]。正常状态下的机体可通过氧化/抗氧化系统维持体内代谢过程中自由基生产与消除的动态平衡。肠道在机体消化吸收过程中可接触到多种致氧化因子,如铁离子、铜离子、血红素、醛等,易造成氧化损伤[5]。随着肠道炎症程度加深和抗氧化系统被破坏,过度氧化应激刺激有害氧自由基分子和过氧化物的合成释放,导致肠道功能屏障保护系统损伤加剧[6]。
南极磷虾(Euphausia superba)是南极海域的小型浮游生物,其因庞大的生物量和高营养价值而备受关注[7]。南极磷虾油(Antarctic krill oil,AKO)是南极磷虾资源开发利用的重要产品,由多种生物活性成分组成[8]。AKO可作为摄入n-3系多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)的良好来源,其中30%~65%的n-3 PUFAs以与磷脂结合的形式存在,这有利于穿透肠壁进行吸收[9]。此外,AKO还含有高浓度的虾青素以及VA、VE等天然抗氧化成分,具有抗氧化特性[10]。研究证明AKO对人体无害、耐受性好、易被人体吸收[11]。近些年研究表明AKO还具有减轻心血管疾病[12],调节高脂血症[13],预防和改善神经认知功能障碍[14]、抑郁[15]等多种功能,并可改善疾病过程中伴随着的持续性氧化应激状态。Grimstad等报道AKO可改善UC大鼠炎症状态和减少血液中氧化标记物水平,但对具体的抗氧化机制未进行深入研究[16]。因此,本实验探讨了AKO对硫酸葡聚糖钠盐(dextran sulfate sodium,DSS)诱导实验性UC小鼠中的抗氧化机制,为AKO的开发和利用提供一些理论参考。
1 材料与方法
1.1 动物、材料与试剂
5 周龄清洁级健康雄性BALB/c小鼠(体质量(15±1)g,生产许可证号:SCXK(沪)2018-006)购自浙江医学科学院。小鼠普通鼠粮及玉米芯垫料购自苏州双狮实验动物饲料科技有限公司。
AKO由浙江省海洋开发研究院提取制备,4 ℃保存。AKO含约48.4%(质量分数,下同)磷脂、37.9%甘油三酯、13.9%游离脂肪酸、0.6%的胆固醇和1 002.4 μg/g虾青素。不饱和脂肪酸(unsaturated fatty acid,UFA)和PUFA分别占总脂肪酸的65.9%和32%。
DSS 美国MP Biomedicals公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒 南京建成生物工程研究所;白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒 武汉博士德生物公司;内毒素(lipopolysaccharides,LPS)ELISA检测试剂盒 武汉华美生物工程有限公司;二胺氧化酶(diamine oxidase,DAO)检测试剂盒 森贝伽生物科技有限公司;cDNA反转录试剂盒、TB GreenTMPremix ExTaqTM荧光定量试剂盒 日本TaKaRa公司;核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)抗体 美国Abcam公司;Keap1抗体 美国Santa Cruz Biotechnology公司;β-actin抗体 美国Cell Signaling Technology公司;其余实验所用试剂均为分析纯。
1.2 仪器与设备
IXS 1型倒置显微镜 日本Olympus公司;Multiskan FC全自动酶标仪 美国赛默飞世尔科技有限公司;TGL-16M高速冷冻离心机 上海如湘仪器有限公司;MyCycler聚合酶链式反应(polymerase chain reaction,PCR)仪 美国伯乐生命医学产品有限公司;ABI ViiATM实时荧光定量PCR(quantitative PCR,qPCR)仪(含FTC-3000实时检测系统) 美国Applied Biosystems公司;ChemiScope series化学发光成像仪 上海勤翔科学仪器有限公司。
1.3 方法
1.3.1 动物实验设计
小鼠抵达实验室后在饲养环境(12 h/12 h光暗循环、温度(22±2)℃、相对湿度(60±5)%)适应5 d。实验期间提供基础饲料和自由饮水。动物实验方案的制定与执行均依照浙江海洋大学实验动物护理伦理委员会的批准和指导开展(编号:2019003)。
将小鼠随机分为4 组(n=6):对照组、DSS组、低剂量AKO组(L-AKO,0.25 g/(kgmb·d))和高剂量AKO组(H-AKO,0.5 g/(kgmb·d))。第1~21天,L-AKO组和H-AKO组小鼠每天分别给予0.25、0.50 g/kg AKO灌胃,对照组和DSS组小鼠给予等体积纯水灌胃处理;第14~21天,除对照组外的其他实验小鼠每天给予含有质量分数3.5% DSS的饮用水以诱导产生实验性UC。实验期间记录小鼠行动饮食状态。实验结束后对小鼠实行人道处死,收集小鼠盲肠至直肠区域肠道(即结肠组织),保存在-80 ℃用于后续分析。
1.3.2 H&E染色
用体积分数4%多聚甲醛溶液固定新鲜结肠组织,进行一系列标准乙醇溶液梯度脱水,石蜡包埋、切片(厚度4 μm)、苏木精-伊红(hematoxylin-eosin,H&E)染色、制片。使用带有计算机辅助成像分析系统的显微镜下放大观察,记录结肠组织切片。
1.3.3 生化指标检测
准确称取部分结肠组织,按1∶9(m/V)的比例加入磷酸盐缓冲液,在组织匀浆器中进行均质。使用高速冷冻离心机在4 ℃条件下3 000 r/min离心10 min,收集离心后的上层液体保存,即结肠组织匀浆液样品。使用ELISA检测试剂盒分别测定TNF-α、IL-6、LPS的水平,GSH-Px、SOD活力和DAO水平使用对应的试剂盒进行检测SOD活力结果以蛋白质量计,GSH-Px活力以其浓度计。
1.3.4 抗氧化相关基因相对表达量的测定
结肠组织在液氮中粉碎后与TRIzol试剂充分混合均匀,静置分离以提取总RNA,并使用琼脂糖凝胶电泳验证质量。将提取到的总RNA作为模板使用反转录合成试剂盒合成cDNA。随后,各组cDNA样品利用TB GreenTMPremix ExTaqTM荧光定量试剂盒进行处理后,再上样进行qPCR,利用实时检测系统进行定量分析。以β-actin为内参基因,采用2-ΔΔCt法计算各基因相对表达量。实验所需引物序列参考表1合成。

表1 引物序列表Table 1 Primer sequences used in this study
1.3.5 蛋白相对表达量测定
取部分结肠组织使用液氮进行粉碎,加RIPA裂解缓冲液裂解细胞提取总蛋白。调整各提取样品的蛋白总量为20 μg用于Western blot分析。所有样品蛋白上样于质量分数10%十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳分离,随后截取目标蛋白区域置于已被甲醇活化的聚偏二氟乙烯(polyvinylidene fluoride,PVDF)上印迹。使用质量分数5%脱脂牛奶稀释液封闭PVDF膜后,依次在一抗和二抗稀释液中进行孵育。所用一抗分别为:Keap1、Nrf2、β-actin,均按1∶1 000比例稀释。在化学发光成像仪下观察记录蛋白条带,并使用ImageJ软件计算目标蛋白灰度。以β-actin为内参蛋白,对目标蛋白的相对表达进行归一化计算。
1.4 数据处理与分析
利用Prism version 7.0软件对数据进行统计分析,结果以平均值±标准差表示。采用单因素方差分析进行多组间的差异性分析,P<0.05时表示差异显著。
2 结果与分析
2.1 AKO对UC小鼠一般行为情况的影响
在实验期间,仅喂食标准饮食的对照组小鼠表现活跃、行动迅捷、毛发光洁。DSS药物干预3 d后,小鼠出现进食和饮水减少、行动迟缓、活力下降等现象,后期可观察到腹泻便血,体质量迅速下降。摄入AKO后的小鼠在行动、毛发、饮食饮水、粪便方面均得到了改善,并在一定程度上缓减DSS造成的体质量降低。
2.2 AKO对UC小鼠结肠组织结构的影响
如图1所示,对照组小鼠结肠上皮细胞和隐窝结构完整,无溃疡和炎症细胞浸润。而DSS干预后肠道结构严重受损,部分肠壁增厚,隐窝结构和杯状细胞扭曲,腺体结构异常,黏膜下炎症细胞浸润。这些症状表明DSS诱导的小鼠UC造模成功。L-AKO和H-AKO处理均可显著改善DSS造成的肠道损伤、组织溃烂,恢复基本结构。H-AKO在维持结肠结构完整且不引起大量炎症方面有更好的效果,提示AKO可以有助于UC小鼠的肠道恢复。

图1 各组小鼠结肠组织H&E染色结果(100×)Fig.1 H&E staining results of colonic tissues of mice in each group (100 ×)
2.3 AKO对UC小鼠结肠组织炎症因子的影响
炎症因子是体内炎症反应的重要信号分子,它们的表达水平与UC的严重程度呈正相关[17]。通过ELISA检测试剂盒测定炎症因子IL-6和TNF-α在结肠组织的表达水平,用以评价机体的炎症反应,结果如图2所示。与对照组相比,DSS组小鼠结肠中IL-6、TNF-α的表达水平显著升高(P<0.05)。与DSS组相比,不同剂量AKO处理后均可以降低炎症因子IL-6、TNF-α的表达水平。其中,H-AKO处理组的IL-6、TNF-α表达水平更接近对照组(P>0.05)。提示摄入AKO有利于降低体内炎症因子水平从而缓解UC小鼠炎症反应。

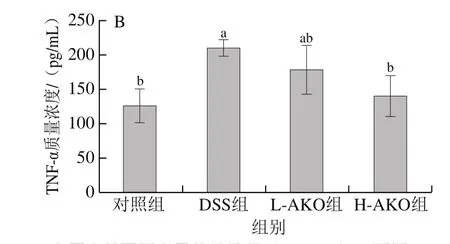
图2 AKO对UC小鼠结肠组织中炎症因子IL-6(A)和TNF-α(B)水平的影响Fig.2 Effect of AKO on the levels of inflammatory factors IL-6 (A)and TNF-α (B) in colon tissues of UC mice
2.4 AKO对UC小鼠结肠通透性的影响
肠道组织是机体免疫系统中的重要组成部分,LPS和DAO的含量可以间接反映肠道屏障的损伤程度[18]。从图3可看出,与对照组相比,DSS诱导后的小鼠结肠内DAO和LPS水平显著升高(P<0.05),AKO处理能明显降低DSS诱导后小鼠结肠内的DAO和LPS的水平,其中H-AKO具有显著性的效果(P<0.05)。结果提示AKO可显著改变小鼠的肠道通透性,维持肠道屏障完整和功能,抵御有害物质侵袭机体。
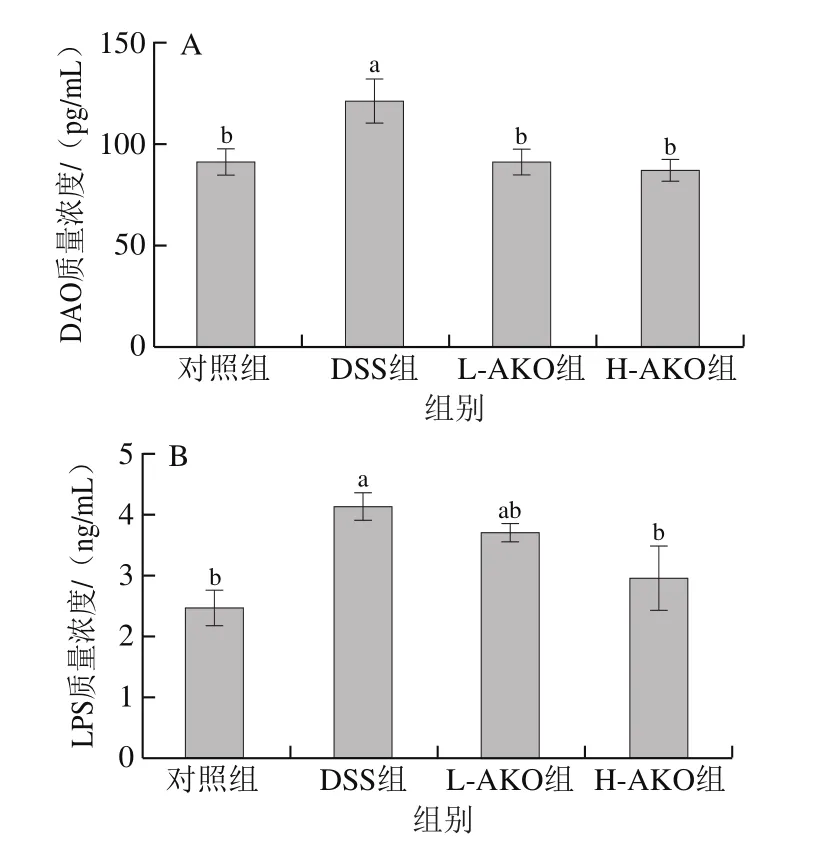
图3 AKO对UC小鼠结肠组织中DAO(A)和LPS(B)水平的影响Fig.3 Effect of AKO on the contents of intestinal permeability indicators DAO (A) and LPS (B) in colon tissues of UC mice
2.5 AKO对UC小鼠结肠中抗氧化酶活力的影响
GSH-Px和SOD的活力可以反映机体的抗氧化能力。如图4所示,与对照组相比,DSS干预后可以显著降低抗氧化酶GSH-Px、SOD在小鼠结肠内的活力(P<0.05),提示小鼠体内抗氧化能力下降。与DSS组相比,不同剂量AKO处理后结肠组织内GSH-Px和SOD活力出现了不同程度的提高。其中H-AKO处理与L-AKO处理结果相比更接近对照组GSH-Px和SOD活力水平。结果显示摄入H-AKO有助于增强炎症状态下的结肠组织中相关抗氧化酶活力,改善UC小鼠体内的抗氧化能力。
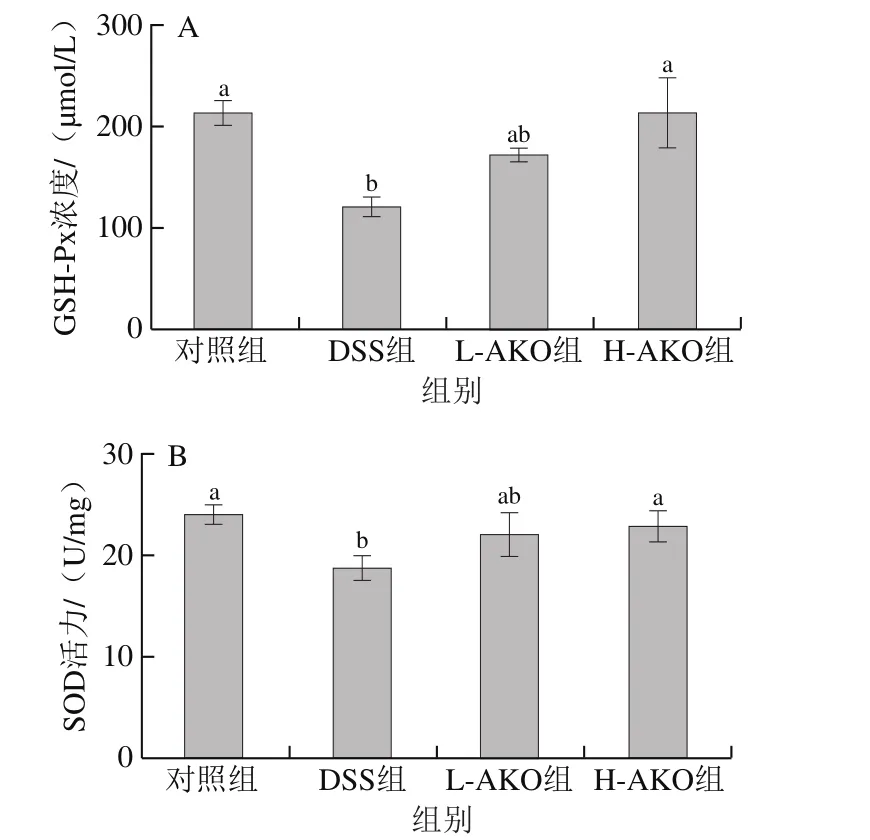
图4 AKO对UC小鼠结肠组织中抗氧化酶GSH-Px(A)和SOD(B)活力的影响Fig.4 Effect of AKO on the activity of antioxidant enzymes GSH-Px (A)and SOD (B) in colon tissues of UC mice
2.6 AKO对UC小鼠结肠抗氧化相关基因表达水平的影响
为了进一步探讨AKO对UC小鼠体内的抗氧化影响,利用qPCR对Nrf2/Keap1信号通路中控制的下游抗氧化酶基因表达进行了验证。如图5所示,与对照组相比,DSS诱导后能显著降低结肠组织中SOD、GSH-Px及Nrf2/Keap1通路中II期下游HO-1基因的表达水平(P<0.05),显著提高Nrf2基因的表达水平(P<0.05)。H-AKO处理可以显著增加DSS干预后的小鼠结肠中SOD、GSHPx、Nrf2、HO-1基因表达水平,并且接近正常水平(P>0.05)。提示H-AKO处理可以提高UC小鼠体内的相关抗氧化基因表达,以抵抗肠道氧化应激损伤。

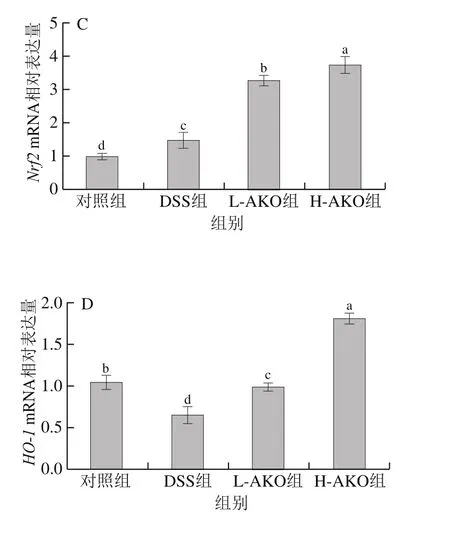
图5 AKO对UC小鼠结肠组织抗氧化相关基因SOD(A)、GSH-Px(B)、Nrf2(C)、HO-1(D)表达水平的影响Fig.5 Effect of AKO on the expression levels of antioxidant genes SOD (A), GSH-Px (B), Nrf2 (C), and HO-1 (D) in colon tissues of UC mice
2.7 AKO对Nrf2/Keap1信号通路的影响
使用Western blot法检测Nrf2/Keap1通路中的关键蛋白水平,用于进一步评价AKO对UC小鼠体内抗氧化机制的影响。在正常情况下,Keap1与Nrf2在细胞质中结合,当机体受到某种刺激后,Keap1-Nrf2的结合不稳定,Nrf2被释放出来并转移到细胞核内进行后续反应,这对于各种靶基因的反式激活必不可少[19]。如图6所示,AKO处理组与DSS组、对照组相比结肠内Nrf2表达水平增加,Keap1表达水平降低,并具有剂量依赖性(P<0.05)。这些结果证明AKO可能是通过调节Nrf2/Keap1信号通路从而改善UC小鼠的氧化损伤。
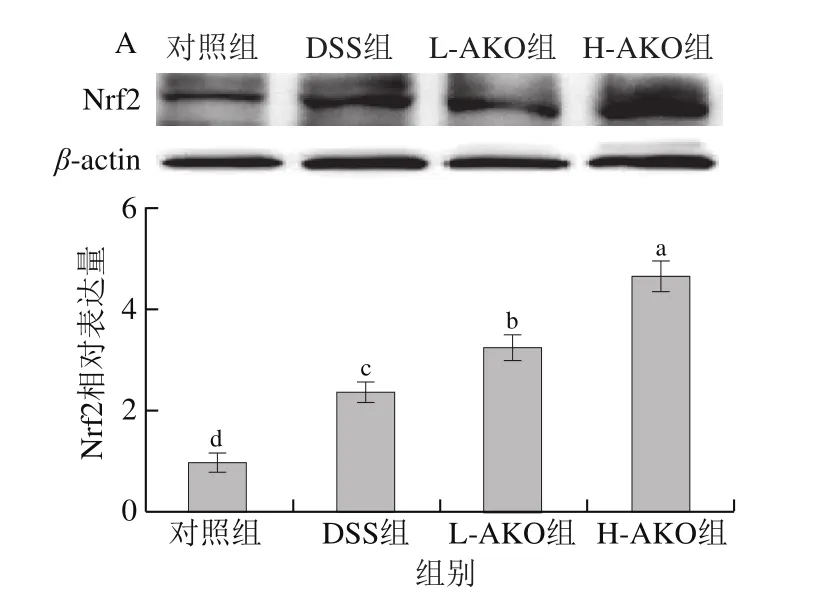
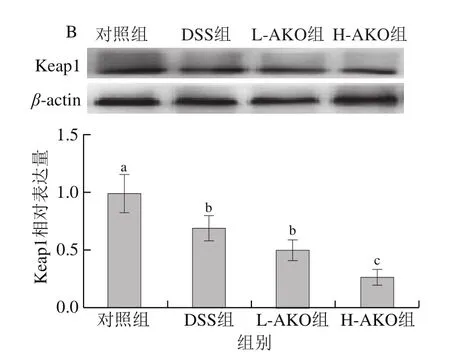
图6 AKO对UC小鼠结肠组织中Nrf2/Keap1信号通路的影响Fig.6 Effect of AKO on Nrf2/Keap1 signal pathway in colonic tissues of mice
3 讨 论
UC是一种引起患者腹部疼痛的慢性肠道疾病,由于药物治疗通常会伴随着严重的副作用且难以完全治愈,因此预防和寻找安全高效的治疗方法成为人们关注的重点[20]。饮食是维持人体健康与生长的关键因素,通过饮食干预进行预防和调节UC发展是行之可效的[21]。AKO富含多种活性物质,是一种新型且受欢迎的食品补充剂。本实验通过AKO干预动物实验,研究其对DSS诱导造成UC小鼠氧化损伤的保护作用。
研究表明UC的发病机制与肠道炎症、异常氧化应激和肠道屏障损伤等因素密切相关[22]。在活动性肠道炎症的发生过程中,先天反应表现为炎症黏膜中白细胞浸润水平的升高,导致氧化应激损伤[23]。TNF-α和IL-6是体内重要的炎症调节因子。TNF-α可促进其他炎症因子产生,引起黏膜炎症和肠道屏障损伤。IL-6与机体的炎症、免疫应答密切相关,过度表达导致免疫紊乱并加剧炎症[24]。徐宝琪等对不同状态下的UC患者进行血清检测,结果表明,与正常人相比,其体内TNF-α和IL-6水平显著性升高[25]。本实验结果显示H-AKO处理可显著降低DSS干预后结肠组织中IL-6、TNF-α的表达水平(P<0.05)。Kim等研究表明AKO脂质体可以极大地抑制脂多糖诱导的RW254.6巨噬细胞促炎因子的产生[26]。n-3 PUFAs可通过多种方式降低炎症反应,包括减少促炎转录因子的分泌、影响膜脂肪酸组成从而维护细胞形态、激活过氧化物酶体增殖受体来提高抗氧化能力等[27]。这提示H-AKO处理可以有助于减少炎症因子的分泌,改善UC小鼠结肠炎症。
此外,炎症因子通过NF-κB通路进一步参与到DSS干预造成的肠道屏障损伤[28]。完整的结肠上皮屏障是维持正常肠道功能的基础条件[29]。黄循铷等实验表明2.5% DSS定量灌胃诱导的结肠炎小鼠出现了结肠上皮组织溃烂、出血、肠道通透性增加等现象[30]。肠道屏障受损时,肠上皮细胞剥离溶解使DAO被释放到管腔内,LPS从死亡革兰氏阴性菌细胞壁中释放到肠道中进入机体循环导致炎症反应加剧[31]。因此,肠道内LPS和DAO水平可间接反映肠道屏障的损伤程度。实验结果显示,在DSS的炎性刺激环境下,肠道中的DAO和LPS水平升高,小鼠肠道屏障的完整性被破坏。与DSS组相比,H-AKO处理可改善结肠组织结构受损和组织溃烂,并降低LPS和DAO水平(P<0.05)。AKO脂质体在肠道屏障模型中表现出可以完全恢复炎症受损的膜道屏障[26]。这提示H-AKO处理有助于维护UC小鼠正常的肠道屏障结构与功能。
氧化应激异常通常被认为是UC进展的关键。在UC患者中可观察到中性粒细胞产生过多活性氧,进而攻击破坏关键大分子,扰乱细胞内稳态,导致组织出现氧化损伤,从而加速和延长炎症反应[32]。同时,氧化应激对肠道屏障的功能和结构完整性产生破坏作用,引发肠内稳态失调[33]。SOD是参与保护组织免受氧化损伤的重要抗氧化酶之一,可调节体内代谢产生超氧阴离子自由基,并联合下游相关过氧化物酶对其进行彻底清除。GSH-Px作为一种过氧化物分解酶,被认为是机体抗氧化防御系统的重要组成部分,可保护细胞免受活性氧造成的损伤[34]。实验结果表明,与对照组相比,DSS组小鼠的SOD和GSH-Px活力均呈现明显下降,提示DSS诱导造成了小鼠抗氧化防御系统功能失常;而通过AKO处理后可以逆转该下降趋势,这可能与KO的组分具有抗氧化作用相关。n-3 PUFAs因其结构中的不饱合键具有一定抗氧化性[35],虾青素作为天然的强抗氧剂能高效清除体内自由基[36],谢丹在AKO抗氧化功能评价的研究中发现磷脂的存在亦可发挥次级抗氧化作用[37]。研究证实通过使用外源性抗氧化物和增加机体内抗氧化系统基因的表达可以预防UC发生[4]。Grimstad等研究表明摄入富含高浓度的虾青素和n-3 PUFAs的AKO可达到减轻自身炎症的氧化应激[16]。提示AKO可能通过发挥自身抗氧化能力和增强体内抗氧化酶活性的协同作用达到减少UC小鼠氧化应激反应。
Nrf2是维持细胞内氧化还原平衡反应的一种重要转录因子,参与多种应激反应、诱导相关保护酶及相关蛋白如SOD、GSH-Px和HO-1[38]的转录。在Nrf2/Keap1信号通路中,Keap1通过泛素化、偶联和降解等作用对Nrf2表达进行负调控,从而影响Nrf2结合抗氧化元件来控制下游抗氧化基因的转录,起到抗氧化作用[19]。HO-1是主要抗氧化应答者之一,是Nrf2/Keap1信号通路的关键靶基因[39]。Nrf2可诱导HO-1表达上调,抑制炎症介质的产生和释放,起到抗炎、抗氧化和抗凋亡的作用,保护细胞[40]。Hye-Won等研究表明摄取n-3 PUFAs可以有效抵抗三硝基苯磺酸介导的野生型UC小鼠中炎症和脂肪氧化,并抑制NF-κB通路和激活Nrf2通路中相关目标基因的表达[41]。王蕾研究表明摄入不同比例的PUFAs可以通过调节Nrf2抗氧化通路来改善DSS诱导的UC小鼠体内抗氧化能力[35]。Helal等研究表明AKO可在铁超载大鼠体内上调Nrf2的表达来降低氧化应激[42]。Wen Chengfei等研究表明AKO通过Nrf2/Keap1信号通路减弱冠心病患者的氧化应激[43]。这些研究表明摄入AKO可影响Nrf2信号通路,缓减机体的氧化应激状态。本研究结果表明小鼠在受到DSS刺激后启动了Nrf2抗氧化通路,但没有改善氧化应激状态。给予AKO处理后可增加小鼠结肠内的Nrf2及相关抗氧化酶的基因表达,增强了结肠组织抗氧化能力。Western blot分析结果表明AKO处理与对照组和DSS组相比,可以增加Nrf2蛋白表达,并抑制Keap1蛋白表达。这些结果表明摄入AKO可以通过激活Nrf2/Keap1信号通路影响UC小鼠体内的抗氧化系统。
综上所述,AKO在UC小鼠肠道中表现出显著的抗氧化功能。AKO激活Nrf2/Keap1信号通路中蛋白和基因表达,增强体内抗氧化酶的活力,减轻机体氧化应激,并降低炎症反应和维持肠道屏障功能。这些结果揭示了AKO在UC小鼠中的保护作用及可能抗氧化机制,可为AKO作为功能性食品或其他辅助材料提供参考,也为海洋资源的开发和利用提供启发。
- 食品科学的其它文章
- 花中多糖化学组成与生物活性研究进展
- 番茄碱的制备及其对乙酰胆碱酯酶的抑制作用
- 色氨酸抑制体外模型中晚期糖基化终末产物形成机理
- 松油烯-4-醇对荧光假单胞菌抑菌能力及作用机理
- Widely Targeted Metabolomic and Transcriptomic Analyses Reveal the Regulation of Trypsin on Antioxidant Enzymes and Saturated Fatty Acids in Hylocereus undatus Fruit during Storage
- 乙烯利处理‘赤霞珠’葡萄果实对其葡萄酒中酚类物质组分的影响

