超高压和巴氏杀菌对蛋清蛋白结构及起泡性能的影响
张根生,刘欣慈,岳晓霞,丁一丹,赵陈美慧,勾凤琦,吕云雄,2,*
(1.哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150028;2.弥勒市朋普镇人民政府,云南 弥勒 652300)
超高压杀菌(ultra high pressure sterilization,UHPS)属于非热杀菌技术,通常采用水作为传压介质,在100~1 000 MPa的高压下对密封食品进行处理[1],通过破坏细胞膜和细胞壁[2]、干扰蛋白质稳态[3]、影响酶活性[4-5]、影响遗传机制[6]和细胞形态[7]来杀灭食品中的有害微生物,具有对食品品质的关键成分破坏性较小[8]、不改变共价键等优点[9]。
蛋清含有88%(质量分数,下同)的水、11%的蛋白质、0.2%的脂肪和0.8%的灰分,其蛋白质组分是多种蛋白质组分的复合混合物,包括卵白蛋白(54%)、卵转铁蛋白(12%~13.6%)、卵类黏蛋白(11%)、卵黏蛋白(3.5%)、溶菌酶(3.4%~3.5%)和其他100多种蛋白质组分,它们都在决定蛋清的功能特性方面发挥重要的作用[10]。目前已有大量的研究证实了UHPS技术对蛋清等蛋制品有杀菌效果。杨瑞香[11]对蛋清UHPS条件及效果进行了研究,发现在高染菌情况下(大肠杆菌总数不低于107CFU/mL),300 MPa、7.5 min高压处理可将大肠杆菌总数降低至符合GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》要求(大肠杆菌总数不高于102CFU/mL)。Tóth等[12]以蛋清为原料,研究了200~350 MPa压力下微生物数量和蛋白质变性情况,发现此条件下微生物数量被控制在104CFU/mL以下,同时差示扫描量热法分析结果表明处理后的蛋清蛋白未变性。然而不同学者针对超高压对蛋白质的影响所得结论不同,Andrassy等[13]报道称250~400 MPa的压力会导致蛋清蛋白凝聚变性;Yamamoto[14]也发现300 MPa的压力会导致蛋白质凝聚变性。而Frydenberg等[15]报道称变性后的蛋白质经稀释可能会促进未折叠蛋白质重新折叠成天然状态。目前,在有效的UHPS条件下,蛋清蛋白质是否会变性尚未有统一的结论,国内对UHPS处理后蛋清蛋白质结构变化方面的研究也较少。
基于上述研究现状,本实验以市售鲜蛋制备得到的蛋清为原料,经超高压和巴氏杀菌处理,室温静置48 h(杀菌后静置24 h,磷酸盐缓冲溶液或蒸馏水稀释后再静置24 h),通过圆二色光谱、紫外光谱、荧光光谱和动态光散射激光粒度仪等进行表征,研究不同压力(200~300 MPa)和保压时间(2.5~12.5 min)下,超高压和巴氏杀菌对蛋清蛋白的构象、粒径、表面电位、起泡特性的影响;同时基于杨瑞香[11]的研究结果(300 MPa保压7.5 min),比较不同杀菌方法对蛋清蛋白的影响。
1 材料与方法
1.1 材料与试剂
鲜蛋 哈尔滨市北京华联超市;无菌袋 常州优坦生物科技有限公司;磷酸氢二钠、磷酸二氢钠(均为分析纯) 天津市天力化学试剂有限公司。
1.2 仪器与设备
ALPHA2-4 LD plus冷冻干燥机 德国Christ公司;Chirascan圆二色光谱仪 英国应用光物理公司;Nano-ZS-90激光粒度仪 英国马尔文仪器有限公司;F-7000荧光光谱仪 日立仪器(上海)有限公司;Spectrum Two傅里叶变换近红外光谱仪、LAMBDA 365紫外光谱仪美国珀金埃尔默股份有限公司;HHP-L2-600-L超高压食品处理机 上海诗斯自动化设备有限公司。
1.3 方法
1.3.1 蛋清的制备
鲜蛋洗净,打蛋去壳取蛋清,挑除蛋清中残留系带,使用搅拌器搅打均匀,装入无菌袋(100 mL/袋),封口待用。
1.3.2 样品的制备
将蛋清放入60 ℃水浴箱中处理3.5 min[16],得到巴氏杀菌蛋清。使用超高压食品处理机,将蛋清分别在200、250 MPa和300 MPa压力下保压2.5、5.0、7.5、10.0、12.5 min,得到UHPS蛋清。分别取50 mL巴氏杀菌蛋清、鲜蛋清、UHPS蛋清于室温静置24 h,-80 ℃预冻48 h后冷冻干燥得到蛋清冻干粉备用。
1.3.3 圆二色光谱测定
参照Ding Lixian等[17]的方法并作适当修改进行圆二色光谱测定。用磷酸盐缓冲溶液(pH 7.2、10 mmol/L)将蛋清冻干粉配制成0.2 mg/mL蛋清溶液,静置24 h后使用具有0.1 cm光程的石英比色皿,光谱分辨率为0.5 nm,扫描速率为100 nm/min,响应时间为0.25 s,带宽为1 nm,在25 ℃下分析190~250 nm波长范围的圆二色光谱信号。
1.3.4 傅里叶变换红外光谱分析
参考曾剑华等[18]的方法,将1 mg蛋清冻干粉与溴化钾粉末混合磨粉并压制成片,进行傅里叶变换红外光谱全波段扫描,设定参数为扫描次数32 次,扫描范围为4 000~400 cm-1,分辨率为4 cm-1。采用Peakfit软件对蛋白酰胺I带(1 700~1 600 cm-1)进行二阶导数、去卷积和高斯曲线拟合,根据峰面积计算二级结构相对含量。
1.3.5 紫外光谱测定
参照汪吴晶等[19]的方法并作适当修改进行紫外光谱测定。用磷酸盐缓冲溶液(pH 7.2、10 mmol/L)将蛋清冻干粉配制成0.1 mg/mL蛋白溶液,静置24 h后使用光程为1 cm的石英比色皿在25 ℃进行波长范围为240~400 nm的紫外光谱扫描。
1.3.6 荧光光谱测定
用磷酸盐缓冲溶液(pH 7.2、10 mmol/L)将蛋清冻干粉配制成0.2 mg/mL蛋白溶液,静置24 h后使用光程为1 cm的石英比色皿进行扫描。扫描条件:激发波长为290 nm,发射波长范围为300~460 nm。激发和发射狭缝宽度为2.5 nm,扫描速率为1 200 nm/min。
1.3.7 蛋清粒径和多分散系数的测定
用磷酸盐缓冲液(pH 7.2、10 mmol/L)将蛋清冻干粉配制成1 mg/mL蛋白溶液,静置24 h后12 000 r/min离心10 min,取上清液过0.45 μm水系醋酸纤维素滤膜。通过Nano-ZS-90激光粒度仪测定蛋清粒径和多分散系数(polydispersity index,PdI),测定温度为25 ℃、平衡时间为120 s、分散相折射率为1.471、分散剂折射率为1.330。
1.3.8 蛋清表面电位测定
用磷酸盐缓冲液(pH 7.2、10 mmol/L)将蛋清冻干粉配制成1 mg/mL蛋白溶液,静置24 h后通过Nano-ZS-90激光粒度仪测定蛋清表面电位,测定条件:温度25 ℃、平衡时间120 s、分散相折射率1.471和分散剂折射率1.330。
1.3.9 蛋清起泡性和泡沫稳定性测定
用蒸馏水配制100 mL质量浓度为5 mg/mL的蛋清液,用搅拌器以2 500 r/min的转速搅打1 min,记录搅打结束时和结束10 min后泡沫体积,按式(1)和式(2)分别计算起泡性和泡沫稳定性。

式中:V为蛋清液体积/mL;V0为搅打结束时泡沫体积/mL;V1为搅打结束10 min后泡沫体积/mL。
1.4 数据处理与分析
采用SPSS和Origin 2018软件分别对数据进行处理、绘图。显著性分析采用Duncan’s法,以P<0.05表示差异显著。
2 结果与分析
2.1 UHPS对蛋清二级结构的影响
UHPS和巴氏杀菌处理得到的蛋清蛋白,其圆二色光谱变化如图1所示,加压处理后蛋清蛋白的二级结构明显发生改变,且随着压力的增加而增加。圆二色光谱在208 nm和222 nm区域显示出的负峰是α-螺旋蛋白的特征峰[20],这些区域谱线的振幅均有较大幅度的增加,即α-螺旋圆二色性信号强度增加。表明UHPS处理后α-螺旋的比例有所增加,这与Zhang Zhong等[21]的研究结果一致。就保压时间对蛋清蛋白结构影响而言,圆二色光谱信号强度随保压时间的延长变化较小,表明二级结构的改变受保压时间影响较小。与之相比,巴氏杀菌的圆二色性信号强度与未处理蛋清更接近,表明巴氏杀菌可能对蛋清蛋白的影响更小。
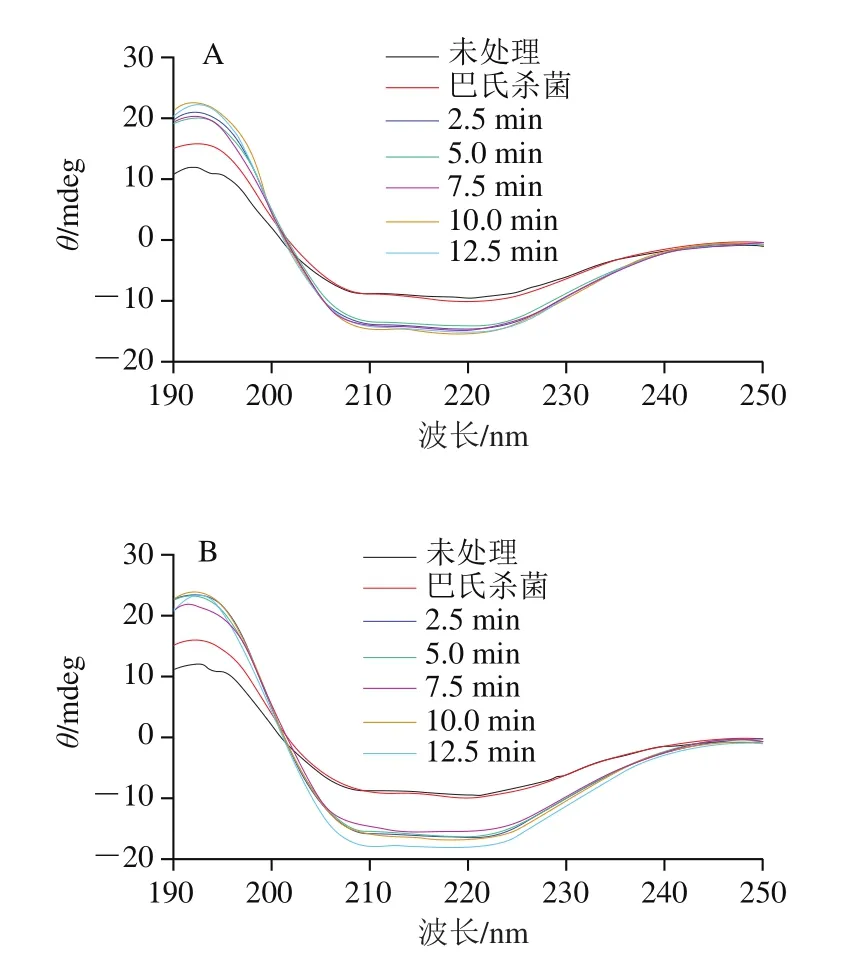
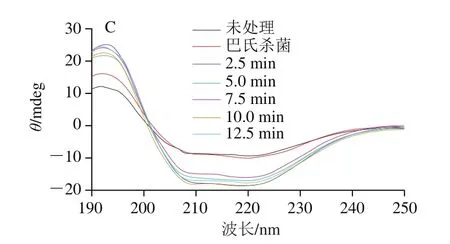
图1 杀菌处理对蛋清圆二色光谱的影响Fig.1 Effect of sterilization treatment on CD spectrum of egg white protein

表2 250 MPa对蛋清二级结构含量的影响Table 2 Effect of UHP sterilization at 250 MPa on secondary structure contents of egg white protein
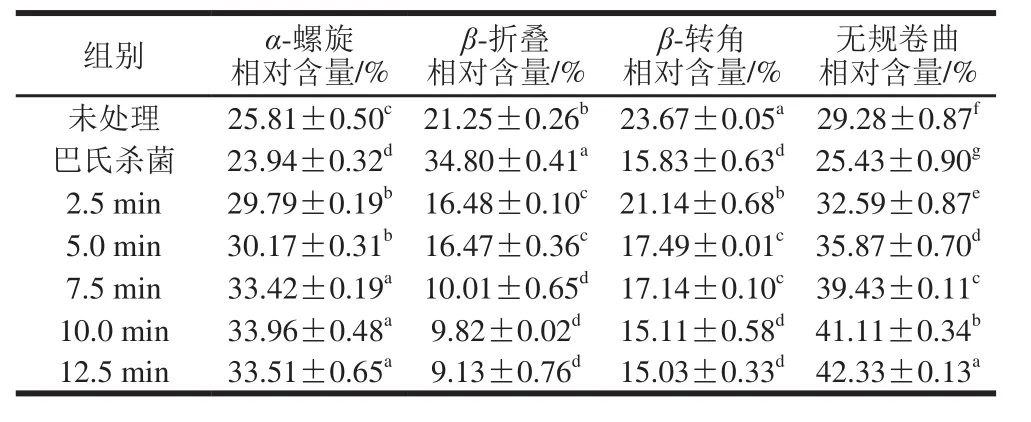
表3 300 MPa对蛋清二级结构含量的影响Table 3 Effect of UHP sterilization at 300 MPa on secondary structure contents of egg white protein
如表1~3所示,蛋清蛋白二级结构中α-螺旋和无规卷曲相对含量随压力增加和保压时间的延长而明显增加,这与圆二色光谱的结果一致。在二级结构中,α-螺旋肽段主链上每个氨基酸残基的N—H基团与顺序螺旋结构第4个氨基酸残基上的C=O基团形成氢键,代表的是一种有序结构[22]。通常来说,UHHP会破坏氢键,而压力处理却增加了这种有序结构的数量,Zhang Zhong等[21]也报道了压力会诱导α-螺旋含量增加的结论,但未就此作出相关阐述,该原因有待进一步研究论证。无规卷曲相对含量的增加表明UHPS处理后形成了更松散的二级结构[23]。压力的增加和保压时间的延长也明显降低了β-折叠和β-转角相对含量,He Xiaoye等[24]的研究也发现高压会降低β-折叠含量。与巴氏杀菌相比,UHHP处理对蛋清蛋白各种二级结构相对含量的影响更大,这也与圆二色光谱的结果一致。

表1 200 MPa对蛋清二级结构相对含量的影响Table 1 Effect of UHP sterilization at 200 MPa on secondary structure contents of egg white protein
综上,UHHP处理对蛋清蛋白二级结构造成了不可逆的破坏(这种破坏在静置48 h后仍能被检测到),并且与巴氏杀菌相比,这种破坏程度更剧烈。
2.2 UHPS对蛋清三级结构的影响
如图2所示,通过荧光光谱可以看出蛋清蛋白质三级结构易受压力和热(巴氏杀菌)处理影响。在同一压力下,随着保压时间的延长,荧光强度先增加后降低,在200 MPa和250 MPa保压12.5 min,300 MPa保压10 min和12.5 min时荧光强度明显降低,这可能是压力诱导基团过度暴露,发生荧光猝灭所致[25]。已有研究证明赖氨酸、组氨酸和半胱氨酸残基具有猝灭色氨酸残基荧光的能力,UHPS处理可以使这些残基更接近色氨酸残基[26],Chen Gang等[27]也认为蛋白质荧光强度的变化与氨基酸残基在色氨酸周围的运动有关。较高压力诱导蛋白质聚集,将荧光基团重新包埋,并且在同一时间下压力越大,结构破坏程度越严重。这与圆二色光谱和傅里叶变换红外光谱观察到的短时变性结果不同,可能是因为二级结构的压敏性更强。杨瑞香[11]的研究结果表明在300 MPa、7.5 min时,可将高染菌(大肠杆菌总数不低于107CFU/mL)蛋清中的微生物杀灭至符合GB 4789.3—2016要求。与巴氏杀菌蛋清相比,300 MPa保压7.5 min的蛋清蛋白荧光强度接近未处理蛋清,对三级结构造成的破坏程度较巴氏杀菌更低。总的来说,荧光光谱表明UHPS处理对蛋清蛋白的三级结构造成了破坏,与巴氏杀菌相比,300 MPa保压7.5 min的影响较小。


图2 杀菌处理对蛋清荧光光谱的影响Fig.2 Effect of sterilization treatment on fluorescence spectrum of egg white protein
在250~265 nm范围内的吸收峰对应苯丙氨酸残基,在265~280 nm范围内的吸收峰对应酪氨酸-色氨酸电子相互作用,在285 nm以上的吸收峰被认为是由色氨酸引起[28]。如图3所示,在200 MPa下紫外吸收强度随保压时间延长而增加,在250~300 nm处的吸收峰强度逐渐增大,表明随着200 MPa保压时间的延长,酪氨酸、色氨酸和苯丙氨酸残基暴露量不断增加。250 MPa处理下紫外吸收峰强度随保压时间延长呈先明显增加后趋于平缓的趋势,这可能是由于在处理10 min和12.5 min时,3 种氨基酸残基已充分暴露,吸收峰不随时间延长而扩大。而300 MPa下,吸收峰之所以在12.5 min呈现出了降低的趋势,可能是因为长时高压诱导蛋白质形成聚集体,将已暴露的基团重新包埋,导致吸收峰强度降低。通过紫外光谱分析发现,压力的增加和保压时间的延长,导致蛋白三级结构变性,这与图2荧光光谱的分析结果一致。与巴氏杀菌相比,300 MPa保压7.5 min后,蛋白紫外吸收度和未处理蛋清更接近,即该压力下对蛋清影响更小。值得注意的是,巴氏杀菌对三级结构造成的结构破坏在紫外光谱中的变化并不明显,这表明热诱导变性后吸光度变化小,而荧光性变化大,即热诱导和压力诱导的变性机制不同。综上所述,UHPS处理对蛋清蛋白三级结构造成了破坏,与巴氏杀菌相比,300 MPa保压7.5 min的影响更小。


图3 杀菌处理对蛋清紫外光谱的影响Fig.3 Effect of sterilization treatment on UV spectrum of egg white protein
2.3 UHPS对蛋清粒径的影响
粒径反映溶液体系小颗粒物质的平均大小,PdI反映粒度的分布情况,PdI越小,小颗粒物质分布越均匀。如图4所示,未处理的蛋清平均粒径为225.5 nm,PdI为0.642。粒径随保压时间的延长呈先增加后下降的趋势。在UHPS处理后,小分子聚集形成蛋白质聚集体[29],所以粒径随保压时间延长和压力增加而增大。然而在时间超过7.5 min后,3 种压力条件下的蛋清粒径突然降低,这可能是由于压力诱导聚集体不断增大,泄压时压力瞬间释放导致粒径较大的聚集体被破坏、蛋白质颗粒被粉碎,从而减小了粒径。Wang Chunyan等[30]也发现了相似的现象,即压力增大,使蛋白链被破坏,蛋白质粒径随压力增加而降低。也正是因为这一原因,随着压力增加,较大的聚集体被破坏,产生了小颗粒物质均匀分布的现象,使PdI逐渐降低,与巴氏杀菌对比可以看出,300 MPa、7.5 min条件下,UHPS对蛋清粒径的影响和巴氏杀菌处理近似,但UHPS处理后的PdI更低,小分子物质粒径更均匀。

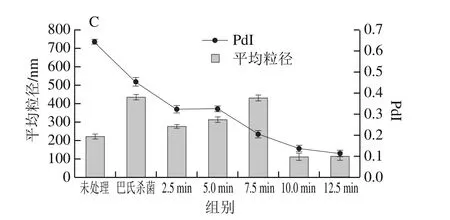
图4 杀菌处理对蛋清粒径的影响Fig.4 Effect of sterilization treatment on particle size of egg white protein
2.4 UHPS对蛋清表面电位的影响
蛋白质由于表面基团的电离而带有表面电荷,这些电荷表现为蛋白分子的表面电位,表面电位的差异反映了带电基团暴露水平的不同[31]。如图5所示,200 MPa和250 MPa下随时间延长,表面电位逐渐增加,这是由于长时高压导致蛋白质展开,暴露出带电基团,从而增强分子间的静电排斥力,破坏现有的蛋白质聚集体,抑制进一步的聚集,电位增加的趋势表明静电排斥力增强,蛋清的物理稳定性更好[32]。然而在300 MPa下,随时间延长表面电位出现了先增加后降低的情况,可能是由于较高压力和较长保压时间下,蛋白质形成聚集体,将已暴露出的基团重新包埋,进而降低了电位[24]。这与图4平均粒径变化结果一致。与巴氏杀菌和未处理蛋清对比可以看出,300 MPa、7.5 min处理后的蛋清表面电位更高,体系更稳定,更有利于后期蛋清贮藏。

图5 杀菌处理对蛋清表面电位的影响Fig.5 Effect of sterilization treatment on zeta potential of egg white protein
2.5 UHPS对蛋清起泡性和泡沫稳定性的影响
起泡性主要与蛋白质在空气-水界面形成膜的能力有关。因此起泡性和泡沫稳定性由静电和疏水相互作用以及二硫键稳定性决定[33]。圆二色光谱、傅里叶变换红外光谱、紫外光谱和荧光光谱已经证实了压力会破坏蛋白质二、三级结构,导致蛋白质分子更适合吸附空气-水界面的气泡。如图6所示,未处理的蛋清起泡性为107%,泡沫稳定性为68%。经200 MPa处理后,蛋清起泡性和泡沫稳定性随时间延长而增加;在250 MPa下,起泡性和泡沫稳定性先逐渐增加,而保压10 min后由于小分子物质大量聚集体,变化趋于平缓;300 MPa处理下,7.5 min前,随时间延长而起泡性和泡沫稳定性增加,小分子物质大量聚集将疏水基团重新包埋,降低了蛋白分子的表面疏水性及在水相-气相界面的稳定趋势,不利于气泡生成和保持,所以起泡性和泡沫稳定性呈下降趋势。和未处理的蛋清相比,巴氏杀菌后起泡性降低、泡沫稳定性增强,与Gharbi等[34]的研究结果一致。可能是由于热诱导和压力诱导的蛋白变性机制不同,巴氏杀菌破坏了蛋白质的主要结构(以共价键连接的氨基酸序列)[35],蛋白质变性凝结、溶解度降低,导致起泡性降低,同时巴氏杀菌促进了疏水基团的暴露,所以其泡沫稳定性得以提升。与之相比,300 MPa、7.5 min处理起泡性得以提升,泡沫稳定性接近。这一压力条件对于起泡性和泡沫稳定性的提升效果优于巴氏杀菌。
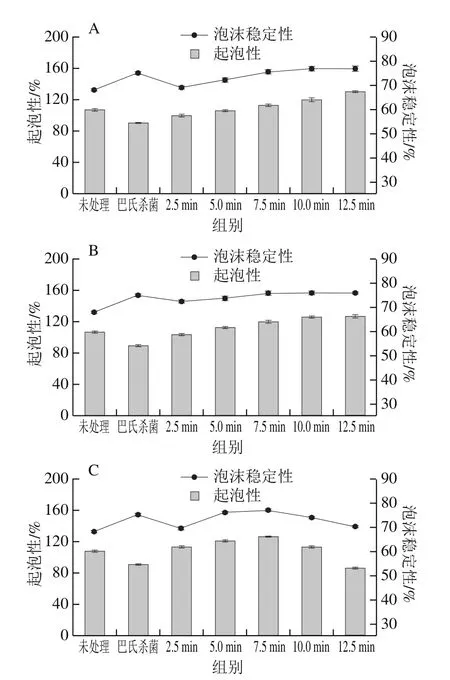
图6 杀菌处理对蛋清起泡性和泡沫稳定性的影响Fig.6 Effect of sterilization treatment on foaming capacity and foam stability of egg white protein
3 结 论
本实验结果表明,超高压和巴氏杀菌均对蛋清蛋白的二级、三级结构造成了不可逆的破坏。随着压力的增加,α-螺旋和无规卷曲相对含量增大,β-折叠和β-转角相对含量降低;超高压处理后荧光强度低于鲜蛋,且荧光强度随压力的增加和保压时间的延长,先增加后降低;高压处理促使酪氨酸、色氨酸和苯丙氨酸残基暴露,但随着保压时间的延长,暴露的氨基酸残基又会被重新包埋。300 MPa保压7.5 min对二级结构的影响较巴氏杀菌更大,对三级结构的影响较巴氏杀菌更小;压力会诱导蛋清聚集,200 MPa和250 MPa下,随着压力的增加和保压时间的延长,蛋清粒径先增大后减小,且分布均匀,起泡性及泡沫稳定性逐渐增大,300 MPa保压7.5 min的粒径与巴氏杀菌接近,体系更均匀,表面电位更高,更有利于贮存;随着压力的增加和保压时间的延长,300 MPa保压7.5 min的起泡性能较巴氏杀菌更好。
- 食品科学的其它文章
- 花中多糖化学组成与生物活性研究进展
- 番茄碱的制备及其对乙酰胆碱酯酶的抑制作用
- 色氨酸抑制体外模型中晚期糖基化终末产物形成机理
- 松油烯-4-醇对荧光假单胞菌抑菌能力及作用机理
- Widely Targeted Metabolomic and Transcriptomic Analyses Reveal the Regulation of Trypsin on Antioxidant Enzymes and Saturated Fatty Acids in Hylocereus undatus Fruit during Storage
- 乙烯利处理‘赤霞珠’葡萄果实对其葡萄酒中酚类物质组分的影响

