浅谈医疗器械的命名、分类和编码
罗键 柯宇星 张岭梅 南方医科大学附属深圳妇幼保健院医疗设备科 (广东 深圳 518028)
内容提要:文章对医疗器械在用且涵盖面相对广的命名、分类和编码进行分析,发现了三个环节存在的不足并提出了建议。
医疗器械指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件[1]。经过改革开放40余年的发展,我国医疗器械产业也从以往的“基础薄弱”蓬勃发展到今日的“门类齐全”。2019年我国的医疗器械销售额已达到4596亿人民币,占全球医疗器械市场约13.2%,连续多年保持15%~20%的增长率。
由于粗放式的管理,医疗器械在管理上并没有做到精细化。《医疗器械监督管理条例》(以下简称《条例》)于国务院第119次常务会议修订通过,自2021年6月1日起施行。以及其配套法规的完善对医疗器械全生命周期管理提出了更高的要求。医疗器械种类、品规繁多、学科跨度大和专业性强,每一个医疗器械本身包含的相关信息之多,生命周期之长。命名、分类和编码的基础性工作是全生命周期精细化管理的基石,凸显不可或缺的地位。
医疗器械现有的命名不准确、不规范、不系统,现有的分类标准和编码不能满足全生命周期管理的全部应用诉求。全生命周期管理工作只能各自形成体系,一旦涉及不同系统间数据交互就没有一个连通的桥梁,时时刻刻出现着信息孤岛,生命周期里的各环节断档,精细化管理难以有效执行。
1.医疗器械命名、分类和编码
1.1 三者间的联系
命名、分类、编码一般是从前到后的顺序。首先对某个医疗器械确定名称,而后根据共同属性分类,最后赋予编码。编码按照唯一性为原则,命名按照普遍性为主,唯一性为辅,分类依据普遍性。三者是唯一性与普遍性交织的关系,是构成医疗器械分类目录的重要部分。用整体的眼光做好系统性的设计,命名、分类、编码工作才能顺利的进行。
1.2 命名
1.2.1 命名的作用
①明确医疗器械与非医疗器械界线,确定可以划分为医疗器械的物品。②利于医疗器械的风险级别管理,提高监督管理效率。
1.2.2 名称
现有名称大致可分类为:专名、通用名。专名是词语指称只应用于单独客体,通用名是词语指称应用于具有相同特征的客体[2,3]。不同名称所指范围见表1。

表1.专名和通用名所指范围
1.2.3 命名的不足
同类别的产品重复申报的情况导致市面上的名称五花八门,同种产品多种名称,多种产品一个名称,对细化界定分类工作造成相当不便。在《医疗器械通用名称命名规则》(以下简称《规则》)实施前并没有命名的相关规定,实施后明确了应当使用通用名称。但《规则》实施前已有的名称已流通使用。《医疗器械通用名称命名指导原则》与16项明细到类别的指导原则对《规则》进行了补充,但各方对于核心词和特征词的理解未达到一致。可能出于各方的考虑角度不同,对名称的诉求不同,指导原则都不作为法规强制执行。且暂未出现通用名称汇总目录可以进行参照,予以理想化的实施还需不断学习改进。
1.3 分类
1.3.1 分类的作用
按照选定的属性(或特征)区分医疗器械,将具有某种共同属性(或特征)的医疗器械集合在一起便于进行系统性的管理[4]。
1.3.2 分类
WS/T118-1999《全国卫生行业医疗器械、仪器设备(商品、物资)分类与代码》(表2)。该分类标准由中华人民共和国卫生部在1999年1月21日发布,1999年7月1日实施。在WZB01-90《全国卫生系统医疗器械、仪器设备(商品、物资)分类与代码》基础上勘误、修改并补充加以延拓、细化[5]。由于制定年代久远,无法全面指导当前的医疗器械分类。
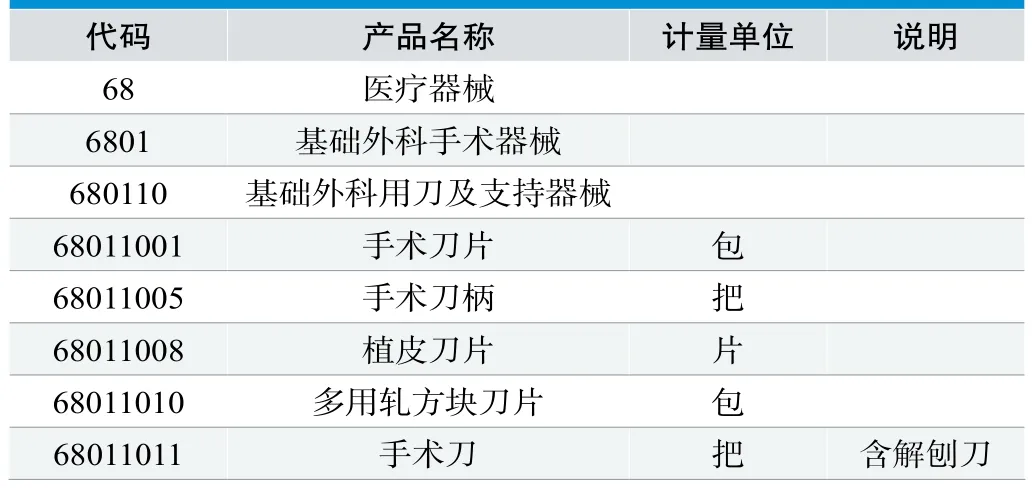
表2.《全国卫生行业医疗器械、仪器设备(商品、物资)分类与代码》
《医疗器械分类目录》(以下简称《目录》)(表3)。依据《条例》及《医疗器械分类规则》(第15号局长令)制定。我国实行的医疗器械分类方法是分类规则指导下的目录分类制,分类规则和分类目录并存,一旦分类目录已实施,应执行分类目录[6]。经过15年的修订后,对于监管方能比较好地对市面上出现的医疗器械进行了系统分类。

表3.17版《医疗器械分类目录》
1.3.3 分类的不足
医疗器械行业经过数十年的高速发展,产品种类增长迅速,技术复杂的产品不断涌现。现行分类规则不能很好地适应形势发展下各方的需求,例如:较为通用的《目录》的侧重点在于风险管理类别,而厂商、供应商、医疗机构等的诉求不止于此,参照《目录》进行分类会有界线模糊的情况。我国医疗器械实行分类分级管理,各级各地审批人员的知识结构、专业水平和综合判断能力等存在差异。特别自食品药品监管机构改革后,监管人员的调整变动大,审批监管人员队伍判定能力有差异[7]。出现同品种产品按不同类别判断,不利于医疗器械市场秩序发展。
1.4 编码
1.4.1 编码的作用
使用规定的数字或字母代指医疗器械特有的信息并将代指信息的数字或字母排列组合,成为确定该医疗器械的标志。
1.4.2 编码
编码可分为两类。一类是纯流水式无含义的编码,另一类是包含特定信息的编码。前者极少使用,绝大数是使用后者。
68系列码。《全国卫生行业医疗器械、仪器设备(商品、物资)分类与代码》和《医疗器械分类目录》这两个分类规则下使用的编码都是68系列码。《医疗器械分类目录》是国家药品监督管理局发布且《全国卫生行业医疗器械、仪器设备(商品、物资)分类与代码》是行业标准,且无其他编码可选用故该编码使用率较高。但是新增的医疗器械都无法准确归类所以导致没有对应编码,难以满足现代医用耗材管理的实际需要,有一定的局限性。
医保医用耗材编码。目前最新的国家医保编码于2019年6月27日“医保业务编码标准动态维护”上线试运行。编码结构见图1。所含要素详细到一个品规即一品一码,不能准确定位到具体的单个产品。医保医用耗材编码有另设7位流水号,笔者认为大致用途是对无法明细到逐个规格型号的一种补充。
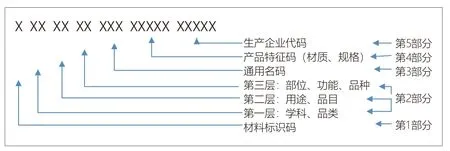
图1.医保医用耗材编码结构
医疗器械唯一标识UDI(表4)。国家药品监督管理局于2019年7月1日《医疗器械唯一标识系统试点工作方案》发布。由产品标识(DI)和生产标识(PI)组成,根据生产标识(PI)中的批次、序列号等详细信息是可以定位到单个产品的,根据医保医用耗材编码的7位流水号是可以实现与UDI做到相互映射。有一种理论认为UDI可能作为医疗器械编码的“一码通”,UDI是针对追溯工作的编码,在概念上广于医疗器械编码[8]。这是对追溯、监管、营销流通等概念混淆,在管理上产品质量监管、追溯和营销流通是有联系,但却又是目标迥异的应用诉求,不同的应用诉求,其编码方案应有不同。UDI在应用中需考虑追溯颗粒度,考虑成本效益,主抓风险管理类别高的医疗器械。
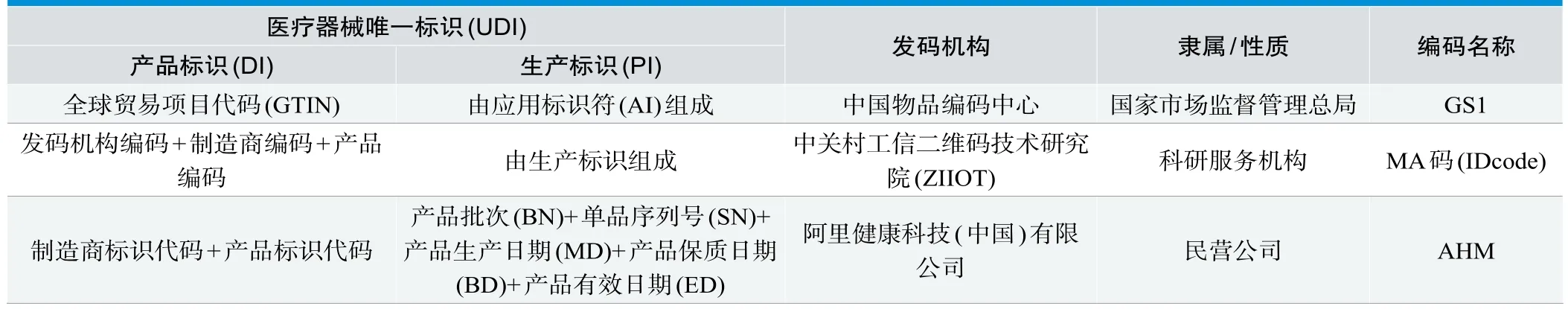
表4.UDI结构及国内发码机构
1.4.3 编码的不足
对于单个产品,现存的编码各家各异,院内不同部门使用的编码不同,不同医疗机构使用的编码不同,不同管理部门管理范围内使用的编码不同。在各个层面上出现一物多码。还有出现一码多物的情况。导致信息无法连通,无法交流。增加了沟通成本,降低了行政效率。
2.建议
2.1 对命名的建议
规范化、精细化命名规则,加强审批环节。避免技术原理、结构组成或者预期目的相同的产品有着不同的名称,避免同一个产品会出现不同名称的情况。根据《规则》要求使用通用名称,但通用名称的性质是普遍性的,参考FDA命名规则,结合我国特别的以通用名称为基准维度,可以使用一对一客体的例如商品名称等为辅维度。在名称上多维度去确定某个医疗器械。
对《规则》实施前已注册的医疗器械命名规范。对市面上现有的医疗器械进行汇总,多部门联合形成标准委员会充分考虑医疗器械不同生命周期内不同环节不同监管部门监督管理的要求。对现有的名称按照命名规则进行规整,向社会发布生产和经营企业对照后对其产品进行调整修改并上报至国家药品监督管理局。
参考日本医疗器械一般名称数据库(JMDN)先行经验,将建立的全新名称目录进行动态维护调整,加强公众知情权与信息共享[9]。加强对于全球医疗器械术语系统(GMDN)的学习认知并充分吸收其中优势用以借鉴。
2.2 对分类建议
影响医疗器械分类规则相关的要素有很多,比如:按临床要素分,按技术原理分,按产品形态分,按预期用途分,按风险管理类别分等。不同角度对分类的侧重点也不尽相同,比如:厂商更侧重于技术原理,供应商侧重于销售及国际化对接的兼容性,监管部门侧重于使用的安全性,医疗机构侧重于科室分布与管理便利实用性。为此,需要国家药品监督管理局组织进行新的医疗器械分类的研究。在设置分类规则前需要汇总现有的分类规则,分析共同之处,其次是汇总市场上现有的医疗器械所包含的要素和规律,最后是考虑的要素维度要足够多以便适应日益发展的医疗器械创新环境。
对审批监管人员队伍的管理,提高各级各地的审批人员对于最新医疗器械的知识学习,制度统一学习标准和督促学习进度。充分利用互联网建立信息平台加强资源共享。减少因为知识结构、专业水平和综合能力造成的对同一个医疗器械判断不相同的现象。为应对新技术使用,材料升级等新型医疗器械问世后可能出现的无法归类情况,需要不断修改调整分类规则。建立分类数据库,加强数据库的信息共享,审核的工作人员在遇到无法准确判断时可参考数据库给出初步意见并交由上级部门审定。
2.3 对编码建议
根据GB-T7027-2002《信息分类与编码的基本原则和方法》对信息编码的基本原则:唯一性、合理性、可扩充性、简明性、适用性、规范性。唯一性指在一个分类编码标准中,每一个编码对象仅应有一个代码,一个代码只唯一表示一个编码对象。但追溯、监管、营销流通等不同环节有着不同的应用诉求,各个环节下设的一个编码只是对应该环节下的一个编码对象,同一个医疗器械在不同环节就有不同的对应编码,增加沟通成本,建立医疗器械“一码通”的医疗器械编码可将信息整合,完善医疗器械行业的编码状况。
对于同一个医疗器械,在不同环节范围的不同生命周期阶段,统一使用一个编码。该统一编码具有唯一性,就犹如身份证号码一样,只需要查询该唯一编码,就可获得这个医疗器械的所有信息。在使用“一码通”编码后可提高办事效率和准确性。“一码通”编码的编制需要整合所涉及环节内的种种应用诉求,依据整合的应用诉求进行编码。根据适用性和可扩充性的原则,“一码通”编码同时也需要充分考虑衡量与国际医疗器械编码接轨以及为新问世的医疗器械赋予编码。
3.小结
全生命周期管理和监督医疗器械的基石是做好命名、分类和编码。三者间联系是非常密切,相互影响,彼此管束,需多维度超立体的统筹考虑。不断完善命名规则和动态的准入管理,源头上保证了医疗器械的界限、明确统一分类规则的制定和唯一编码的实施是医疗器械信息化管理过程的有力保障。使三者所构成的分类目录随行业发展的必然趋势不断迭代更新。在医疗改革深化的背景下。改进命名、分类和编码三个环节有利于各医疗机构对医疗器械的管理;有利于各平台的数据交互,集采平台中合理价格体系的建立从而打破因信息差带来的运营成本压力;有利于规范行业标准;有利于市、省、国家监管部门的统计和监管。

