致病蛋白Htt-exon1在大肠杆菌中表达及铜离子结合能力的检测
项 玲, 肖桂然
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
亨廷顿舞蹈病(Huntington’s disease,HD)是一种常染色体显性遗传神经退行性疾病,以舞蹈样不自主动作[1]和进行性智能衰退为特征[2]。临床上主要表现为运动、认知及精神3个方面的障碍而且进行性加重,发病年龄从童年到大于70岁不等,患者一般在中年(35~50岁)发病,发病后15~20 a后死亡[3-4]。但是到目前为止其致病机理仍不明确,并且尚无有效的治疗手段,目前主要治疗策略仍为对症治疗,包括减轻运动症状、改善认知功能、调整异常精神状态等[5]。
HD致病基因为IT15,代谢产物为亨廷顿蛋白(Huntingtin,Htt),Htt氨基端从第17位氨基酸残基开始有一段重复的谷氨酰胺(polyglutamine,polyQ)序列。该重复序列过度延长形成异常的享廷顿蛋白,会在神经细胞内聚集、沉淀,该现象被认为是该病发病的原因和关键[6]。它的长度在正常人群中短于36个,而在HD患者中突变的Htt的谷氨酰胺序列长度超过37个[7]。该疾病的发生和严重程度取决于polyQ片段的长度,polyQ片段越长,疾病开始得越早、病情越严重[8-9]。尽管近年来国际上对HD的研究非常活跃,但Htt突变后引起神经元死亡的分子机制尚不清楚[10-11]。研究发现,虽然整个亨廷顿蛋白分子量为350 kDa,但实际上含有polyQ的亨廷顿蛋白在体内需要被剪切成短的N端片段才能发挥毒性,而且病人脑中具有很多被截短的N端毒性片段,其中这些片段中大部分是exon1片段[10-11]。
有研究发现,多种神经退行性疾病患者脑内有过渡金属离子的失衡现象,包括锌离子、铁离子、铜离子和锰离子等。文献[12-14]表明,HD和金属的关系密切,病人和小鼠、大鼠模型脑中都发现铁离子和铜离子的异常升高;文献[15]表明铜离子能够促进体外表达的亨廷顿致病蛋白 N 端片段聚集。本课题组前期利用果蝇模型研究发现,脑内铜离子水平直接影响HD的进程[11]。课题组利用生物信息学研究发现,亨廷顿蛋白第1个外显子(Htt-exon1)上存在可能与金属离子结合的位点,但是没有直接证据[16]。
本课题组从Htt-exon1入手,通过基因工程手段得到体外表达的GST融合蛋白GST-Htt-exon1,借助于GST标签,将此蛋白分离纯化成功,得到纯化的Htt-exon1,并且进一步借助于电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)技术检测其与铜离子的结合能力,发现该蛋白能够与铜离子直接结合。本文推测铜离子在体内通过直接与该致病蛋白结合促进其聚集,加重其毒性,促进疾病进程。该研究对于探究该致病蛋白产生毒性的分子机制至关重要,为后续疾病的防治及药物靶点的寻找奠定了坚实的基础。
1 材料与方法
1.1 材料
1.1.1 宿主菌和载体
大肠杆菌感受态菌株DH5α、DE3购于北京全式金生物技术有限公司; pGEX-6p-2载体由清华大学生命科学学院周兵实验室馈赠。
1.1.2 主要试剂
EasyTaq DNA Polymerase、BamHⅠ和HindⅢ限制性快速内切酶、T4 DNA Ligase buffer、dNTP mix、Trans2K Plus DNA Marker、T4 DNA Ligase、6×DNA loading buffer、蛋白Marker、5×Protein loading buffer、无菌水等均购于北京全式金生物技术有限公司;GST重力预装柱购自 Novagen 公司;异丙基-β-D-硫代半乳糖(IPTG)、氨苄青霉素、考马斯亮蓝R-250、琼脂糖、TAE、溴化乙锭均购于上海生工生物工程股份有限公司;GST Bind Resin 和填料柱购于Novagen 公司;PVDF 膜购于Millipore 公司;显色试剂购于碧云天公司。引物合成及序列测定由上海生工生物工程股份有限公司完成;ICP-MS由清华大学分析测试中心完成。
1.1.3 主要仪器
高压蒸汽灭菌锅购于北京勤诚盛达科学仪器有限公司;电热恒温水浴锅购于上海精宏实验设备有限公司;超净工作台购于上海智城分析仪器制造有限公司;高速冷冻离心机购于Beckman Coulter,USA;超低温冰箱购于Thermo Fisher scientific;凝胶成像系统购于上海天能科技有限公司;基因扩增仪、恒温培养振荡器、脱色摇床、电热恒温培养箱、微量移液器等。
1.2 方法
1.2.1 原核表达载体的构建
设计聚合酶链式反应(polymerase chain reaction,PCR)引物如下。
上游引物 F:
5′-ATGGCGACCCTGGAAAAGCTGATGAAG-3′;
下游引物R:
5′-CGGTCGGTGCAGCGGCTCCTCAG-3′。
选用BamH Ⅰ和Hind Ⅲ2个酶切位点。 以含有42个polyQ的Htt-exon1 polyQ42 转基因果蝇P463及对照[17]的cDNA为模板,通过 PCR 扩增、双酶切、凝胶回收后连接到载体pGEX-6p-2上构成重组质粒,并转化大肠杆菌 DH5α 感受态细胞, 挑选阳性克隆进行 PCR 和测序鉴定。借助于PCR过程中CAG的高度重复,获得含有10个polyQ的Htt-exon1 polyQ10和含有42个polyQ的毒性蛋白Htt-exon1 polyQ42共2种片段。
1.2.2 重组蛋白的原核表达
将测序后鉴定正确的重组质粒转化到 BL21(DE3) 感受态细胞中,配制 LB 液体培养基,挑选阳性单克隆接种到含有 LB 液体培养基的1.5 mL EP 管过夜,第 2天 早上转接到 10 mL LB 培养基扩大培养,培养至OD600达到 0.4 ~0.6 时,加IPTG 至终浓度为 0.5 mmol/L,18 ℃诱导14 h,25 ℃诱导7 h,离心收集菌体,超声破碎菌体获取上清。SDS-PAGE 电泳检测表达结果,比较不同条件下表达菌表达的蛋白量。
1.2.3 重组蛋白的表达检测
12 000 r/min、10 min离心收集菌体, Tris-HCl 洗涤菌体,将样品置于冰上,超声破碎至样品清亮。先留取一部分全蛋白,然后在12 500 r/min条件下离心20 min,离心后分别留上清液和沉淀。用考马斯亮蓝染色法进行检测。
1.2.4 重组蛋白的纯化
利用带有GST的标签蛋白与琼脂糖介质上交联的谷胱甘肽配体互补性结合,用上清液注到柱子上进行纯化,重组蛋白。利用蛋白酶PP在其位点进行特异性切割,收集切割后纯化的蛋白液。用考马斯亮蓝染色法进行蛋白定量并且将全蛋白、上清液、沉淀及纯化后的重组蛋白进行考马斯亮蓝染色。
1.2.5 Western Blot 鉴定
按1.2.4 所述方法分离纯化得到的Htt-exon1 polyQ10、Htt-exon1 polyQ42与转空载体的 BL21 裂解上清液进行 SDS-PAGE 电泳,转膜,用 5% 脱脂奶粉 4 ℃封闭过夜,加入用 PBST(PBS缓冲盐-0.5%吐温20)溶液稀释的鼠 ANTI-Htt-exon1 一抗(Sigma, 3B5H10),室温轻摇 2 h,PBST 洗膜 3 次,每次 5 min;加入羊抗鼠IgG (BOSTER,BA1031),室温轻摇 2 h,PBST 洗膜 3 次,每次 5 min;显色液显色,观察 PVDF 膜上的显色条带。
1.2.6 重组蛋白与铜离子的结合能力检测
按 1.2.4 所述方法分离纯化得到Htt-exon1 polyQ10和Htt-exon1 polyQ42,将蛋白样品硝化溶解于 15% 稀硝酸中,采用ICP-MS测定铜离子的质量浓度。每个样品重复 3 次,数据用 Graph Pad Prism 6.0 进行分析。
2 结果与分析
2.1 Htt表达载体的构建分析
以cDNA为模板扩增Htt-exon1 polyQ,样品PCR反应扩增出的特异性条带,结果显示,扩增片段条带清晰、大小正确,与Htt-exon1片段相符,初步推断已扩增出目的基因片段。用限制性内切酶BamH Ⅰ和Hind Ⅲ切割目的基因和pGEX-6p-2载体,酶切后进行琼脂糖凝胶电泳检测,如图1所示。图1中,M代表marker;1、2分别代表Htt-exon1 polyQ10的PCR扩增条带及酶切条带;3、4分别代表Htt-exon1 polyQ42的PCR扩增条带及酶切条带。
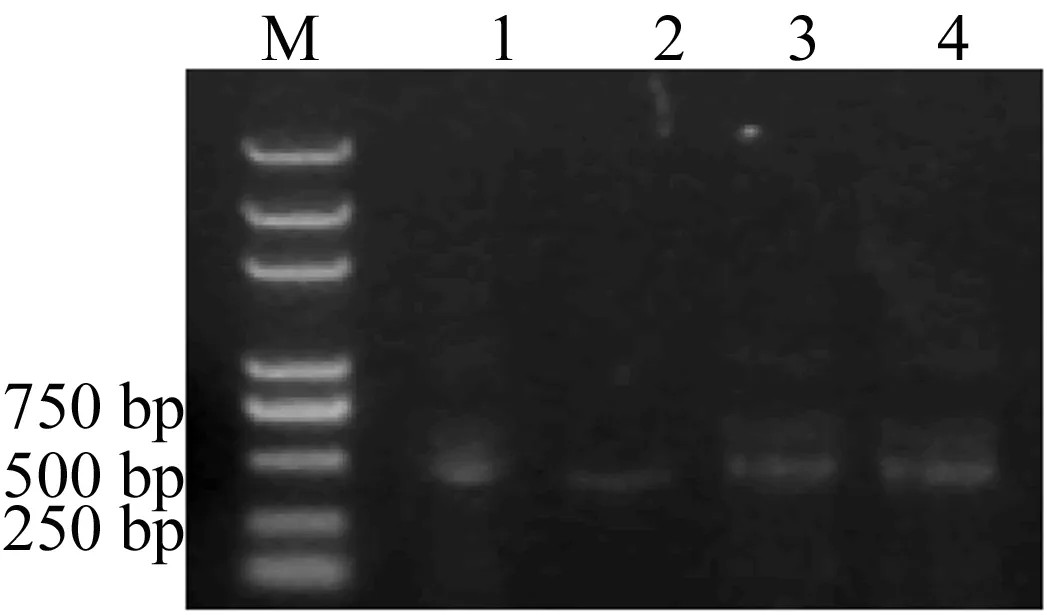
图1 扩增片段及酶切回收后的电泳检测
将酶切过的基因和载体用T4 DNA连接酶于16 ℃金属浴中过夜连接,得到重组质粒pGEX-6p-2 Htt-exon1 polyQ,如图2所示。
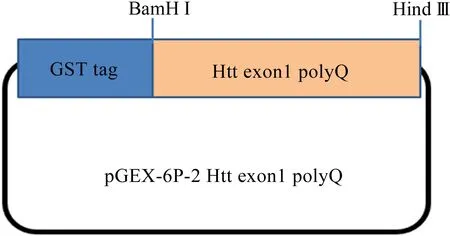
图2 重组质粒 pGEX-6p-2 Htt-exon1 polyQ的结构示意图
将重组质粒转入克隆载体E.coliDH5α,用含有100 g/L氨苄青霉素的LB平板筛选阳性单克隆,结果如图3所示,由图3可知,大肠杆菌在琼脂培养基上的菌落形态为圆形,表面光滑,半透明,小凸起。可以判断平板上生长的是大肠杆菌,且未被杂菌污染。

图3 转化后的克隆载体DH5α
挑取单克隆进行菌落PCR鉴定并进行电泳检测,鉴定结果如图4所示。图4中,M代表marker。由图4可知,挑选的部分单菌落为阳性菌落,扩增后条带大小不一致,这是由于Htt-exon1中含有大量CAG重复,在扩增的过程中会有变化,导致不同长度的CAG重复数目产生,本文利用这一原理,在一个模板的帮助下,获取不同长度的Htt-exon1 polyQ。
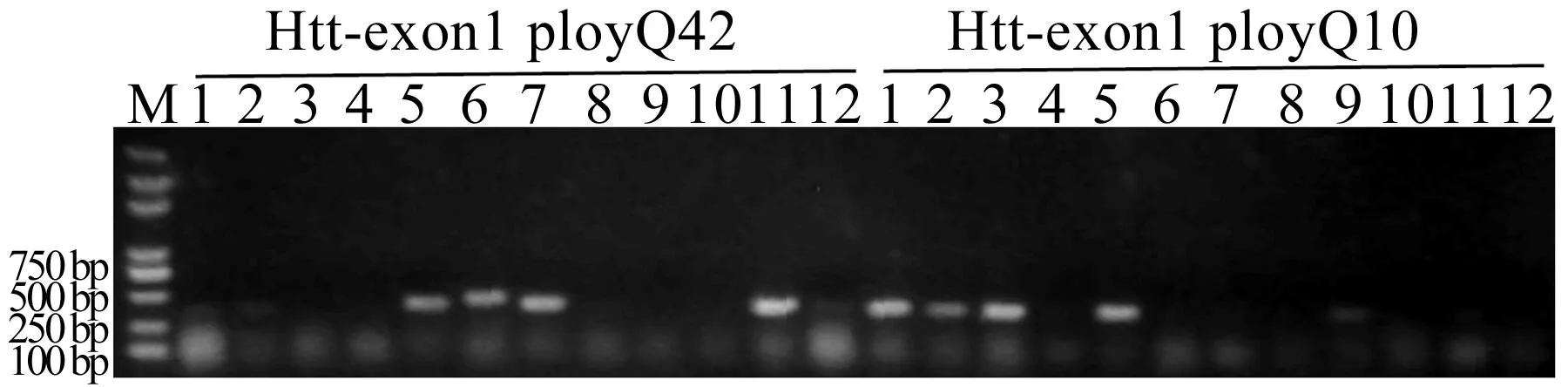
图4 菌落PCR的电泳图
2.2 GST-Htt exon1 polyQ的原核表达分析
将阳性克隆的重组质粒提取出来并转入到表达载体E.coliBL21,对表达菌进行培养,结果显示转化效果良好。
加入诱导剂IPTG 25 ℃诱导7 h,让菌株表达目的蛋白,比较不同条件下表达菌表达的蛋白量。对细菌表达的蛋白进行考马斯亮蓝染色实验,对表达菌表达的蛋白进行定性检测,结果如图5所示。图5中:M代表marker;1代表未诱导蛋白;2代表GST标签;黑色方框中表示表达的Htt-exon1 polyQ10和Htt-exon1 polyQ42,分别记为3、4。
由图5可知,由蛋白质marker对照得知,GST标签分子量为27 kDa,GST-Htt-exon1 polyQ10的分子量为40 kDa左右,GST-Htt-exon1 polyQ42的分子量为50 kDa左右。
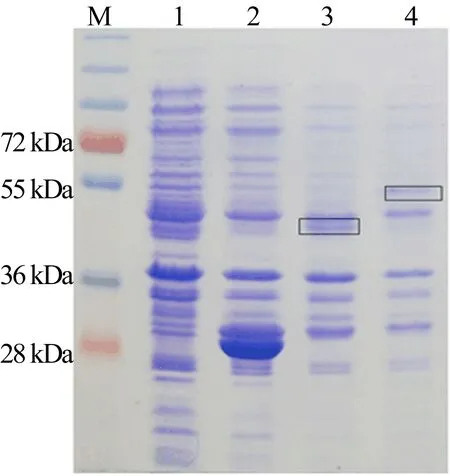
图5 不同诱导条件下考马斯亮蓝染色
2.3 GST-Htt-exon1 polyQ的纯化结果分析
将样品破碎取全蛋白上清液、沉淀与过柱子之后的洗脱液进行考马斯亮蓝染色分析, 利用带有GST标签的融合蛋白与琼脂糖介质上交联的谷胱甘肽配体互补性结合,除杂后加入还原型谷胱甘肽洗脱蛋白,从而分离到纯化目的蛋白,结果如图6所示。

图6 GST融合蛋白纯化过程中样品的电泳检测
图6中:1~7为表达的Htt-exon1 polyQ10;8~14为表达的Htt-exon1 polyQ42;M代表marker。1和8分别为全蛋白样品;2和9分别为上清液样品;3和10分别为沉淀样品;4和11分别为上清上柱后的流传液,说明表达的蛋白都结合到吸附柱了,吸附效果良好;5和12分别为GST对照上柱之后的流传液,说明吸附效果良好;6和13分别为加入还原型谷胱甘肽洗脱蛋白,分离纯化的目的蛋白,6为带有GST标签的Htt-exon1 polyQ10,13为带有GST标签的Htt-exon1 polyQ42;7和14 为吸附了表达蛋白后的柱子内的琼脂糖介质,说明吸附效果良好,切割效果良好,洗脱下来的蛋白中含有切割完成后吸附在柱子上的GST,没有切割的仍旧吸附在柱子上的有GST标签的Htt-exon1 polyQ10和有GST标签的Htt-exon1 polyQ42。带有GST标签Htt-exon1 polyQ10的大小为50 kDa,带有GST标签Htt-exon1 polyQ42的大小为54 kDa。图6结果表明,融合了GST标签的Htt-exon1 polyQ10 和Htt-exon1 polyQ42在GST的帮助下顺利被分离纯化。
2.4 纯化后重组蛋白Western Blot验证
用 GST 亲和层析柱纯化后的蛋白洗脱液,经PP酶切割后,利用SDS-PAGE分析后发现皆可得到纯度相对较高的目的蛋白。然后将纯化后的蛋白进行 Western Blot 鉴定,结果如图 7所示。图7中:1代表Htt-exon1 polyQ42;2代表Htt-exon1 polyQ10。由图7可知,Htt-exon1 polyQ10在 8.5 kDa 位置出现了一条明显的条带,Htt-exon1 polyQ42在 12.5 kDa 位置出现了一条明显的条带,与预测的蛋白大小的位置相符。
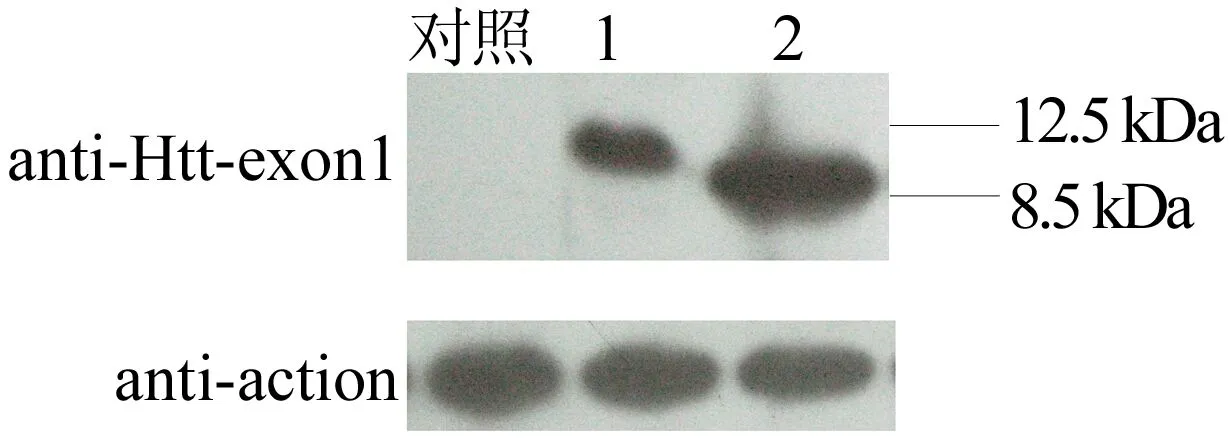
图7 Western Blot 鉴定纯化后的重组蛋白
2.5 重组蛋白与铜离子结合能力的分析
在诱导过程中,向培养基中外源添加铜离子后分离纯化融合蛋白,运用BCA kit检测蛋白浓度,运用 ICP-MS 检测蛋白上铜离子的质量浓度,结果如图8所示。
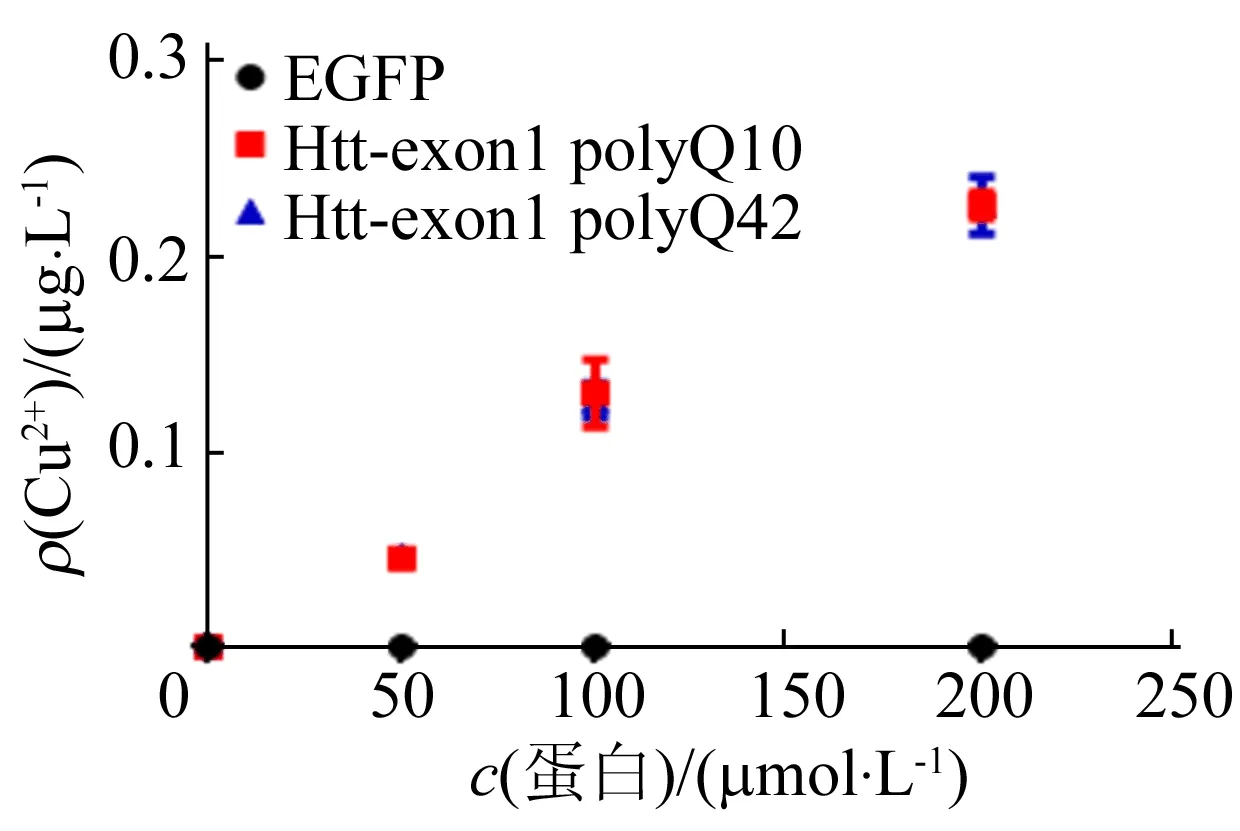
图8 ICP-MS 测得重组蛋白中铜离子质量浓度
从图8可以看出,Htt-exon1 polyQ10和Htt-exon1 polyQ42上均结合了大量的铜离子,作为对照的EGFP蛋白没有与铜离子的结合,这说明Htt-exon1能够直接结合铜离子,且不受polyQ浓度的影响。
3 结 论
HD是一种由于polyQ过度延长引起的神经退行性疾病,该疾病是世界上第三大神经退行性疾病,影响很多人的健康。但是由于该疾病病因、病理一直不明确,目前缺少有效治疗手段。HD病人及疾病模型动物体内均有铜离子的紊乱,但是具体机制不明。本课题组一直致力于铜离子与HD的研究。前期利用果蝇模型研究发现,脑内铜离子会促进致病蛋白Htt-exon1 polyQ的聚集,促进疾病进程,降低脑内铜离子水平能够显著挽救HD模型的疾病表型[11]。但是铜离子促进Htt-exon1 polyQ聚集的分子机制却不清楚。
本文利用基因克隆技术获得致病蛋白片段Htt-exon1 polyQ,并于大肠杆菌中成功表达;利用GST标签分离纯化该蛋白,研究发现体外表达的Htt-exon1 polyQ蛋白具有结合铜离子的能力。提供了直接的证据表明HD致病蛋白片段具有结合铜离子的能力,证实了之前提出的假设,铜离子通过直接结合到Htt-exon1上,引起Htt-exon1 polyQ的构象变化,从而影响其毒性。对研究该疾病的致病机理及药物靶点的发现和疾病的治疗具有十分重要的意义。
在本文构建的纯化蛋白基础上,可以深入探究该致病蛋白的性质及结构,以研究该蛋白致病机制,为HD寻找治疗手段。例如,可以探测在体外条件下,影响该蛋白聚集的条件,包括金属离子、氧化压力、环境等;可以探究能够缓解致病蛋白聚集的条件;可以筛选与该蛋白存在互作的蛋白,深入剖析蛋白在体内的作用机制及代谢过程;可以进行药物筛选,寻找能够缓解致病蛋白聚集的药物。

