果蝇锌离子转运蛋白Catsup亚细胞定位分析
田雪珂, 肖桂然
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
果蝇作为四大经典模式生物之一,其饲养容易、生长周期短,后代多,有利于数据的采集和大规模试验的进行。作为动物模型,果蝇遗传背景清楚,操作简单成熟,引入了酵母中的转录调控机制,即Gal4-UAS系统。Gal4-UAS系统是实现果蝇体内转基因的常用手段,该系统由Gal4(driver)和UAS(responder)2个调控元件组成,分别存在于2种转基因果蝇中,2种果蝇杂交产生的后代同时含有这2个元件,Gal4结合到UAS序列上,启动UAS下游基因细胞的组织特异性表达[1],这是哺乳动物望尘莫及的,被广泛应用于遗传、发育及营养学等各种基础研究。
Catsup基因在早期研究中曾被认为是儿茶酚胺生物合成过程中酪氨酸羟化酶活性的负调节因子,儿茶酚胺是一种由突触小泡负荷并参与多巴胺释放的化学物质,在果蝇中该物质还参与睡眠行为的控制[2-3]。生物信息学分析显示, Catsup 和锌离子转运蛋白 ZIP 家族成员hZIP7高度同源,其编码的蛋白极可能是一个定位在高尔基体上的转锌蛋白[4-5],但是目前对于该基因的分子功能及结构还缺乏研究。
荧光蛋白是一系列在紫外光激发下产生荧光的生物发光蛋白,以其荧光稳定性好、灵敏度高、无毒害等优点广泛应用于诸多领域。荧光蛋白主要包括绿色、黄色和红色 3 种颜色,绿色荧光蛋白(green fluorescent protein,GFP)最初从水母(Scyphozoa)中分离,文献[5]从不发光的海洋生物群克隆到了GFP基因,可在细菌、真菌、植物、动物中广谱表达产生绿色荧光;黄色荧光蛋白(yellow fluorescent protein,YFP)最初来自维多利亚多管水母(Aequoriavictoria),发射波长为527 nm,是GFP的一种突变体;红色荧光蛋白(red fluorescent protein,RFP)最初从珊瑚虫中分离,发射波长为583 nm,是GFP的同源荧光蛋白。这3种荧光蛋白常作为报告基因或者追踪基因,被广泛应用于生物、医学等领域[6-8]。
为了鉴定果蝇Catsup的分子功能,需要确定其亚细胞定位,本文构建了Catsup与GFP融合表达载体,通过显微注射进入果蝇中,构建UAS-Catsup-GFP转基因果蝇,利用荧光显微镜观察了Catsup的亚细胞定位,确定其定位在高尔基上。
1 材料与方法
1.1 材料
1.1.1 宿主菌、质粒及转基因果蝇
大肠杆菌感受态菌株DH5α购于北京全式金公司; pUAST质粒、Golgi-mRFP果蝇由清华大学生命科学学院周兵实验室馈赠。
1.1.2 主要试剂
EasyTaq DNA Polymerase、EcoR Ⅰ、Sal Ⅰ和Not Ⅰ限制性快速内切酶、T4 DNA Ligase、T4 DNA Ligase buffer、dNTP mix、Trans2K Plus DNA Marker、6×DNA loading buffer均购于北京全式金生物技术有限公司;异丙基-β-D-硫代半乳糖(IPTG)、氨苄青霉素均购于北京普利莱公司;无菌水、琼脂糖、1×TAE电泳缓冲液、溴化乙锭储存液均购于国药集团化学试剂有限公司。
1.1.3 主要仪器
高压蒸汽灭菌锅购于北京勤诚盛达科学仪器有限公司;电热恒温水浴锅购于上海精宏实验设备有限公司;超净工作台购于上海智城分析仪器制造有限公司;高速冷冻离心机购于Beckman Coulter, USA;超低温冰箱购于Thermo Fisher scientific;凝胶成像系统购于上海天能科技有限公司;荧光显微镜购于尼康映像仪器销售有限公司;基因扩增仪、恒温培养振荡器、脱色摇床、电热恒温培养箱、微量移液器等。
1.1.4 引物及测序
引物和测序报告均由上海生工生物技术有限公司提供。
1.2 实验方法
1.2.1 培养基配制
(1) LB液体培养基的配制。称取1 g蛋白胨,0.5 g酵母粉及1 g NaCl,加入80 mL ddH2O,用NaOH调pH值至7.0~7.2,定容至100 mL,121 ℃高压灭菌20 min。
(2) LB固体培养基的配制。100 mL LB液体培养基中加入1.2 g琼脂粉,121 ℃高压灭菌20 min。
1.2.2 Catsup-GFP表达载体的构建
1.2.2.1 目的基因的获得
利用Primer Premier 5.0软件设计所需引物,所需引物为:
FP:5’CATgaattcCAAAATGGCCAAACAAGTGG;RP:5’CATgtcgacCTCGAACTTGGCGATAACG。
从pcDNA3.1-hzip13-EGFP上切下来GFP[9]。以cDNA为模板,用高保真扩增酶进行聚合酶链式反应(polymerase chain reaction, PCR)扩增。
1.2.2.2 pUAST-Catsup-GFP表达载体的构建
将回收的Catsup目的基因用限制性内切酶EcoR Ⅰ和Sal Ⅰ在37 ℃下进行双酶切。pUAST vector用EcoR Ⅰ和Not Ⅰ双酶切。EGFP用Sal Ⅰ和Not Ⅰ双酶切。用T4 DNA连接酶16 ℃过夜连接。将连接过夜的产物转入到大肠杆菌感受态细胞中,用含有100 mg/mL氨苄青霉素LB固体培养基筛选阳性克隆。挑取长势正常的单克隆菌落进行PCR鉴定,并用200 mg/mL IPTG诱导剂37 ℃诱导4 h,对表达菌表达的蛋白进行定性测量。
1.2.3 Catsup-GFP细胞的亚细胞定位
将得到的pUAST-Catsup-GFP表达载体验证正确后通过显微注射技术导入果蝇,得到不同Catsup-GFP插入位点的转基因果蝇。将该转基因果蝇与全身特性表达的driver-Daughterless杂交,待其长至3龄,通过PCR技术扩增电泳验证得到Catsup-GFP果蝇。用验证后的Catsup-GFP果蝇挑红眼与肠细胞特异表达的driver-NP3084杂交,待幼虫长至3龄解剖,用荧光显微镜看其亚细胞定位,初步确定Catsup定位在高尔基上。用高尔基体上特异性表达的果蝇Golgi-GFP与driver-NP3084杂交,待幼虫长至3龄,用荧光显微镜观察是否与Catsup-GFP的亚细胞定位重合, 确定Catsup是否定位在高尔基体上。
2 结果与分析
2.1 Catsup基因的扩增
以果蝇cDNA为模板扩增Catsup基因片段,如图1所示,图1中,M为DNA Marker;1为Catsup基因。由图1可知,样品PCR扩增出了DNA片段,且在2 000 bp有一条明显的特异性条带。与期望得到的Catsup结构基因片段相符,表明扩增出了目的基因片段。
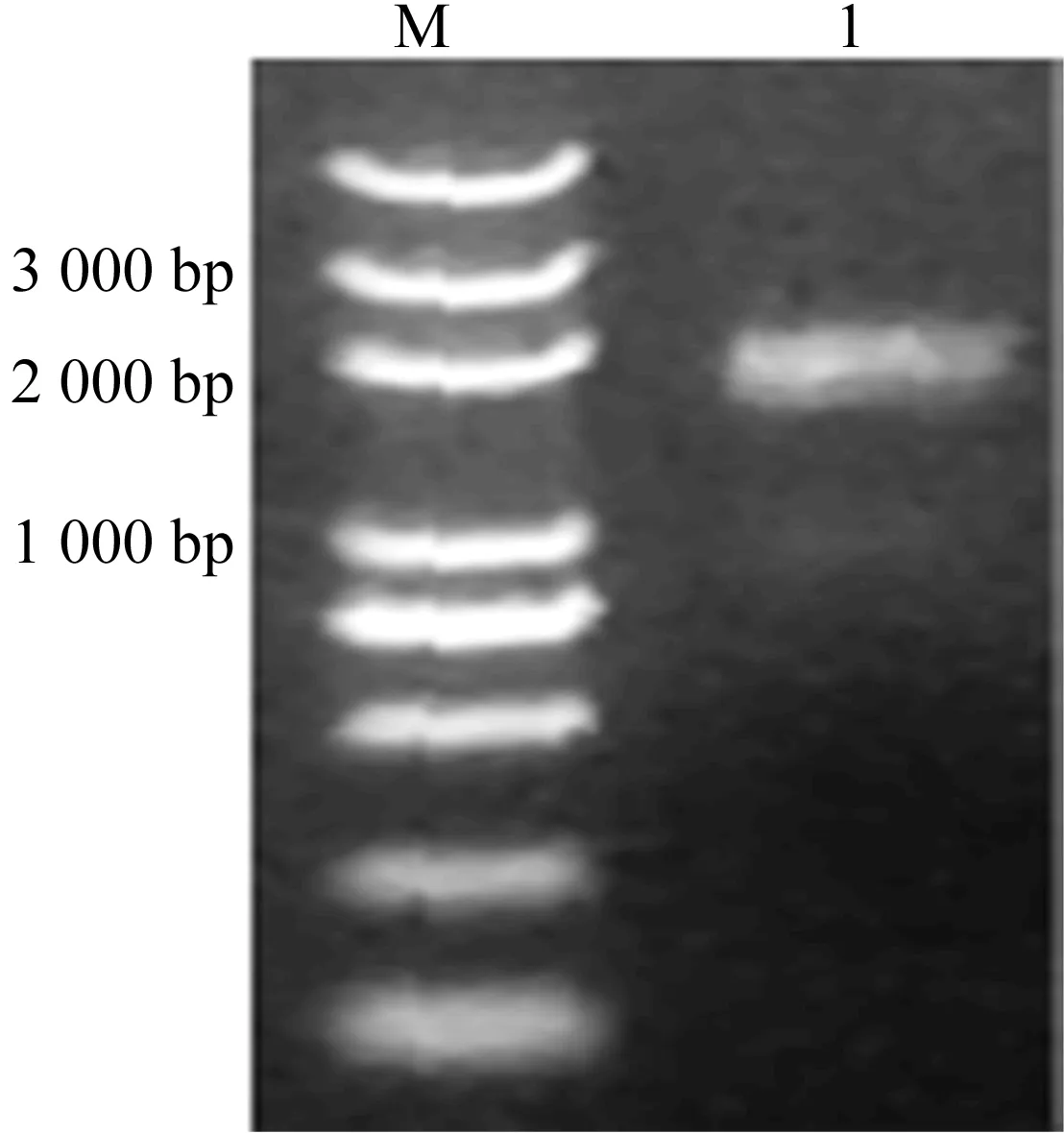
图1 PCR扩增目的片段
2.2 Catsup-GFP表达载体的转化及鉴定
将PCR扩增出的Catsup目的基因、pcDNA3.1-hzip13-EGFP上切下来GFP和空载pUAST分别用限制性核酸内切酶进行酶切,用T4 DNA连接酶于16 ℃金属浴中过夜连接,然后将重组质粒转入大肠杆菌感受态细胞E.coliDH5α中,用含有100 mg/mL氨苄青霉素的LB平板培养,筛选阳性单克隆如图2所示,由图2可知,大肠杆菌在琼脂培养基上的菌落形态为圆形。边缘整齐,表面光滑,半透明,小凸起。可以判断平板上生长的是大肠杆菌,且未被杂菌污染。
图2 转化后的克隆载体大肠杆菌
挑取单克隆进行菌落PCR鉴定并电泳检测,Catsup-GFP过表达菌株的菌落的PCR鉴定结果如图3所示,图3中,M为DNA Marker;1~16为随机挑取的菌落。由图3可知,所有单菌落均显示阳性条带。但可能由于制胶原因,部分条带显示小于预期的2 000 bp。
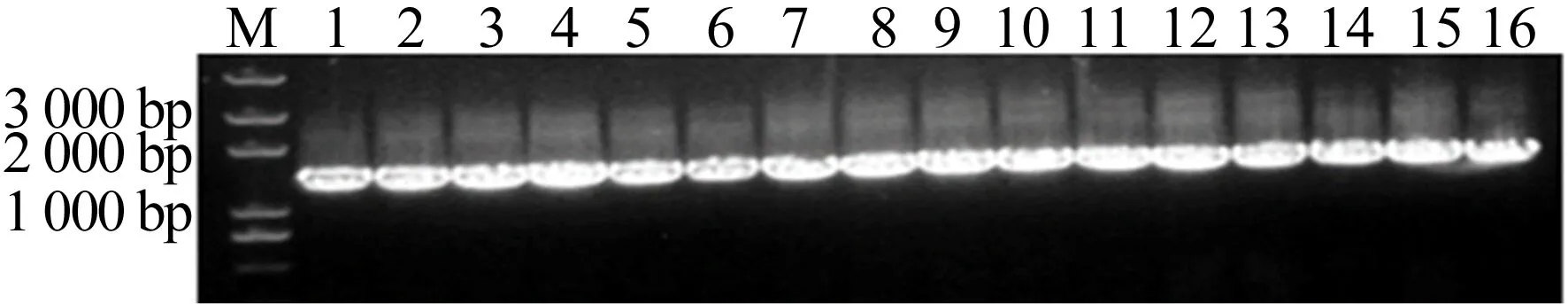
图3 菌落PCR的电泳图
2.3 Catsup-GFP质粒PCR验证
从阳性克隆中选取1号提取质粒,选取Catsup N端载体引物及GFP R端引物,进行PCR扩增实验,结果如图4所示,图4中,M为DNA Marker;1为Catsup基因。已知Catsup大小为1 350 bp,GFP大小为726 bp,由图4可知,样品PCR扩增出了2 000 bp DNA片段,表明Catsup-GFP质粒连接成功。

图4 Catsup-GFP双酶切电泳图
Catsup-GFP质粒连接成功的载体进行测序,结果反馈序列正确,表明成功构建了能在果蝇中进行表达的pUAST-Catsup-GFP质粒。
2.4 Catsup-GFP果蝇的构建
将验证成功的Catsup-GFP质粒纤维注射野生型果蝇w1118(眼睛白色),得到不同插入位点的Catsup-GFP转基因果蝇,因为pUAST载体具有白眼基因,所以成功转基因果蝇的眼睛呈红色。取红色眼睛转基因果蝇与平衡子进行杂交,进行染色体验证及纯化。共获取3株UAS-Catsup-GFP转基因果蝇。
用得到的转基因果蝇和全身表达的Gal4杂交,待其长至3龄提全虫的RNA,将RNA反转录后进行电泳检测,选取Catsup N端载体引物及GFP R端引物,进行PCR扩增实验,如图5所示。图5中,1、2、3代表Catsup-GFP质粒随机注射果蝇后得到的3种不同插入位置的Catsup-GFP果蝇。由图5可知,Catsup-GFP质粒转基因果蝇构建成功。

图5 Catsup果蝇验证结果
2.5 果蝇Catsup亚细胞定位分析
为了鉴定Catsup的亚细胞定位,将验证成功的Catsup-GFP果蝇和高尔基体上特异性表达的Golgi-GFP果蝇分别与肠细胞特异表达的driver-NP3084杂交,待幼虫长至三龄,解剖出肠子,用荧光显微镜拍其亚细胞定位如图6所示。从图6可以看出,Catsup-GFP与Golgi-RFP完全重合,表明Catsup定位在了高尔基上。
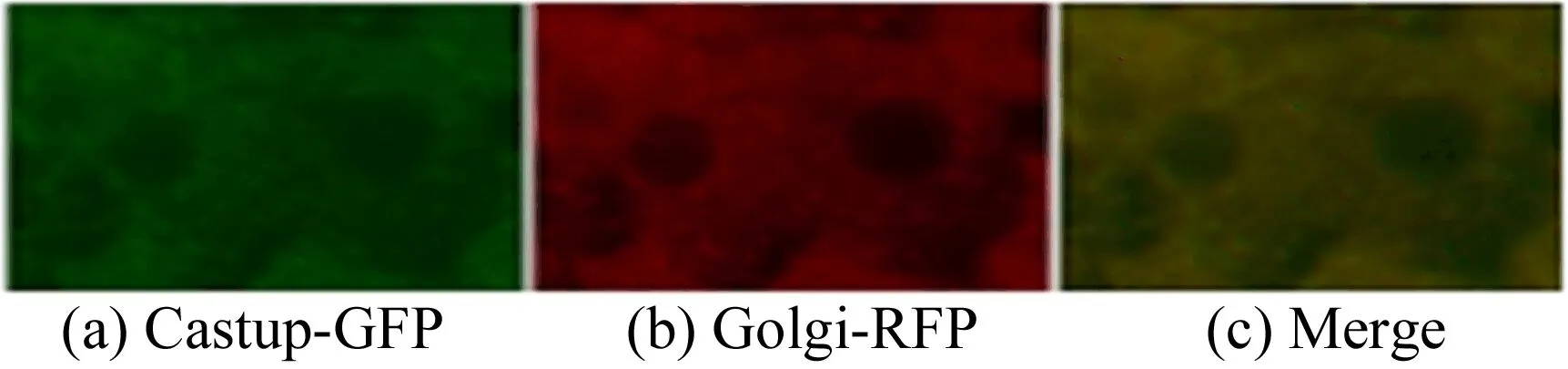
图6 Catsup亚细胞定位
3 结 论
有研究推断,Catsup与细胞的生长调节、睡眠以及乳腺癌的发生发展等均有关[10]。但是, Catsup的分子功能还未确定,它在很多器官中的功能尚未可知[11]。生物信息学分析显示,Catsup编码的蛋白极可能是一个定位在高尔基体上的转锌蛋白。为了确定Catsup的亚细胞定位,并解析其作用机制,本文利用PCR技术扩增Catsup基因,从pcDNA3.1-hzip7-EGFP酶切下GFP,经双酶切后将它们一起连接在pUAST质粒上,导入大肠杆菌感受态细胞,经测序获得构建成功的载体。随后,本文将此载体通过显微注射技术构建转基因果蝇,利用遗传技术获取转基因成功的果蝇,并分析转基因的染色体位置。选取该转基因果蝇进行定位分析,发现Catsup是一个定位在高尔基体上的蛋白,因此Catsup在分泌途径中起作用,为后续关于Catsup的科学研究奠定基础。

