生鲜食品中沙门氏菌多重耐药性检测与复合型Ⅰ类整合子的分析
周雨蕾,李晓芳,侯温甫,王宏勋,周敏
(武汉轻工大学食品科学与工程学院,湖北武汉 430023)
沙门氏菌(Salmonella)是一种重要的、血清型繁多的食源性致病菌[1-2],是全球导致食物中毒的最常见的致病病原体之一,主要污染包括动物源生鲜食品如鸡蛋、鸡肉、畜制品[3]及蔬菜。由于不适当的储存、烹调或交叉污染,沙门氏菌可以在设备表面及某些食品中存活并繁殖达到引起人类疾病的水平[4]。每年约3亿人次因感染沙门氏菌而患病,给食品安全和消费者健康带来严重危害[5,6]。近年来,沙门氏菌的耐药性极其严峻,耐受的抗菌药物也呈现多样化[7],多重耐药菌株正在源源不断出现。除自身基因突变,细菌可通过抗生素耐药基因的水平转移从外部获得抗性,这也是临床耐药菌株产生的重要途径[3]。
整合子是一种可移动的DNA元件,包含一个能够整合和表达耐药基因的特异重组系统,并将耐药基因从一种细菌转移到另一种细菌,从而导致耐药基因的传播[8-9]。Ⅰ类整合子是目前最常见且研究最多的整合子[10],常因嵌入到质粒或者转座子以促进自身在细菌中的扩散[11],其携带的多种耐药基因盒类型正在不断增加[12]。插入序列(ISs)是一类最短的可移动元件,能插入到基因组一个或多个靶位点[13],并可以转移任何DNA片段[14],其中ISCR1常与多种耐药基因相关[15]。Ⅰ类整合子的3'保守区(3'CS)后连接ISCR1及其下游的耐药基因盒形成复合I型整合子结构[16],复合I型整合子同时包含有两种遗传元件,这使其能更容易捕获和传播耐药基因。
此前的研究表明,复合I型整合子阳性分离株对多种抗生素具有显著的耐药性[17-18],对这一结构的研究非常重要[19],前期的研究多集中在沙门氏菌临床株,目前国内外只有少量文献报道食源性沙门氏菌中的复合I类整合子。本研究针对66株沙门氏菌分离株,检测其耐药谱、血清型和序列型,再分析沙门氏菌菌株的复合 I类整合子和耐药基因盒,旨在分析复合 I类整合子在多重耐药菌株中的作用,为科学指导应用抗生素及沙门氏菌的防控提供数据参考[20]。
1 材料与方法
1.1 实验材料
菌株:从湖北武汉和荆州地区各大农贸市场与超市生鲜制品中分离得到的沙门氏菌株共66株(禽类来源51株、畜类来源7株、水产6株、其他来源2株),标准质控菌株:大肠埃希菌ATCC25922,大肠杆菌工程菌DH5α。
试剂:培养基Luria-Bertani(LB)Agar、Luria-Bertani(LB)Broth、Mueller Hinton Agar(MHA)和麦康凯琼脂,北京陆桥技术股份责任公司;DNA分子标准量Marker,博迈德生物技术有限公司;2×Taq Master Mix,诺唯赞生物技术有限公司;琼脂糖、GelRed染料,上海拜力生物科技有限公司;抗生素阿莫西林(Amoxycillin,AML)、氨苄西林(Ampicillin,AMP)、头孢噻肟(Cefotaxime,CTX)、头孢呋辛钠(Cefuroxime sodium,CXM)、氯霉素(Chloramphenicol,C)、环丙沙星(Ciprofloxacin,CIP)、萘啶酸(Nalidixic acid,NA)、诺氟沙星(Norfloxacin,NOR)、链霉素(Streptomycin,ST)、庆大霉素(Gentamicin,CN)、呋喃妥因(Nitrofurantoin,F)、磺胺复合物(Sulphonamides compound,S3)、四环素(Tetracycline,TE)和沙门氏菌诊断血清(60种),宁波天润生物有限公司;magenten总DNA提取试剂盒、凝胶回收试剂盒,TaKaRa公司。
1.2 仪器与设备
凝胶电泳仪(DYCP-31DN,BIORAD);凝胶成像仪(GelDoc XR+,BIORAD);PCR仪(T100,BIORAD)。
1.3 方法
1.3.1 药敏检测
按照美国临床实验室标准化协会(CLSI2016)推荐的K-B纸片法进行14种抗生素药敏实验,以大肠杆菌 ATCC25922为质控菌株,结果判定参考CLSI2016(表1),多重耐药定义为至少对三类抗生素耐药或者中介。
1.3.2 血清型检测
采用玻片凝集法[21]进行沙门氏菌血清型分型。
1.3.3 DNA模板的制备
按照magenten总DNA提取试剂盒方法提取沙门氏菌总DNA。
根据收集0.5~1.0 mL新鲜制备的菌液,高速离心后去上清液,加入240 μL STE、10 μL溶菌酶溶液(20 mg/mL)、5 μL RNA 酶(100 mg/mL),37 ℃下水浴10 min;继续加入250 μL DL缓冲液、10 μL蛋白酶K(20 mg/mL),移液枪吸打混匀,65 ℃下水浴30 min;加入250 μL无水乙醇,涡旋混匀15 s。
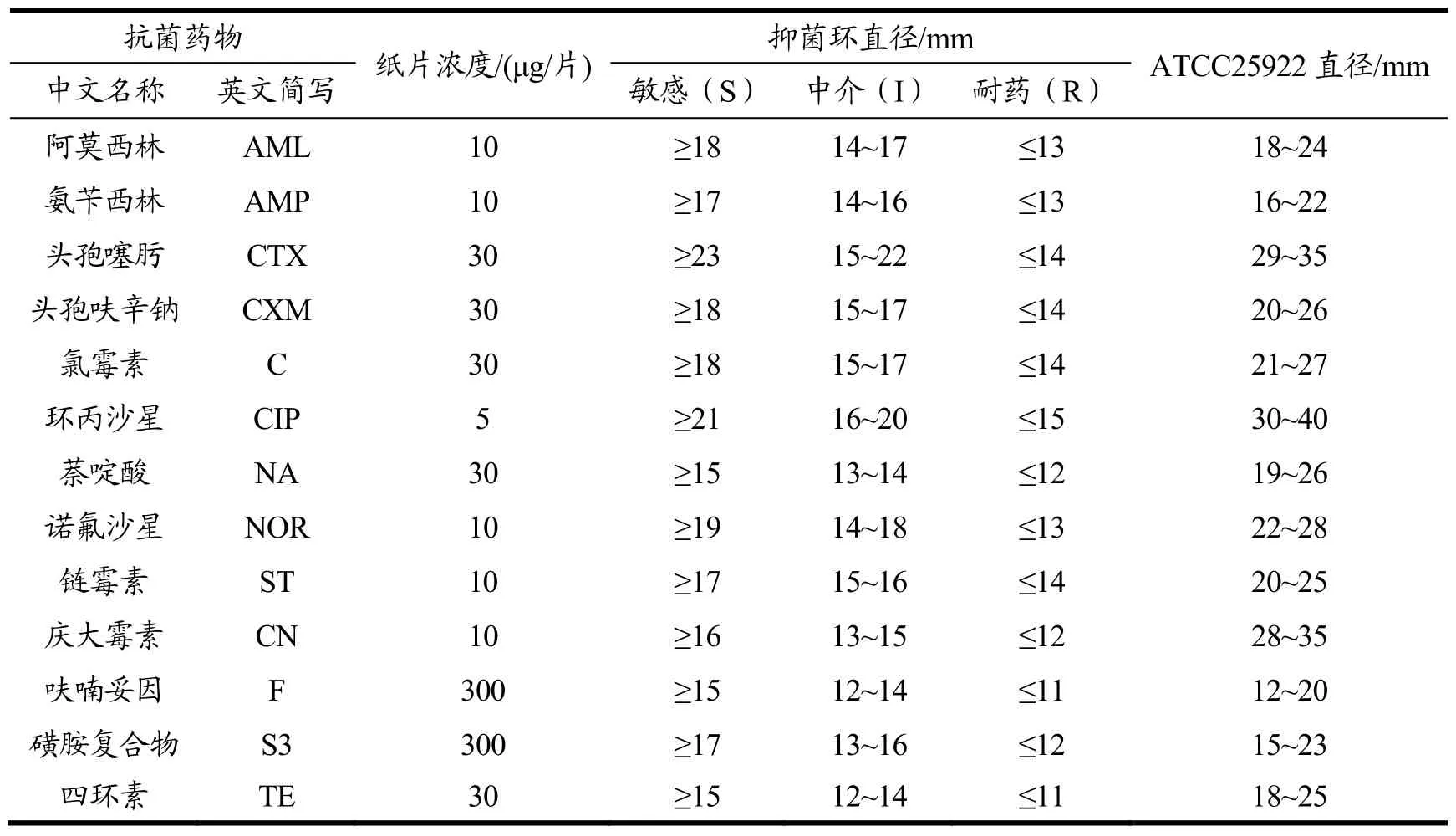
表1 抗生素判定标准Table 1 Standard for antibiotic susceptibility test

表2 Ⅰ类整合子及ISCR1引物信息Table 2 Ⅰ integron and ISCR1 primer information
将溶液移至spin column管中,10000 r/min离心1 min,弃滤液;加入500 μL GW1缓冲液,8000 r/min离心1 min,弃滤液;继续加入650 μL GW2缓冲液,8000 r/min离心1 min,弃滤液;12000 r/min下离心2 min,弃收集管,套上灭菌后的1.5 mL离心管,往spin column管中加入50 μL Buffer AE,静置10 min,12000 r/min离心2 min;回收滤液得到总DNA,于-20 ℃下保存。
1.3.4 MLST分型
根据 PubMLST数据库(http://mlst.warwick.ac.uk/mlst/dbs/Senterica)推荐的七个管家基因扩增引物和扩增条件,以多重耐药沙门氏菌总DNA为模板进行PCR扩增,PCR产物送华大基因测序公司双向测序,将序列上传至MLST沙门氏菌数据库中,与数据库中原有的等位基因型序列进行比对,得到每个看家基因的基因型编号,将其组合后得到对应的序列型(sequence type,ST)。
1.3.5 基因盒扩增
1.3.5.1 引物设计
针对I类整合子与ISCR1区段,利用Primer 5设计扩增引物,检测Ⅰ类整合子和ISCR1两端的保守区域。含有Ⅰ类整合子与ISCR1元件的分离株,对其基因盒CS可变区进行PCR扩增,检测其中的耐药基因。引物序列见表2。
1.3.5.2 PCR反应及检测
PCR反应体系:0.5 μL总DNA为模板,前后引物各0.5 μL,2×Taq Master Mix DNA 聚合酶 12.5 μL,用蒸馏水补足至25 μL。
PCR反应条件:预变性94 ℃,5 min;变性94 ℃,时间30 s;退火时间30 s;延伸72 ℃,时间2 min;最后延伸5 min。采用含有superGel染料的琼脂糖进行PCR产物的凝胶电泳,再利用凝胶成像系统检测相应目标基因的扩增条带。
1.3.6 基因盒片段的克隆与测序分析
扩增片段的纯化:采用TaKaRa普通琼脂糖凝胶(离心柱型)DNA回收试剂盒DNA片段回收,将PCR目的产物纯化。将凝胶回收的PCR产物与pMD-19T载体体外连接,连接体系总体积10 μL:PCR纯化产物 4.5 μL,pMD-19T 0.5 μL,Solution Ⅰ(2×)5 μL;在4 ℃条件下过夜连接。参考文献进行质粒载体的转化[6],宿主菌为DH5α,将培养到对数生长期的菌液送测序公司测序,利用NCBI数据库对序列进行分析,确定耐药基因盒阵列。
2 结果与讨论
2.1 药敏检测结果
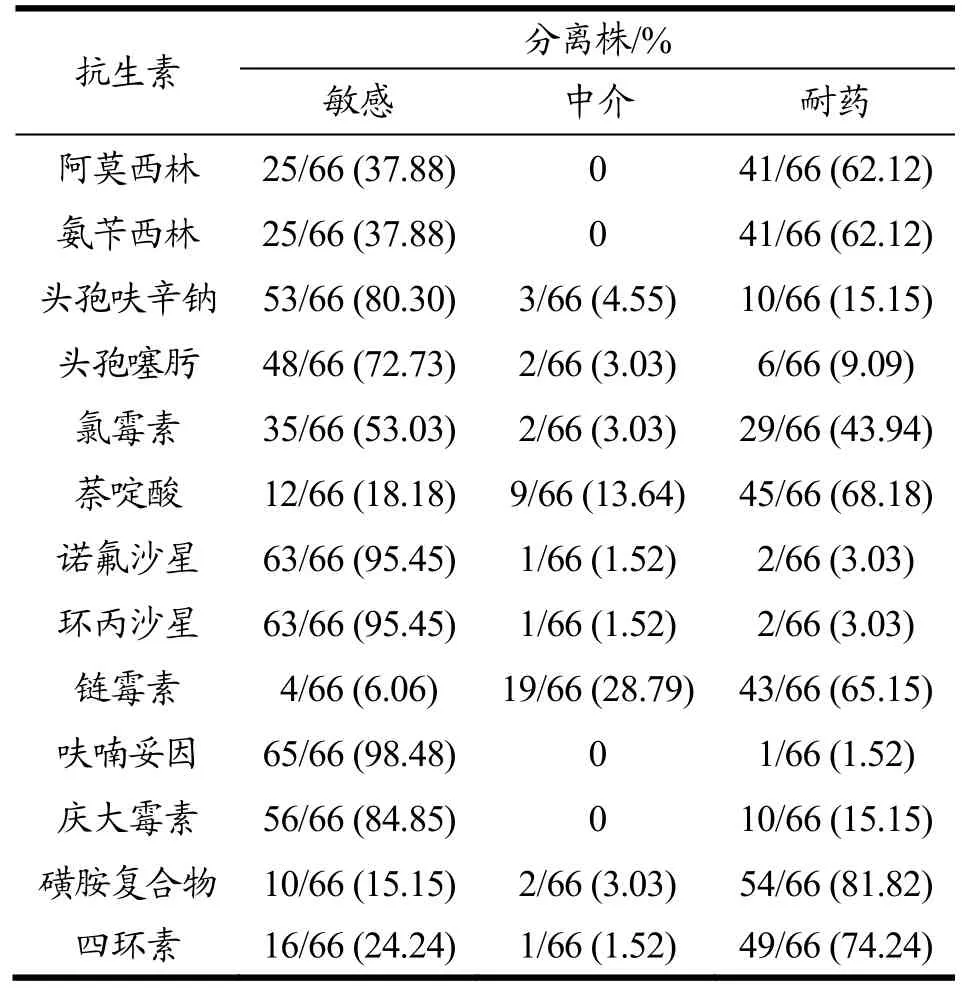
表3 66株沙门氏菌分离株的药敏检测结果Table 3 Antimicrobial susceptibility test results of 66 Salmonella isolates
对66株沙门氏菌分离株进行了药敏检测,结果发现对磺胺复合物耐药率最高(81.82%),其次为四环素(74.24%)、萘啶酸(68.18%)、链霉素(65.15%)、阿莫西林(62.12%)、氨苄西林(62.12%)和氯霉素(43.94%),沙门氏菌分离株对头孢呋辛钠(15.15%)、庆大霉素(15.15%)、头孢噻肟(9.09%)、环丙沙星(3.03%)和诺氟沙星(3.03%)的耐药率较低,仅一株菌(1.51%)对呋喃妥因耐药(表3)。多重耐药菌株为32株,多重耐药率为48.48%(表5),与印广浩[25]从扬州农贸市场分离的猪源沙门氏菌的多重耐药率(25%)相比偏高,但与廖成水等[26]2015年报道的鸡源沙门氏菌多重耐药率(96.94%)相比,本实验中沙门氏菌分离株多重耐药率较低。
2.2 血清型及MLST型检测结果
本次分离的32株多重耐药菌株分为11种不同血清型,其中S. Thompson及S. Agona是优势血清型,分离率分别为 21.88%和 18.75%。S. Takoradi、S.Typhimurium、S. Kentucky、S. Derby均占9.38%,其它5种血清型包含的菌株数均在2株及以下(表5)。相比其它血清型,优势血清型S.Thompson分离株对头孢菌素类、磺胺类抗生素的耐药率达到 100%,这表明S. Thompson可能因为较高的耐药性而在本地区成为流行血清型。这个结果与美国、尼日利亚和英国等地区的报道不同,他们的研究表明肉制品中沙门氏菌分离株最常见的血清型为S.Typhimurium[27-28]。
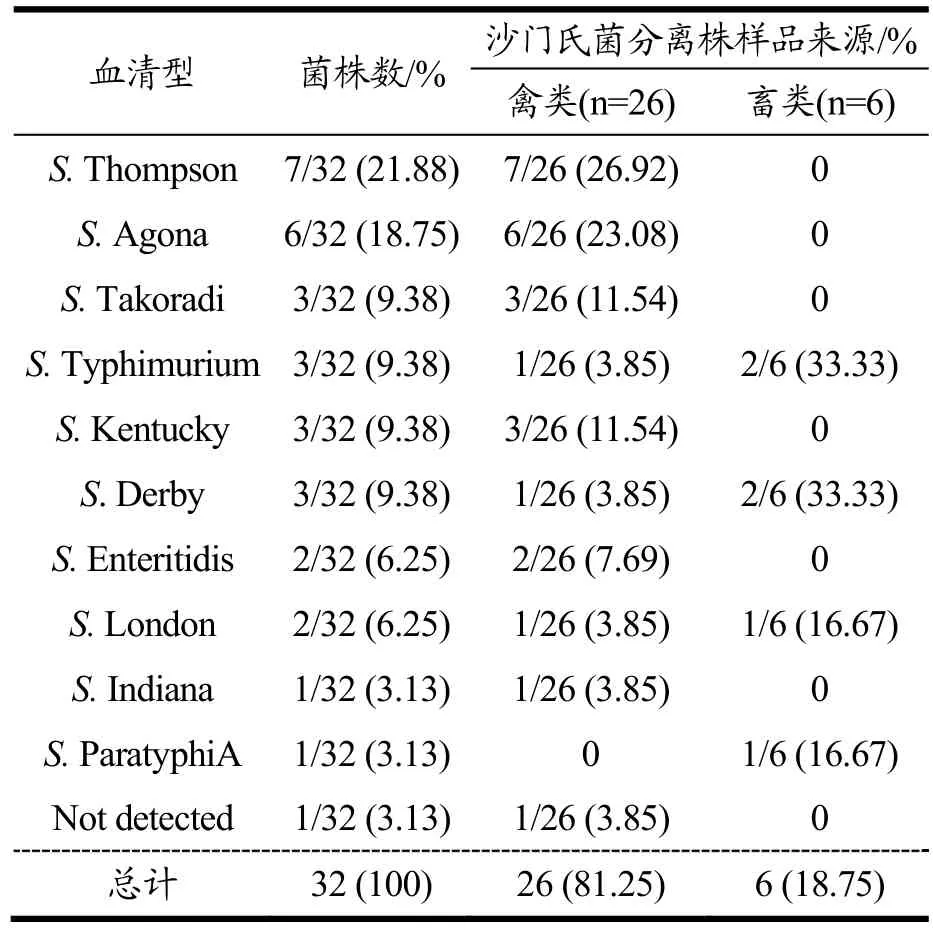
表4 32株多重耐药沙门氏菌分离株血清型的分布Table 4 Distribution of 32 multi-drug resistance Salmonella isolates serovars
32株沙门氏菌中分为15种ST型,其中有3株为新的ST型(表5),其中ST26是最主要的序列型(7/32,21.88%),其次为 ST13(4/32,12.50%),ST541及ST314(9.38%,3/32)。优势血清型均在禽类来源中检测出,这说明沙门氏菌血清型可能具有宿主差异性,不同血清型沙门氏菌有不同的宿主范围。将本次试验ST分型结果与血清型结果比较可知,MLST的15种序列型与 11种血清型结果之间关系密切,符合率达31/32(96.88%),未对应的为一株血清型未确定的粗糙型沙门氏菌分离株。表明相同血清型基本对应固定的ST型[1]。
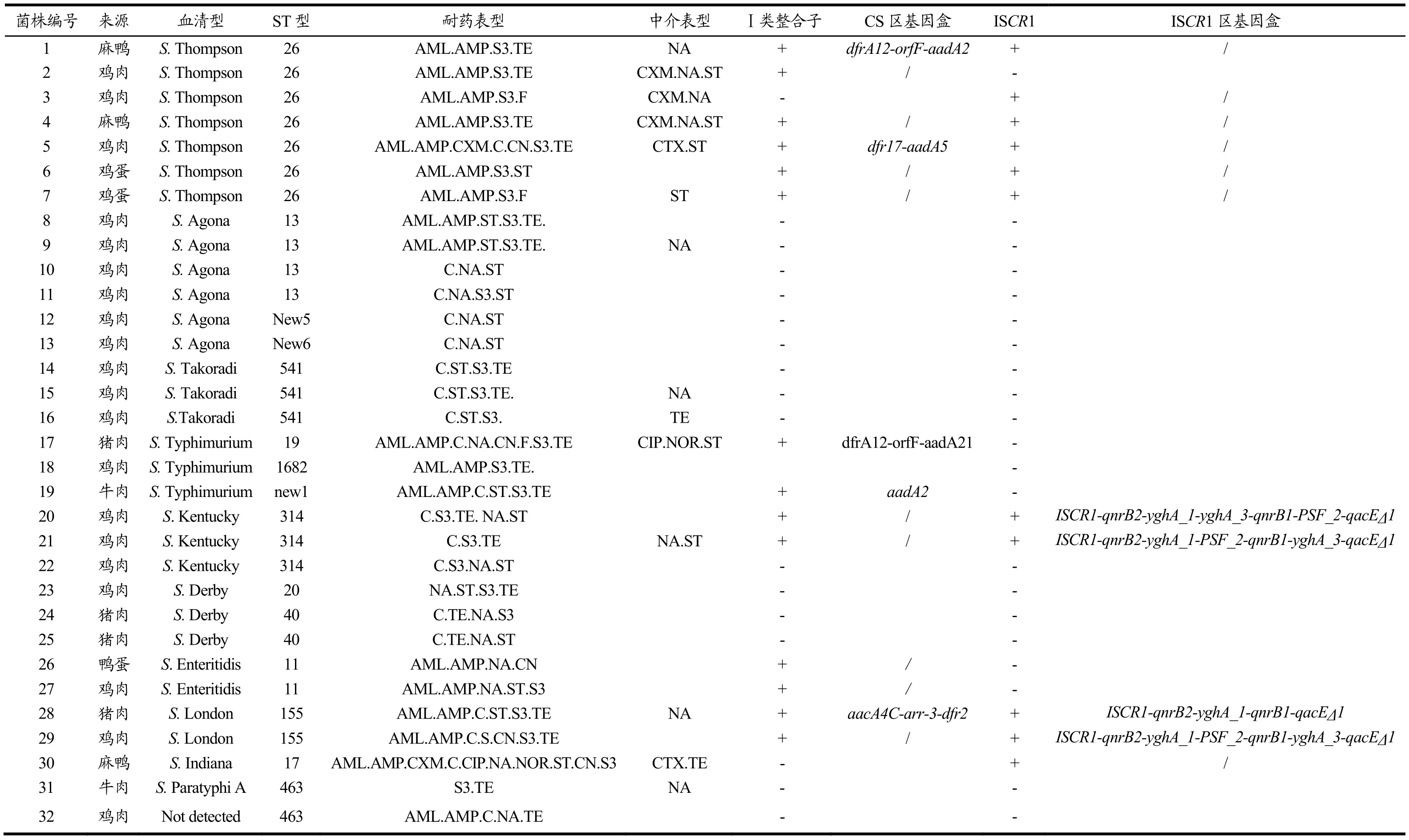
表5 32株多重耐药菌株特征及耐药基因盒信息Table 5 Information of 32 multi-drug resistant strains and gene-cassette
2.3 复合整合子检测
2.3.1 Ⅰ类整合子检测
以32株多重耐药沙门氏菌分离株的总DNA作为模板,利用PCR方法扩增I类整合酶基因intI1和末端消毒剂基因qacEΔ1-sul1。结果发现,在32株沙门氏菌分离株中,有 14株扩增到intI1基因片段和qacEΔ1-sul1基因片段,检出率为43.75%(表5)。本实验在多重耐药沙门氏菌中Ⅰ类整合子的检出率和国外 Ahmed等[29]报道的食源性多重耐药沙门氏菌Ⅰ类整合子的阳性率(57.45%)相当,但明显低于国内杨丹[30]报道的藏鸡多重耐药沙门氏菌Ⅰ类整合子检出率(95.12%),表明整合子在不同区域或不同来源的多重耐药菌株中有差异。
对确定包含Ⅰ类整合子的菌株进行可变区耐药基因盒的检测。在14株Ⅰ类整合子阳性菌株中,有9株扩增到150 bp的特异性片段,测序后发现为空基因盒。在另外的5株分离株中,分别扩增到0.9 kb、1.7 kb、1.9 kb、2.2 kb和 2.3 kb的特异性片段,检出率为35.71%(5/14)。经克隆、测序和序列分析,发现这5株分别含有五种不同基因盒(表 5),其阵列分别为aadA2(0.9 kb,n=1)、aacA4C-arr-3-dfr2(1.7 kb,n=1)、dfrA12-orfF-aadA2(1.9 kb,n=1)dfrA12-orfF-aadA21(2.2 kb,n=1)、dfr17-aadA5(2.3 kb,n=1)。其中aadA2、aadA4C和aadA21是氨基糖苷类抗生素耐药基因,dfr2、dfrA12和dfr17是磺胺类抗生素耐药基因。含有Ⅰ类整合子的菌株基本表现出相应的耐药性,Meng等人[31]研究也表明I类整合子的存在与沙门氏菌耐药性之间存在一定的相关性。
2.3.2 ISCR元件检测结果
以32株沙门氏菌分离株的总DNA为模板,利用PCR方法在11株中扩增到ISCR1元件(orf513基因),检出率为34.38%(11/32)。利用513BF作为上游引物,消毒剂基因qacEΔ1前端序列做下游引物,通过PCR检测 ISCR1元件中的耐药基因盒。结果发现,在 11株ISCR1元件阳性菌株中有4株扩增出2700 bp左右的片段,检出率为 36.36%(4/11),经克隆、测序和序列分析发现,4个基因盒中有3种基因排列方式:qnrB2-yghA-1-PSF-2-qnrB1-yghA-3( n=1)、qnrB2-yghA-1-yghA-3-qnrB1-PSF-2( n=2)、qnrB1-yghA-1-qnrB6(n=1)。其中qnrB1、qnrB2为喹诺酮类抗生素耐药基因,PSF-2为噬菌体休克蛋白F,yghA-1和yghA-3为未表征的氧化还原酶基因。本实验中4株菌株的ISCR1耐药基因盒都包含有qnrB,其中3株对萘啶酸(NA)表现为耐药或中介,仅1株对萘啶酸表现为敏感。黄建芳等[32]发现ISCR1阳性菌株常与qnrA1-共同传播。Toleman等人[33]研究中报道ISCR1中的耐药基因盒主要包括喹诺酮耐药基因qnr以及β-内酰胺类耐药基因,且耐药基因盒基因与耐药表型具有较强相关性。
2.3.3 复合整合子菌株的耐药及基因盒同源性分析
同时含有这两种遗传元件(Ⅰ型复合整合子)的菌株共检测出9株,检出率为28.13%(9/32)。其中,包含Ⅰ型复合整合子元件且均含有耐药基因盒的只有第28号菌株(表5),其表现出对β-内酰胺类(阿莫西林和氨苄西林)、苯丙醇类(氯霉素)、氨基糖苷类(链霉素)、磺胺复合物和四环素五大类6种抗生素的耐药性,对喹诺酮类(萘啶酸)表现出耐药中介。Cheng等[34]和Xia等[35]的研究也表明,同时携带Ⅰ类整合子和ISCR1两种遗传元件的沙门氏菌比携带单一元件的沙门氏菌表现出更强的耐药性。
对 28号菌株基因盒和侧翼序列进行同源性分析[36],结果如图 1,Ⅰ类整合子的基因盒aacA4C-arr-3-dfr2与来自中国某医院临床分离沙门氏菌 Nsa217[37]质粒(KR338349)的基因盒相似,在Nsa217质粒耐药基因盒的下游还含有一个完整的氨基糖苷类耐药基因aadA16,以及一个消毒剂基因qaceΔ1,说明Ⅰ类整合子可能可以介导临床和食品分离株之间的耐药基因的传播。而 ISCR1基因盒阵列qnrB2-yghA_1-qnrB6通过同源性比对,则与肺炎克雷伯菌KP15-2-53[38]质粒(MN480461.1)中一段序列相同,KP15-2-53质粒基因盒上下游分别有一个IS91和IS26,说明其具有较强的传播能力,有利于耐药基因在不同菌株之间进行水平转移。
3 结论
本试验中,66株生鲜食品来源沙门氏菌分离株对磺胺复合物、四环素、萘啶酸、链霉素、阿莫西林、氨苄西林的耐药率均较高,且耐3种及以上抗生素的菌株占 48.49%,对 6种以上抗生素耐药的菌株占7.58%。32株多重耐药株中分为11种血清型,优势血清型为S. Thompson和S. Agona,MLST的序列分型将多重耐药株分为15种ST型,优势序列型为ST26、ST13。试验中仅携带一种遗传基因元件(I类整合子或ISCR1元件)的沙门氏菌中,对抗生素耐药的类型最多涉及到四类。携带ISCR1元件的菌株均表现出对3种以上的抗生素的耐药性,且对阿莫西林、氨苄西林、头孢唑啉、氯霉素、庆大霉素、诺氟沙星、磺胺复合物和四环素的耐药率差异显著。本试验中一株携带Ⅰ型复合整合子的菌株耐药性极强,对五大类6种抗生素表现为耐药,且耐药基因盒基因与耐药表型表现出较强的相关性,耐药基因盒与沙门氏菌 Nsa217质粒和肺炎克雷伯菌的KP15-2-53质粒分别具有同源性,表明其传播能力较强。研究沙门氏菌分离株的特征及其中复合整合子的流行状况,将有助于阐明耐药基因的传播机制,对食源性致病菌进行风险评估,降低或防止食品安全事件的发生。

