麦长管蚜9个miRNA在不同发育阶段的表达
张方梅, 闫 艺, 程登发, 朱 勋, 张云慧,*, 李祥瑞,*
(1.中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193; 2.信阳农林学院, 河南信阳 464000)
麦长管蚜Sitobionavenae是我国粮食种植区小麦蚜虫的优势种,现在被认为是荻草谷网蚜,主要通过取食韧皮部汁液、分泌蜜露、传播植物病毒等方式危害小麦,影响其产量和品质(Fuetal., 2014; Liuetal., 2014; Honeketal., 2017)。蚜虫具备典型的表型可塑性,当外界环境条件变化时,蚜虫呈现两种不同的形态:有翅型和无翅型(Taguetal., 2005; Braendleetal., 2006)。蚜虫这种表观形态的变化主要受温度、密度和食物质量等环境因子的胁迫,通过选择性地调节相关基因的表达来实现(Brissonetal., 2010; Zhangetal., 2015)。
微小RNA(microRNA, miRNA)是一类长度为22 nt左右的小分子非编码RNA,广泛存在于各类生物体内。作为一种重要的后转录调控原件,通过抑制靶基因的翻译过程或降解靶基因的mRNA而参与基因调控(Brenneckeetal., 2005; Boutla and Tabler , 2006)。目前已经鉴定出大量与昆虫翅发育相关的miRNA。例如,德国小蠊BlattellagermanicaLet-7和miR-100同时下调引起翅发育畸形,而miR-100单独下调时则导致翅面积减小(Rubioetal., 2012)。果蝇DrosophilamiR-iab-4及其反义链miR-iab-8通过抑制超级双胸基因Ubx的活性,控制其翅与平衡棒之间的转换(Ronshaugenetal., 2005; Starketal., 2008; Tyleretal., 2008);miR-12和miR-283则通过调控Hedgehog信号通路引起翅发育畸形(Friggi-Grelinetal., 2008)。鳞翅目特异的miR-2768靶向翅脉中断(ci)基因的编码区,在翅原基发育中发挥作用(Quahetal., 2015);miR-263a参与调控翅鳞片细胞的形成(Surridgeetal., 2011)。在东亚飞蝗Locustamigratoria中,miR-133通过调控多巴胺合成途径中的关键靶标基因henna和pale,导致散居型和群居型之间表型可塑性和行为变化(Yangetal., 2014)。miR-34通过调控两个胰岛素受体(InR1和InR2),进一步控制下游的转录因子FOXO,从而分别控制褐飞虱后代长翅型和短翅型的发育(Xuetal., 2015; Xu and Zhang, 2017)。此外,在蚜虫中也发现了与翅发育相关的miRNA。如在褐色桔蚜Aphiscitricidus中过表达miR-9b能够抑制其翅的发育过程,出现翅卷曲或翅发育不完整的表型(Shangetal., 2020)。本实验室前期研究也已发现过表达或者抑制表达麦长管蚜miRNA能引起其翅发育的异常(Lietal., 2021)。以上结果表明,miRNA在昆虫表型可塑机制中发挥重要的作用。
核小RNA基因U6常被选作昆虫miRNA内参基因,其广泛地表达在昆虫各组织和细胞中,且在多种昆虫miRNA的表达稳定性筛选研究中已有诸多报道,如麦长管蚜(Lietal., 2016)、小菜蛾Plutellaxylostella(Shakeeletal., 2018)、斜纹夜蛾Prodenialitura(岑永杰等, 2019)和白背飞虱Sogatellafurcifera(Changetal., 2018)等。但目前对麦长管蚜U6的序列及特征尚无文献报道。本研究通过RT-PCR技术对麦长管蚜U6 cDNA全长序列进行克隆、分析,选择前期测序获得在麦长管蚜成蚜两翅型间差异表达的9个miRNA(miR-277,miR-9a,miR-7,Let-7,miR-1,miR-315,miR-8,PC-3p-2743_844和PC-5P-113190_15),验证这些miRNA在两翅型不同发育阶段的表达模式,界定其发挥作用的具体时期,为探索开发麦长管蚜的绿色防控技术提供新思路。
1 材料与方法
1.1 试虫及样本收集
麦长管蚜成虫于2012年4月采自农业部廊坊作物有害生物科学观测试验站(39°30′42″N, 116°36′7″E),在室内已连续饲养多代,饲养条件:温度(20±1)℃、相对湿度50%~70%、光周期16L∶8D,供食小麦为北京837(感蚜品种)。从养虫笼内挑取单头无翅成蚜,连续饲养3代,构建若蚜的单克隆品系。分别收集有翅蚜和无翅蚜不同发育阶段的样本,包括伪胚胎(100头成蚜的伪胚胎)、1龄(50头)、2龄(40头)、3龄(30头)、4龄(30头)和成蚜(20头)(Lietal., 2021),每组样品取3个重复,将所有样品于液氮速冻后,-80℃冰箱保存备用。
1.2 试剂和仪器
RNA提取试剂TRI Reagent(Ambion)购自于Invitrogen Life Technologies公司,反转录试剂盒(miScript II RT Kit)购自于Qiagen公司,荧光定量试剂盒(miScript SYBR Green PCR Kit)购自于Qiagen公司。QL-902涡旋振荡仪(海门市其林贝尔仪器制造有限公司),5415D低温高速离心机(德国Eppendorf公司),NanoDrop2000微量紫外分光光度计(美国Therno Scientific公司),实时荧光定量PCR仪7500 Fast(美国Applied Biosystems公司),Imaging G6凝胶成像系统(北京鼎昊源科技有限公司)。
1.3 麦长管蚜总RNA提取及cDNA的合成
取1.1节麦长管蚜各发育阶段有翅和无翅个体样本各30 mg,利用Trizol法提取其各样本的总RNA,用微量分光光度计检测总RNA的浓度,2%的琼脂糖凝胶电泳进一步检测其质量。根据miScript Ⅱ RT Kit反转录试剂盒的操作说明,合成cDNA第1链,稀释10倍作为模板,用于qRT-PCR反应。
1.4 麦长管蚜U6的PCR克隆
麦长管蚜内参基因U6的PCR克隆分为两部分。据已知的非洲爪蟾XenopussiluranaU6(GenBank登录号: NR_033272.1)和黑腹果蝇DrosophilamelanogasterU6 cDNA序列(GenBank登录号: AH004871.2),在保守区域设计一对引物(表1)扩增麦长管蚜U6 cDNA的片段。反应体系(10 μL): 2×Taq Mix 5 μL, 上下游引物(10 μmol/L)各0.5 μL, 1.3节的cDNA模板1 μL, RNase-free Water 3 μL。反应条件: 95℃预变性5 min; 94℃变性30 s,60℃退火30 s,70℃延伸12 s,共35个循环。
3′端采用miRNA线性加尾法进行RT-PCR(用Qiagen公司miScript Ⅱ RT Kit),引物序列见表1。用1.3节得到的cDNA模板及引物进行PCR扩增,按照miScript SYBRGreen PCR Kit试剂盒使用说明书,PCR反应体系(10 μL): 2×SYBR Green Master 5 μL, 上下游引物(10 μmol/L)各0.5 μL, 模板1 μL, RNase-free Water 3 μL。PCR反应条件: 95℃预变性15 min; 94℃变性15 s, 60℃退火30 s, 70℃延伸34 s, 共40个循环; 70℃充分延伸5 min。将PCR产物回收后克隆测序。利用DNAMAN软件对麦长管蚜U6的全长序列进行拼接,然后输入NCBI数据库进行Blast比对分析。
1.5 麦长管蚜9个miRNA成熟序列的克隆
我们前期完成了麦长管蚜两种翅型miRNA文库测序及分析(Lietal., 2016),筛选出9个可能与翅型分化相关的miRNA(miR-277,miR-9a,miR-7,Let-7,miR-1,miR-315,miR-8,PC-3p-2743_844,PC-5P-113190_15)。麦长管蚜9个miRNA的上游引物采用Primer Primier 5.0设计(表1)。PCR反应体系和反应条件同1.4节。利用胶回收试剂盒对目的片段进行回收纯化,再连接到pEASY-T1载体中,转化至大肠杆菌EscherichiacoliTrans1-T1感受态细胞,最后进行菌落PCR阳性克隆鉴定,送到北京三博远志生物技术有限责任公司进行测序验证。
通用接头的长度61 bp(表1),miRNA成熟序列22 nt左右,所有的miRNA的序列长度均约为83 bp左右。9个miRNA在有翅和无翅成蚜中的PCR产物经2%琼脂糖电泳检测。
1.6 麦长管蚜9个miRNA的qRT-PCR反应
将1.3节cDNA分别进行5倍梯度稀释作为荧光定量的模板,检测9个miRNA和内参基因U6的引物特异性及扩增效率。以模板稀释倍数的lg值为横坐标,Ct值为纵坐标构建标准曲线,对引物序列的特异性和扩增效率进行评价。
按照miScript SYBR Green PCR Kit试剂盒使用说明书构建PCR反应体系(20 μL): 2×SYBR Green Master 10 μL, 上下游引物(10 μmol/L)各1 μL, 模板1 μL, RNase-free Water 7 μL。PCR反应条件: 95℃预变性15 min; 94℃变性15 s, 60℃退火30 s, 70℃延伸34 s, 共40个循环。按照仪器说明选择融解曲线条件,60℃升至95℃,60℃ 1 min,然后95℃ 30 s,自动采集荧光信号。U6及所筛选的9个miRNA的定量PCR上游引物采用Primer Premier 5.0设计(表1),本研究所有引物委托生工生物工程(上海)股份有限公司合成。下游引物为试剂盒提供的通用引物。所有发育阶段均设3个生物学重复和3个技术重复。采用2-ΔΔCt法计算麦长管蚜9个miRNA在麦长管蚜两翅型不同发育阶段的相对表达量。

表1 引物信息
1.7 数据分析
利用SAS9.2(SAS Institute Inc., Cary, NC, 美国)软件,采用单因素方差分析(one-way ANOVA, LSD分析法)分析麦长管蚜9个miRNA的相对表达量在不同发育阶段的差异显著性;采用独立样本t检验分析麦长管蚜9个miRNA的相对表达量在某一发育阶段的有翅型和无翅型之间的差异显著性。
2 结果
2.1 引物扩增特异性及扩增效率
qRT-PCR结果显示,9个miRNA和内参基因U6的溶解曲线均为单峰,表明引物具有特异性,扩增效率均在90%~104%之间,相关系数R2值均高于0.97,表明各候选基因和内参基因引物设计合理,具有良好的扩增效率和特异性,符合荧光定量分析的要求(表1)。
2.2 麦长管蚜内参基因U6 cDNA全长序列的克隆与序列分析
PCR得到U6基因片段。5′端和3′端的片段大小分别为74和100 bp左右,将得到的两段序列拼接,得到麦长管蚜的U6 cDNA序列(GenBank登录号: MZ357962),全长为92 bp。
将克隆得到的麦长管蚜U6 cDNA序列与GenBank数据库中已经登记注册的10个物种秀丽隐杆线虫Caenorhabditiselegans(GenBank登录号: X07829.1)、黑腹果蝇Drosophilamelanogaster(GenBank登录号: M24607.1)、人Homosapiens(GenBank登录号: X07425)、小鼠Musmusculus(GenBank登录号: X06980)、庆网蛱蝶Melitaeacinxia(GenBank登录号: JX878560.1)、小菜蛾Plutellaxylostella(GenBank登录号: KF307745.1)、曼氏血吸虫Schistosomamansoni(GenBank登录号: L25920.1)、有钩绦虫Taeniasolium(GenBank登录号: AF529186.1)、非洲爪蟾Xenopussilurana(GenBank登录号: NR_033272.1)和四膜虫Tetrahymenathermophile(GenBank登录号: X53790.1)的U6 cDNA序列进行同源性分析,核苷酸序列一致性分别为83.5%, 88.12%, 86%, 87%, 78.26%, 89.11%, 75.42%, 89%, 80.56%和68.93%,其中与小菜蛾的最高,与四膜虫的最低(图1)。

图1 11种生物U6 cDNA的序列比对
2.3 麦长管蚜9个miRNA成熟序列的克隆测序
结果表明在麦长管蚜的有翅和无翅成蚜中均得到9个miRNA的一条特异性片段。将目的片段DNA凝胶回收后,通过pEASY-T1载体转化到大肠杆菌Trans1-T1感受态细胞中,进行菌落PCR阳性克隆鉴定,目的片段预期在190 bp左右,之后进行测序。克隆测序得到的序列和预测的miRNA序列吻合较好。
2.4 9个miRNA在麦长管蚜两翅型不同发育阶段的表达
qRT-PCR结果表明,9个miRNA在麦长管蚜有翅蚜和无翅蚜伪胚胎、各龄期若蚜及成蚜中均有表达,但不同miRNA在不同发育阶段的相对表达量不同(图2)。大部分miRNA在伪胚胎期及若蚜期的相对表达量均较低,在成蚜期相对表达量较高,且6个miRNA(miR-277,miR-9a,miR-7,Let-7,miR-1和miR-315)在有翅成蚜中的相对表达量高于在无翅成蚜中的,有翅成蚜和无翅成蚜中的相对表达量与其他发育阶段相比差异显著(有翅蚜:FmiR-277=86.11,PmiR-277<0.001;FmiR-9a=8.23,PmiR-9a=0.0014;FmiR-7=16.12,PmiR-7<0.0001;FLet-7=25.53,PLet-7<0.0001;FmiR-1=29.49,PmiR-1<0.001;FmiR-315=17.82,PmiR-315<0.0001; 无翅蚜:FmiR-277=5.70,PmiR-277=0.0064;FmiR-9a=4.82,PmiR-9a=0.0120;FmiR-7=9.60,PmiR-7=0.0007;FLet-7=33.39,PLet-7<0.0001;FmiR-1=2.75,PmiR-1=0.042;FmiR-315=26.13,PmiR-315<0.0001)。
其中miR-277和miR-9a在有翅成蚜期的相对表达量较高,分别达到17.35±2.90和16.63±2.14,约是其若蚜期和伪胚胎期的50倍(图2: A, B)。除miR-315外,miR-277,miR-9a,miR-7,Let-7和miR-1在成蚜期的相对表达量在两翅型间均差异显著(tmiR-277=8.94,PmiR-277=0.0123;tmiR-9a=10.41,PmiR-9a=0.0091;tmiR-7=11.34,PmiR-7=0.0077;tLet-7=6.22,PLet-7=0.0249;tmiR-1=41.71,PmiR-1=0.0006)。miR-9a和miR-315分别在伪胚胎和3龄若蚜期相对表达量在两翅型间差异显著(tmiR-9a=-3.46,PmiR-9a=0.0259;tmiR-315=-4.70,PmiR-315=0.0093)(图2: B, F)。此外,miR-9a在无翅蚜的各个发育阶段中,其伪胚胎期的相对表达量最高。
miR-8,PC-3p-2743_844和PC-5p-113190_15在无翅成蚜中的相对表达量较高。其中miR-8(图2: G)和PC-3p-2743_844(图2: H)在有翅成蚜和无翅成蚜期相对表达量显著高于在其他发育阶段(有翅蚜:FmiR-8=16.27,PmiR-8<0.0001;FPC-3p-2743_844=3.56,PPC-3p-2743_844=0.0333; 无翅蚜:FmiR-8=5.17,PmiR-8=0.0093;FPC-3p-2743_844=26.87,PPC-3p-2743_844<0.0001),而PC-5p-113190_15在无翅蚜3龄若蚜期相对表达量显著高于在其他发育阶段(F=18.62,P<0.0001)(图2: I)。miR-8在成蚜期的相对表达量在两翅型间差异显著(t=-6.12,P=0.0257),PC-3p-2743_844在伪胚胎和成蚜期的相对表达量在两翅型间差异显著(伪胚胎:t=-2.96,P=0.0417; 成蚜期:t=-9.43,P=0.0111)。PC-5p-113190_15在3龄若蚜期的相对表达量在两翅型间呈现极显著差异(t=-12.55,P=0.0002)。
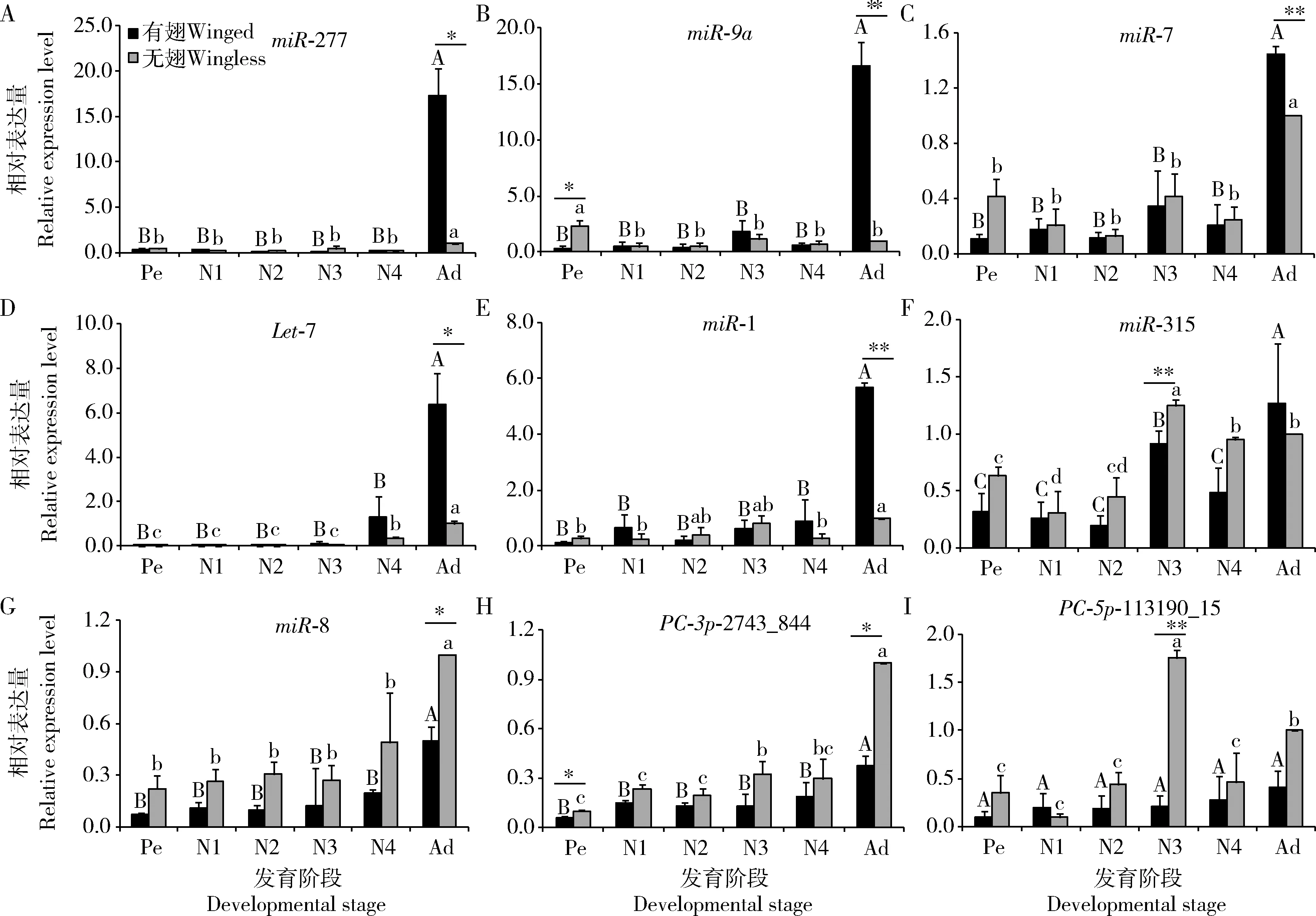
图2 麦长管蚜两翅型不同发育阶段9个miRNA的表达谱
3 讨论
本研究分析了9个miRNA在麦长管蚜两翅型间、不同发育阶段的表达模式,其中7个miRNA(miR-277,miR-9a,miR-7,Let-7,miR-1,miR-315和miR-8)在其他昆虫中已经报道可能参与昆虫翅发育的过程,而PC-3p-2743_844和PC-5P-113190_15是在麦长管蚜中新鉴定的miRNA,本研究对其相关功能进行了探讨。此外,本研究通过克隆获得麦长管蚜U6 cDNA全长序列。序列同源性分析结果表明,麦长管蚜与其他昆虫如小菜蛾、庆网蛱蝶等的U6 cDNA序列一致性比较高(图1),表明其在昆虫不同种间保守性比较高。而且U6作为miRNA传统的内参基因,常被用来评估miRNA目的基因的表达(Lin and Lai, 2013; Hanetal., 2014; Gharbietal., 2015),因此本研究选择U6作为定量表达的内参基因。
miRNA在不同组织、不同发育阶段中的表达模式不相同,还有一些仅在特定发育阶段或特定的组织中表达(Liuetal., 2008)。本研究检测的麦长管蚜9个miRNA中,大部分miRNA在伪胚胎期及若蚜期的相对表达量均较低,在成蚜期相对表达量较高(图2),表明miRNA随着成蚜个体miRNA表达量的增加,发挥调控作用可能集中在成虫阶段,但这还需要通过验证靶基因的表达进一步证实。
miR-277在有翅成蚜中相对表达量最高(图2: A),这种高表达现象在豌豆蚜Acyrthosiphonpisum中也存在(杨宗霖等, 2019)。有研究发现果蝇的miR-277可以通过调控Pacman控制翅原基生长(Jonesetal., 2013),也能够抑制胰岛素的信号,缩短其寿命(Esslingeretal., 2013)。在本研究结果中,miR-277无论是在有翅成蚜还是在无翅成蚜中,其相对表达量均与在其他龄期的呈现显著差异;与在有翅成蚜期的相比,在无翅成蚜期的相对表达量下调,推测miR-277可能参与延长麦长管蚜有翅成蚜的寿命,这与有翅蚜长距离迁飞的行为有关。此外,Xu等(2015)已经证实,胰岛素信号通路参与了褐飞虱的翅型分化,结合先前的在果蝇中的研究发现miR-277能够抑制果蝇胰岛素的信号(Esslingeretal., 2013),推测miR-277在蚜虫翅型分化中也可能起着重要的作用。
miR-9a影响果蝇翅的发育,其可通过抑制靶基因LIM-only的表达,引起果蝇翅组织缺失及异位细胞凋亡(Biryukovaetal., 2009),也可通过抑制senseless引起其翅原基细胞凋亡(Bejaranoetal., 2010)。本研究发现,在无翅蚜中,麦长管蚜的miR-9a在伪胚胎期表达量最高,且在两翅型间差异显著(图2: B)。伪胚胎期是麦长管蚜翅型分化敏感时期之一,易受到外界因子的影响(Ankersmit and Dijkman, 1983; Mülleretal., 2001)。组织学研究也已经明确,在许多蚜虫类群中,出生时都有一个翅原基(Braendleetal., 2006),只是在发育成为无翅型的过程中翅原基发生退化。这从侧面证明,miR-9a可能在伪胚胎时期就开始对靶基因进行调控,使其朝向无翅蚜方向发育。目前有研究已经证实,在褐色桔蚜中miR-9a同源基因miR-9b负向调控ABCG4的表达,ABCG4通过调控IRP3的表达影响胰岛素信号通路的活性从而调控其翅的发育(Shangetal., 2020),这进一步为miR-9a在麦长管蚜翅型发育中的作用提供了依据。
Legeai等(2010)在豌豆蚜中研究发现,与无翅雌性蚜相比,Let-7和miR-100在有翅侨迁蚜中的表达是上调的,这与本研究结果一致。本研究也发现麦长管蚜Let-7在无翅成蚜中的表达是下调的,且在两翅型间差异显著(图2: D),表明Let-7可能在麦长管蚜表型差异中起着非常重要的作用,这进一步表明miRNA在不同种的蚜虫间保守性较高,表达趋势也基本一致。蜕皮激素信号通路也在昆虫多型性分化中发挥重要作用(Zhang CXetal., 2019;Zhang RJetal., 2019)。已有研究证实,在家蚕Bombyxmori和果蝇中Let-7通过直接或间接方式参与昆虫的蜕皮调控,抑制其表达后不能正常蜕皮(Lingetal., 2014),或抑制成虫背腹部的神经肌肉接头发育(Caygill and Johnston, 2008)。而对于麦长管蚜来说,Let-7是否影响其蜕皮过程,还需要后期深入研究。
此外,miR-1,miR-7,miR-8和miR-315也都通过不同方式参与了昆虫翅发育的调控。如miR-1可能参与了蝗虫胸部飞行肌和翅的发育(Weietal., 2009),抑制果蝇miR-7的表达,可引起翅体积的减小(Aparicioetal., 2015),miR-8控制其翅色素沉积和羽化(Kennelletal., 2012),miR-315是翅发育wingless的信号调控者(Silveretal., 2007),这些与翅发育相关的miRNA均都能注释到豌豆蚜的基因组中(Brissonetal., 2010),且其中的一些miRNA在桃蚜Myzuspersicae的两翅型间也差异表达(Ghanimetal., 2006)。此外,通过干扰miR-2,miR-306和miR-14的表达均引起麦长管蚜翅畸形发育(Lietal., 2021)。以上结果均表明miRNA在麦长管蚜翅发育过程中发挥着不可忽视的作用。
本研究筛选出的与蚜虫翅型分化相关的9个miRNA在两翅型不同发育阶段表现出不同的表达模式。根据结果推测,这些差异或特异表达的miRNA可能在伪胚胎或成虫阶段对蚜虫翅型发育进行调控,但具体靶向哪个基因,参与哪个调控通路,值得进一深入研究。

