白背飞虱SfABCD1对杀虫剂胁迫的响应表达
曾庆会, 周 操, 杨熙彬, 杨 洪,3,*, 金道超, 龙贵云
(1.贵州大学昆虫研究所, 贵州山地农业病虫害重点实验室, 农业农村部贵阳作物有害生物科学观测试验站, 贵阳 550025;2.重庆师范大学生命科学学院, 重庆 401331; 3.贵州大学烟草学院, 贵阳 550025)
白背飞虱Sogatellafurcifera是水稻上一种典型的r对策、迁飞性害虫(Kisimoto, 1976),主要以3种方式危害水稻:一是成虫、若虫直接刺吸为害;二是雌成虫产卵时破坏水稻的输导组织;三是传播南方水稻黑条矮缩病毒(southern rice black-streaked dwarf virus, SRBSDV),给水稻生产造成极大的损失(Zhouetal., 2008)。应用杀虫剂仍然是控制白背飞虱最有效的方法之一,但杀虫剂的使用导致白背飞虱对多种杀虫剂产生了不同程度的抗性(Matsukawa-Nakataetal., 2019; Ruanetal., 2021)。在江苏、四川、福建和两广地区对稻飞虱的抗药性水平的监测发现,白背飞虱对新烟碱类杀虫剂吡虫啉(imidacloprid)、噻虫嗪(thiamethoxam)和呋虫胺(dinotefuran)的抗性倍数为1~15倍;对生长调节剂类杀虫剂噻嗪酮(buprofezin)的抗性倍数高达50~184倍(张帅, 2021)。经典的害虫抗药性研究主要集中于细胞色素P450酶系(简称P450s)、羧酸酯酶(carboxylesterases, CarEs)和谷胱甘肽-S-转移酶(glutathione S-transferases, GSTs)3个家族中(Zhouetal., 2013; Kangetal., 2018; Yangetal., 2018; Zhouetal., 2018; Alietal., 2019; Wangetal., 2020)。例如:有报道显示,白背飞虱体内CarE活性增强而导致对井冈霉素(jinggangmycin)产生抗性(Geetal., 2017),同样,促进P450和GST活性也会对噻嗪酮产生抗性(Alietal., 2019)。随着害虫抗药性分子水平的深入研究,昆虫ABC转运蛋白(ATP-binding cassette transporter, ABC transporter)被认为是除了P450s, GSTs和CarEs之外参与内外源物质解毒作用的重要蛋白家族,在不同种类杀虫剂的转运或抗性形成过程中发挥重要作用(Wuetal., 2019)。
ABC转运蛋白作为一种外排泵,主要利用ATP将物质(包括离子、肽类、激素、营养物质、外源物质和药物)进行跨膜运输(Bakeretal., 2015),这种现象普遍存在于多种生物体内(Deanetal., 2001; Wuetal., 2019)。昆虫ABC转运蛋白通常被分成了8个亚家族(ABCA-H),其中ABCE亚族与ABCF亚族不属于跨膜蛋白,且没有转运功能(Broehanetal., 2013)。在大多数昆虫中,ABC转运蛋白通过转运外源物质的方式来表现出对杀虫剂的抗性(Buss and Callaghan, 2008; Liuetal., 2019)。近些年,关于ABC转运蛋白参与昆虫抗性的研究愈来愈多,且主要集中于ABCB, ABCC和ABCG亚家族基因(Dermauw and Van Leeuwen, 2014),如ABCG基因在阿拉伯按蚊Anophelesarabiensis和黑腹果蝇Drosophilamelanogaster二氯二苯三氯乙烷(dichlorodiphenyltrichloroethane, DDT)抗性种群中表达水平更高(Pedraetal., 2004; Jonesetal., 2012);小菜蛾PlutellaxylostellaABCA, ABCC, ABCG, ABCH和ABCF亚家族的ABC转运蛋白在毒死蜱(chlorpyrifos)抗性菌株中过表达(Youetal., 2013; Nakaishietal., 2018);采用CRIPSR/Cas9系统敲除ABCC2和ABCC3基因后,发现这两个基因参与了小菜蛾Cry1Ac抗性(Guoetal., 2019)。瓜实蝇Bactroceracucurbitae在阿维菌素(abamectin)、β-氯氰菊酯(beta-cypermethrin)和呋虫胺(dinotefuran)3种杀虫剂胁迫后,ZcABCB7和ZcABCC2基因的表达显著上调,表明这两个基因可能参与了瓜实蝇对异源物质的代谢(Xuetal., 2021)。在稻飞虱中,对于ABCD亚家族基因在昆虫中参与杀虫剂抗性的报道目前仅见于灰飞虱Laodelphaxstriatellus中(Sunetal., 2017),并推测LsABCD1基因与灰飞虱抗药性的形成密切相关。
本研究以白背飞虱转录组(Zhouetal., 2018)和基因组(Wangetal., 2017)数据为基础,利用RT-PCR技术克隆获得了ABC转运蛋白D亚家族基因SfABCD1完整的开放阅读框,通过RT-qPCR技术检测SfABCD1基因在白背飞虱不同发育阶段、不同组织以及在不同浓度的噻虫嗪、噻嗪酮和阿维菌素胁迫后的表达特性。旨在探究SfABCD1基因对杀虫剂胁迫的响应,为进一步探究白背飞虱对药剂的适应及抗性产生的分子机制提供理论基础。
1 材料与方法
1.1 供试虫源
白背飞虱采于2013年贵州省贵阳市花溪区水稻田;在实验室内不接触任何农药的条件下,以水稻TN1饲喂至今。饲养条件为温度25±1℃,相对湿度70%±10%,光周期16L∶8D。不同发育阶段样品收集白背飞虱1-5龄若虫和羽化后第1-4天雌雄成虫。不同组织样品包括5龄若虫和成虫的头部、体壁、脂肪体、肠道、足、翅、精巢和卵巢。每个样品取30头虫,重复3次取样,确保数据的准确性。
1.2 供试试剂
杀虫剂97%噻嗪酮原药(杂环类)购自广西平乐农药厂,96%噻虫嗪原药(烟碱类)购自南京盼丰化工有限公司,96.4%阿维菌素原药(大环内酯类)购自山东齐发药业有限公司。HP Total RNA Kit(Omega Bio-Tek, Norcross, GA, 美国);PrimeScript®RT Reagent Kit(TaKaRa, 日本);2×EasyTaq PCR SuperMix(全式金生物技术有限公司, 北京);FastStart Essential DNA Green Master Mix(Roche, Indianapolis, IN, 美国)。
1.3 总RNA提取与cDNA合成
将1.1节所取白背飞虱样品或组织参照HP Total RNA试剂盒说明书提取总RNA。使用1%琼脂糖凝胶电泳检测提取的总RNA质量,参照PrimeScript®RT Reagent Kit试剂盒说明书合成cDNA第1链。
1.4 SfABCD1的克隆
基于白背飞虱的转录组(GenBank登录号: SRP116252)和基因组(GenBank登录号: PRJNA331022)数据获得SfABCD1基因片段,比对确认后,通过Primer Premier 6.0软件设计扩增SfABCD1基因的特异性引物(表1),并通过RT-PCR法进行扩增验证,反应体系: 上下游引物(10 μmol/L)各1 μL, PCR Mix 12.5 μL, cDNA模板3 μL, ddH2O 7.5 μL。PCR扩增条件: 95℃预变性3 min; 95℃变性30 s, 55℃退火30 s, 72℃延伸1~3 min, 30个循环;最后72℃延伸10 min,置于4℃保存。PCR产物经1%的琼脂凝胶电泳检测合格后,将扩增产物纯化后连接到pMD18-T载体上进行克隆,并送往上海生工生物工程有限公司进行测序。
1.5 序列分析
根据克隆获得的序列,使用在线BLAST工具与其他物种同源基因进行相似性比对。通过DNAMAN 6.0软件(LynnonBiosoft, Quebec, 加拿大)预测氨基酸序列和开放阅读框(ORF);使用Swiss-Prot(ExPASy server)工具的“Compute pI/Mw”(http:∥au.expasy.org/tools/pi_tool.html)分析SfABCD1的分子量和理论等电点;利用PFAM软件(http:∥pfam.xfam.org/)预测SfABCD1的保守结构域;采用MEGA 7.0软件中的邻接法(neighbor-joining, NJ)构建系统发育树,重复1 000次(Kumaretal., 2016)。
1.6 SfABCD1基因的时空表达特性分析
根据克隆所获得的序列设计RT-qPCR的特异性引物(表1),检测SfABCD1的时空表达特性,以RPL9基因(GenBank登录号: KM885285)作为内参基因(Anetal., 2015)。根据表1中所设计的引物,以1.3节合成的cDNA为模板,在CFX96TMReal-time Quantitative PCR System(BioeRad, Hercules, CA, 美国)中进行RT-qPCR。每个样品设3次技术重复。qPCR反应体系: 上下游引物(10 μmol/L)各1 μL, FastStart Essential DNA Green Master Mix 10 μL, cDNA模板1 μL, ddH2O 7 μL。PCR扩增程序: 95℃预变性2 min; 95℃变性30 s, 50℃退火并延伸30 s(循环40次);最后进行60-95℃溶解曲线分析。
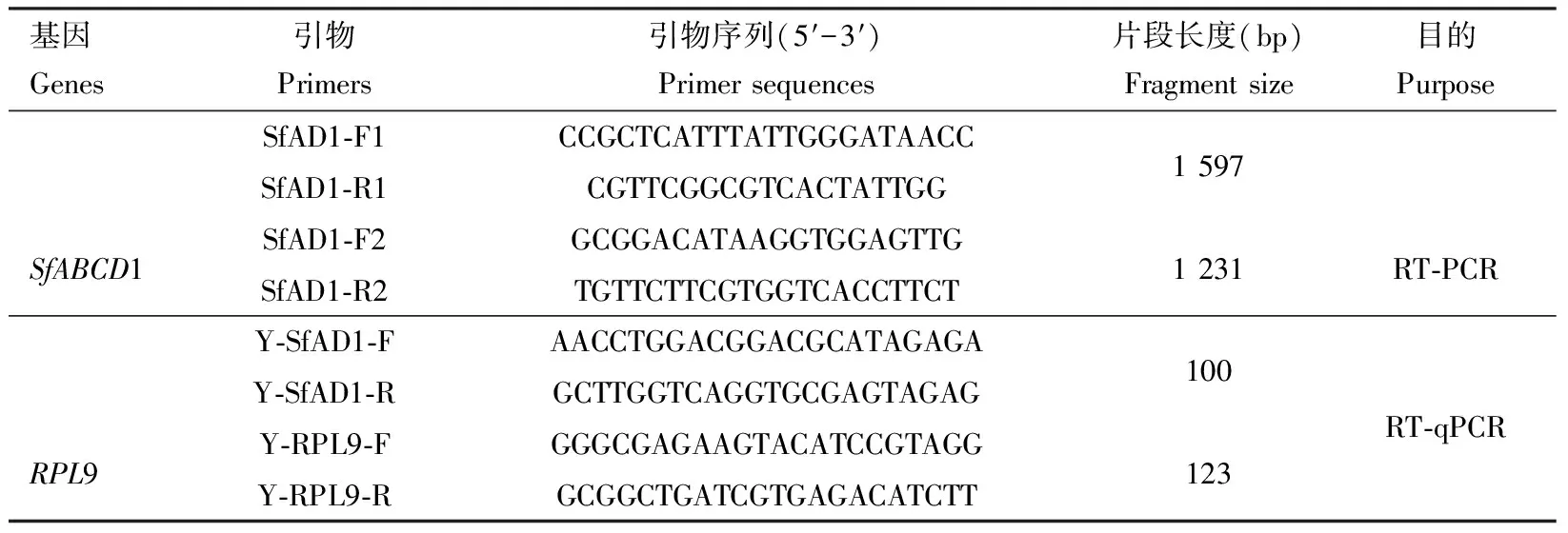
表1 引物信息
1.7 不同杀虫剂胁迫后SfABCD1基因的表达分析
基于本课题组前期对白背飞虱毒力测定的结果(刘磊磊等, 2015),噻虫嗪、噻嗪酮和阿维菌素各配制4个浓度(LC10, LC25, LC50和LC90),使用稻茎浸渍法(Wangetal., 2018)处理稻茎:将各组水稻浸入已配制的杀虫剂药液中30 s,以清水处理作为对照(CK);将处理后的水稻苗自然晾干植株表面水分,再用棉花包裹水稻根部并浸湿以保持其水分,放入两通玻璃试管内(内径3 cm,长30 cm)。挑选白背飞虱3龄若虫,以3种杀虫剂不同浓度进行胁迫,将处理后的试管置于人工气候箱内饲养,饲养条件同1.1节。饲养48 h后挑选存活若虫,换干净的试管与秧苗继续饲养;胁迫48, 96和120 h后进行取样,每个处理取15头存活若虫,设置3次生物学重复。将所取样品置于-80℃冰箱中保存备用。总RNA提取和cDNA第1链合成的方法同1.3节。进行RT-qPCR(同1.6节),检测不同浓度杀虫剂胁迫后的白背飞虱SfABCD1基因的表达量。
1.8 数据分析
数据用SPSS21.0进行分析;用2-ΔΔCt法计算白背飞虱SfABCD1的相对表达量(Livak and Schmittgen, 2001);采用单因素方差分析(one-way ANOVA)检验处理效果,采用LSD多重比较分析处理间的差异显著性。
2 结果
2.1 SfABCD1基因克隆和序列特征
从白背飞虱基因组和转录组数据中获得一个ABC转运蛋白家族基因;通过克隆验证,最终获得长度为2 306 bp的基因序列:采用NCBI比对,确定了该基因为白背飞虱ABC转运蛋白D亚家族基因,将其命名为SfABCD1(GenBank登录号: MW701394)。SfABCD1 cDNA序列包含一个完整的2 220 bp的开放阅读框(ORF),编码739个氨基酸;其分子式为C3686H5871N993O1058S33,分子量约为82.08 kD,理论等电点(pI)为9.32。在氨基酸组成中,负电荷残基总数有65个,正电荷残基总数有87个;不稳定系数为33.23,说明该蛋白可能是稳定蛋白。根据20种氨基酸比例分析,其中最多的是亮氨酸(Leu),占总氨基酸的11.1%,色氨酸(Tyr)占比最少,仅占总氨基酸数的1.1%。
SfABCD1转运蛋白包含有1个亲水的核苷酸结合域(nucleotide binding domain, NBD)和1个疏水的跨膜结构域(transmembrane domain, TMD),表明SfABCD1转运蛋白属于半分子转运蛋白。系统发育树显示(图1):SfABCD1与灰飞虱Laodelphaxstriatellus、褐飞虱Nilaparvatalugens、棉蚜Aphisgossypii、桃蚜Myzuspersicae的ABCD亚族成员亲缘关系相对较近,其中与灰飞虱的亲缘关系最近,与褐飞虱的次之,与其他昆虫的ABCD亚族成员亲缘关系相对较远。
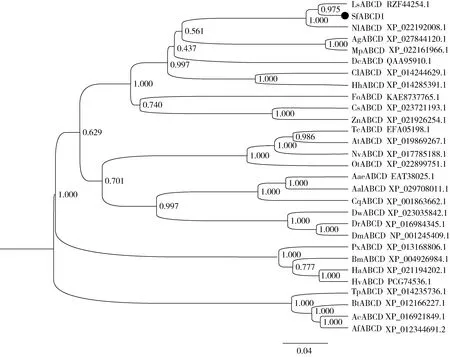
图1 邻接法构建的基于氨基酸序列的白背飞虱SfABCD1和其他昆虫ABCD的系统发育树(1 000次重复)
2.2 SfABCD1的时空表达
SfABCD1的表达量在1-3龄若虫中随龄期增大而下降,此后随龄期增大而上升,且在5龄第2天若虫中达峰值。在成虫期,表达量较5龄若虫期显著降低(P<0.05),且在雄成虫中,表达量呈现随着时间推移下降(图2: A)。SfABCD1基因在5龄若虫不同组织中的表达量由高到低为肠道>头部>体壁>足>脂肪体,在肠道中的表达量显著高于其他组织中的(P<0.05)(图2: B);对于成虫而言,该基因在翅中的表达量显著高于在其他组织中的(P<0.05)(图2: C);且在若虫和成虫的脂肪体和足中的表达量无显著差异(P>0.05)。
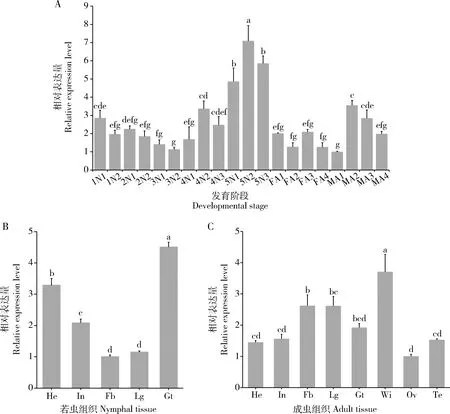
图2 SfABCD1在白背飞虱不同发育阶段(A)以及5龄若虫(B)和成虫(C)不同组织中的表达谱
2.3 杀虫剂胁迫下SfABCD1基因表达
LC10, LC25和LC50浓度噻虫嗪胁迫48 h后的SfABCD1基因表达量显著高于对照组(P<0.05),其响应趋势随浓度增加而下降,但LC90处理组与对照组相比无显著差异(P>0.05);处理96 h后,仅在LC10和LC50浓度下SfABCD1表达量显著高于对照组(P<0.05);至120 h时,与对照组相比,所有处理组均无显著差异(P>0.05)(图3: A)。LC10, LC50和LC90浓度噻嗪酮胁迫48 h后的SfABCD1基因表达量均显著高于对照组(P<0.05),但LC25处理下无显著性变化(P>0.05);在96 h后,仅有LC10和LC50浓度下SfABCD1显著高表达(P<0.05);处理120 h后与对照组相比均不显著(P>0.05)(图3: B)。LC10和LC25浓度阿维菌素胁迫48 h和96 h后SfABCD1基因相对表达量与对照组比较没有显著性变化(P>0.05),但LC50和LC90浓度处理后SfABCD1基因的表达量显著高于对照组(P<0.05);而处理120 h后,与对照组相比均无显著差异(P>0.05)(图3: C)。LC10, LC25, LC50和LC904个浓度的3种杀虫剂处理48, 96和120 h后与对照组相比,胁迫48 h的SfABCD1表达水平与对照差异最大,胁迫96 h时表达差异下降,处理120 h时其表达水平几乎接近对照组。
3 讨论
本研究以白背飞虱转录组和基因组数据为基础,采用RT-PCR技术克隆得到一个ABCD亚家族转运蛋白基因的完整ORF序列,根据其保守结构域和序列相似性将其命名为SfABCD1。保守结构域分析结果发现与灰飞虱的结果(Sunetal., 2017)一致,表明SfABCD1属于典型半分子转运蛋白。SfABCD1与其他昆虫ABCD系统发育树显示,与灰飞虱、褐飞虱ABCD亚族亲缘关系较近(图1),暗示着它们之间的相关性高。
RT-qPCR结果表明,SfABCD1基因在整个若虫期均有表达,且在5龄若虫期高表达,随后成虫期表达量下降(图2: A),表明SfABCD1在白背飞虱具有时间表达特异性,与其他昆虫转运蛋白ABC的表达模式类似,例如:ABCC2在棉铃虫整个发育阶段均有表达,在5龄幼虫阶段表达量最高(杨帆, 2013);禾谷缢管蚜Rhopalosiphumpadi的3个基因ABCG9,ABCG20和ABCG23在3-4龄若蚜阶段表达最高(康新乐等, 2015)。ABC转运蛋白可利用ATP水解产生的能量进而将糖类、氨基酸、抗生素、脂肪酸等各种物质进行跨膜运输,以维持昆虫正常变态发育的生理过程(Bakeretal., 2015)。SfABCD1基因在白背飞虱不同发育段的表达水平不同,由此可以推测,SfABCD1在白背飞虱的生长发育过程中可能在某些关键的时间点上起重要的作用。
昆虫的消化道主要有摄取、运送、消化和吸收功能,还具有水分平衡和排泌的特殊功能,并在杀虫剂代谢中具有重要意义(Wuetal., 2020)。有研究报道ABCB与ABCG基因在褐飞虱5龄若虫中肠中的表达量最高(闸雯俊等, 2014, 2020)。在桔小实蝇Bactroceradorsalis18个BdABC基因中,约2/3的BdABC基因主要在中肠和马氏管等组织中高表达(Xiaoetal., 2018)。在冈比亚按蚊Anophelesgambiae多种ABC转运蛋白高度富集于中肠和马氏管中,并在抗拟除虫菊酯的种群中显著表达(Pignatellietal., 2018)。在本研究中发现,SfABCD1基因在白背飞虱若虫期的肠道中高表达(图2),推测其可能参与了外源物质的代谢。同时,ABC转运体也是血脑屏障(blood-brain barrier, BBB)上重要的一个组成部分,其表达和转运功能的增加会促进脑组织内药物外排,从而保护脑神经、影响药物向中枢神经系统的传递(Miller, 2010; Grubeetal., 2018)。本研究同样发现SfABCD1基因在若虫头部高表达(图2),表明该基因可能参与头部对异源物质的外排。
代谢能力增强是昆虫抗药性产生的重要原因之一,ABC转运蛋白作为排毒的重要参与角色,有报道表明其与杀虫剂抗性有关。例如,在桃蚜的抗蚜威(pirimicarb)抗性品系中,ABCG和ABCH亚家族基因表达水平显著高于敏感品系(Silvaetal., 2012);马拉硫磷(malathion)、阿维菌素和β-氯氰菊酯(beta-cypermethrin)的LD50胁迫桔小实蝇后,分别有4, 10和14个BdABC基因的表达量显着上调;利用RNAi技术沉默BdABCB7基因后,发现该基因能诱导杀虫剂马拉硫磷抗性的产生(Xiaoetal., 2018)。在白背飞虱中,ABC转运蛋白会上调其表达量来响应杀虫剂胁迫。例如,以低浓度(LC15)的环氧虫啶(cycloxaprid)处理白背飞虱后,有2个ABCG基因显著上调;而在高浓度(LC85)处理后,有1个ABCG基因和1个ABCC基因的表达被显著上调(Yangetal., 2016);另外,白背飞虱ABCG和ABCB亚家族基因也参与了噻虫嗪、噻嗪酮和阿维菌素胁迫的响应(Zhouetal., 2019; 曾庆会等, 2020)。在本研究中,噻嗪酮(LC10, LC50和LC90),噻虫嗪(LC10, LC25和LC50)与阿维菌素(LC50和LC90)胁迫48 h后的SfABCD1基因表达量均显著上调(P<0.05)(图3),其中噻虫嗪浓度升高,SfABCD1基因的表达水平大致呈下降趋势,不同的是,LC25浓度噻嗪酮胁迫下与对照组相比无显著性差异;另外,LC50和LC90浓度阿维菌素处理后显著上调。对于3种杀虫剂胁迫后SfABCD1基因表现出不同的表达水平,导致这一结果的原因可能是由于SfABCD1对于不同杀虫剂的响应机制不同。桔小实蝇ABC转运蛋白在杀虫剂胁迫下的研究中发现,胁迫48 h后大多数BdABC基因(包括BdABCF,BdABCG和BdABCH)表现出最高表达水平,其中BdABCD1在LD50马拉硫磷与阿维菌素胁迫24, 48和72 h后,仅在48 h表现出最大转录水平(Xiaoetal., 2018)。本研究中发现,SfABCD1对噻嗪酮、噻虫嗪和阿维菌素3种杀虫剂胁迫的响应具有一定的时间效应,SfABCD1的表达水平与对照组相比,其在胁迫48 h后的差异表达倍数最大,且随着处理时间的推移呈下降趋势;胁迫120 h后,该基因转录水平接近对照组(图3)。这些结果表明,SfABCD1基因在白背飞虱响应杀虫剂的胁迫中起重要作用,在后期的响应中的作用较小。本研究中仅对胁迫白背飞虱48, 96和120 h后SfABCD1基因的表达水平进行了测定,其在48 h之前的转录水平的变化尚不清楚,在今后的研究中还需要系统地进行研究,进一步明确其在白背飞虱前期响应杀虫剂胁迫中的功能。此外,有研究表明昆虫体内解毒酶对杀虫剂的代谢存在着剂量效应(Fournier and Brodeur, 2002)。3种亚致死浓度(LC10, LC20, LC30)噻虫嗪对月季长管蚜Macrosiphumrosivorum乙酰胆碱酯酶、谷胱甘肽-S-转移酶、羧酸酯酶活力上表现出一定的剂量效应(袁家瑜等, 2020)。本研究中也发现,SfABCD1对噻嗪酮、噻虫嗪和阿维菌素3种杀虫剂胁迫的响应存在着显著的剂量效应,随着杀虫剂浓度的增加,SfABCD1的表达水平呈现出逐渐升高或降低的趋势(图3)。但值得注意的是,在LC25噻嗪酮处理组中SfABCD1的表达水平与对照组无显著性差异。出现这一差异的原因,目前尚不清楚,还有待进一步的研究。
总之,本研究获得了白背飞虱SfABCD1基因完整的开放阅读框,并发现其在若虫消化道和头部中高表达,明确了SfABCD1的时空表达特性;初步阐明SfABCD1基因应对不同外源物质、不同药剂剂量以及不同时间点的表达模式,该结果为进一步明确SfABCD1基因响应杀虫剂胁迫的机制提供理论基础。

