SfHMGR在白背飞虱生殖调控中的功能分析
周 操, 杨熙彬, 龚明富, 杨 洪,3,*, 龙贵云,贾泽艳, 曾庆会, 金道超
(1.重庆师范大学生命科学学院,重庆 401331; 2.贵州大学昆虫研究所, 贵州山地农业病虫害重点实验室,农业农村部贵阳作物有害生物科学观测试验站, 贵阳 550025; 3.贵州大学烟草学院, 贵阳 550025)
保幼激素(juvenile hormone, JH)是昆虫咽侧体中合成的一种半萜类化合物,参与调控昆虫的发育、变态和生殖等过程(Shelbyetal., 2007; Jindraetal., 2013; Royetal., 2018)。JH与保幼激素结合蛋白(juvenile hormone binding protein, JHBP)结合形成复合体,经血液循环运送至特定组织或器官的细胞核后,与其核受体蛋白Met(methoprene-tolerant)结合,形成JH-Met复合体,在JH的作用下,Met再与另外一个bHLH-PAS家族蛋白Taiman(或者称之为steroid receptor coactivator, SRC)形成二聚体,传递保幼激素信号,激活下游的转录因子Krüpple-homologue 1(Kr-h1)等基因的表达,最终调控昆虫的发育、变态和生殖等过程(Kayukawaetal., 2017; Royetal., 2018)。
3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase, HMGR)是JH合成途径中的上游蛋白,催化HMG-CoA还原成甲羟戊酸,再经过法尼焦磷酸合成酶催化形成法尼焦磷酸(FPP)(Bellésetal., 2005; 李娟等, 2012)。该过程是JH和胆固醇/固醇类物质生物合成共有的反应途径(Bellésetal., 2005)。迄今为止,已在许多昆虫物种中鉴定出HMGR同系物,包括华山松大小蠹Dendroctonusarmandi(Yuetal., 2015)、黑腹果蝇Drosophilamelanogaster(Gertleretal., 1988)、家蚕Bombyxmori(Kinjohetal., 2007)、棉铃虫Helicoverpaarmigera(Wangetal., 2013)、小地老虎Agrotisipsilon(Duportetsetal., 2000)、太平洋折翅蠊Diplopterapunctata(Huangetal., 2015)、桔小实蝇Bactroceradorsalis(Yangetal., 2018)和德国小蠊Blattelagermanica(Martinez-Gonzalezetal., 1993)等。已有研究表明,HMGR参与了昆虫的激素合成以及生长发育和繁殖的调控。例如:沉默桔小实蝇的BdHMGR基因表达后,能够抑制雌虫卵巢发育(Yangetal., 2018);使用RNAi技术靶向沉默棉铃虫HaHMGR基因表达后,显著抑制了雌虫的产卵和HaVg基因的表达(Wangetal., 2013);此外,干扰中华豆芫菁Epicautachinensis成虫EcHMGR的表达可导致斑蝥素合成的显著下降,而外源性JH可提高斑蝥素的产量(Lüetal., 2016)。
白背飞虱Sogatellafurcifera属于典型的r对策的迁飞性害虫,具有极强的繁殖力,易暴发成灾(金剑雪等, 2017; Yangetal., 2020),能够通过若虫、成虫刺吸水稻汁液以及传播南方水稻黑条矮缩病毒,严重影响水稻的产量和品质(Zhouetal., 2008; Otuka, 2013; Wuetal., 2017)。目前对于该虫的防治仍以化学防治为主,但长期大量地使用杀虫剂致使其对多种杀虫剂产生了严重的抗性(Alietal., 2019; Ruanetal., 2021; 张帅, 2021)。因此,寻找新的作用靶标,开发新的高效、安全的杀虫剂对于该虫的防治具有重要意义。生殖相关基因在昆虫的繁殖与发育过程中起着至关重要的作用,本研究基于已公布的白背飞虱基因组(Wangetal., 2017)和转录组(Zhouetal., 2018)数据,鉴定出白背飞虱JH生物合成中的关键基因SfHMGR,采用RT-PCR技术对其序列进行验证,使用RT-qPCR技术测定其时空表达特性,并通过RNAi技术靶向沉默SfHMGR后观察雌虫卵巢的发育情况、统计产卵量,测定JH生物合成下游基因和信号转导相关基因及卵巢发育关键基因的转录水平,研究其在白背飞虱生殖中的功能,为白背飞虱的绿色防控提供新的科学依据和作用靶标。
1 材料与方法
1.1 供试昆虫
白背飞虱种群于2013年采集自贵州省贵阳市花溪区水稻田(26°31.302″N, 106°62.294″E),并在实验室内一直以不接触任何农药的处于分蘖期的TN1水稻饲养至今(周操等, 2016)。饲养室内的条件为:温度25±1℃,相对湿度70%±5%,光周期16L∶8D。
1.2 总RNA的提取及cDNA第1链的合成
收集1.1节白背飞虱样品使用Bertin Precellys 24多功能样品均质器(Bertin Technologies,法国)进行研磨后,参照HP Total RNA Kit试剂盒(Omega,美国)说明书提取总RNA(Zhouetal., 2021)。将提取的总RNA参照PrimeScriptTMRT Reagent Kit with gDNA Eraser(TaKaRa, 日本)说明书合成RT-PCR扩增及RT-qPCR所需cDNA模板(Zhouetal., 2021)。
1.3 SfHMGR基因克隆
基于已发表的白背飞虱基因组(Wangetal., 2017)和转录组(Zhouetal., 2018)数据,通过查找注释信息,初步获得白背飞虱SfHMGR基因序列,并通过在线工具Blast进行相似性比对。经进一步确认后,再利用Primer Premier 6.0软件设计特异性引物(表1),采用RT-PCR法对其准确性进行验证。PCR反应体系(25 μL): 2×TSINGKE Master Mix(北京擎科生物科技有限公司,北京)12.5 μL, cDNA模板1 μL, 上下游引物(10 μmol/L)各1 μL, ddH2O 9.5 mL。PCR扩增条件: 95℃ 3 min; 95℃ 30 s, 55℃ 30 s, 72℃ 3 min, 共30个循环; 最后72℃ 10 min。PCR产物经电泳检测合格后,将扩增产物纯化后进行TA克隆,并将克隆后的产物送往公司进行测序。
1.4 序列分析
使用ORF Finder(http:∥www.ncbi.nlm.nih.gov/gorf/gorf.html)分析SfHMGR基因的ORF及其编码的氨基酸序列;使用ProtParam(https:∥web.expasy.org/protparam/)预测编码蛋白质的氨基酸分子组成、相对分子质量及等电点等理化性质;使用PFAM(http:∥pfam.xfam.org/)预测SfHMGR基因的保守结构域;使用TMHMM(http:∥www.cbs.dtu.dk/services/TMHMM/)分析蛋白的跨膜结构域;使用SignalP-5.0(http:∥www.cbs.dtu.dk/services/SignalP/)分析蛋白的信号肽;借助MEGA 7.0软件使用邻接法(neighbor-joining, NJ)构建HMGR的系统发育树,重复运行1 000次。
1.5 SfHMGR基因时空表达分析
将初羽化的白背飞虱雌虫和雄虫配对后使用玻璃管单独饲养,每天更换一次水稻苗。饲养过程中分别收集从1龄若虫到成虫13个时间点的样品,分别为1-3龄若虫、4龄第1-2天若虫、5龄第1-3天若虫、羽化后12 h雌成虫、羽化后1-4 d雌成虫。每个样品包含15~30头白背飞虱。在雌虫羽化24 h后,在PBS中解剖白背飞虱的头部(50头)、肠道(100头)、脂肪体(50头)、卵巢(30头)和体壁(100头)。所有的样品均设置3个生物学重复。将收集的样品分别置于1.5 mL无RNA酶的离心管中,保存于-80℃冰箱中备用。
根据已验证的SfHMGR序列设计特异性引物(表1),采用RT-qPCR法测定SfHMGR基因在白背飞虱不同发育阶段和不同组织中的转录水平,以核糖体蛋白L9基因SfRPL9(GenBank登录号: KM885285)和α微管蛋白基因SfTUB(GenBank登录号: KP735521)为内参基因(Zhouetal., 2020)。RT-qPCR反应体系: 上下游引物(10 μmol/L)各1 μL, iQTMSYBR®Green Supermix 10 μL, cDNA模板1 μL, ddH2O 7 μL。反应条件: 95℃ 2 min; 95℃ 30 s, 50℃ 30 s, 40个循环; 同时在60~95℃进行溶解曲线分析。每个反应设置3次技术重复。
1.6 RNAi实验
使用特异性引物(表1)通过PCR扩增SfHMGR基因片段,参照TranscriptAid T7 High Yield Transcription Kit试剂盒(Thermo,美国)说明书,以扩增所得的SfHMGR基因片段为模版合成双链RNA(dsRNA)。用NanoDrop 2000核酸浓度分析仪(Thermo,美国)测定dsRNA浓度,并将其稀释至1 000 ng/μL备用。采用相同的方法合成水母Aequoreavictoria的绿色荧光蛋白基因GFP(GenBank登录号: CAA58789)的dsRNA。以羽化12 h以内的白背飞虱雌成虫作为供试昆虫,使用IM-31微型注射器进行显微注射,每头试虫注射0.1 μL,以注射等体积的dsGFP作为阴性对照(Zhouetal., 2021)。每处理设置3个生物学重复,每个重复注射100头。注射完成后,将试虫放入装有新鲜水稻苗的试管中,置于温度25±1℃、相对湿度70%±5%、光周期16L∶8D的人工气候箱中饲养。在注射dsRNA 48 h后收集样品,检测目的基因的沉默效率。

表1 本研究所用引物
将注射后的1头雌成虫与2头雄成虫(排除雄虫对交配的影响)进行配对,每个处理配对15对,设置3个生物学重复。配对饲养的白背飞虱每2 d换一次新鲜水稻,每天观察一次初孵若虫数,10 d后解剖换出的稻苗记录尚未孵化的卵,直至雌成虫死亡。统计雌虫的产卵量,并在雌虫注射dsRNA 6 d后,解剖并观察各处理雌虫个体的卵巢发育情况,并使用Nikon SMZ25体视显微镜进行拍照(Zhouetal., 2020)。同时,为进一步明确SfHMGR基因沉默后对白背飞虱生殖影响的机制,根据已报道的JH生物合成下游基因SfJHAMT(GenBank登录号: MW014329)和SfFAMeT(GenBank登录号: MW014330)、JH信号传导相关基因SfMet(GenBank登录号: MN229742)和SfKr-h1(GenBank登录号: MN229741)以及卵巢发育关键基因SfVg(GenBank登录号: MN296092)和SfVgR(GenBank登录号: MN296093),参考Zhou等(2021)设计RT-qPCR引物序列,使用1.5节中的反应体系和反应程序,测定其在SfHMGR基因沉默48 h后的转录水平。
1.7 数据分析
利用2-ΔΔCt法计算SfHMGR基因在不同发育阶段和不同组织中的相对表达量,并用SPSS 22.0软件进行统计分析。使用LSD法分析SfHMGR基因的在不同发育阶段和不同组织中表达量的差异显著性; RNAi相关实验的差异显著性采用Student氏独立样本t检验进行分析。
2 结果
2.1 SfHMGR基因克隆与序列分析
基于白背飞虱基因组和转录组数据,结合其注释信息进行查找,并通过RT-PCR技术对其序列进行验证,最终获得的序列长度为2 800 bp,并将其命名为SfHMGR(GenBank登录号: MW883397)。其中包含了一个完整的ORF,长2 724 bp,编码907个氨基酸。推导的蛋白质分子式为C4365H7019N1195O1300S60,预测的分子量为98.96 kD,理论等电点为6.15。保守结构域分析发现(图1),该蛋白含有典型的HMG-CoA还原酶的保守结构域(第466-872位氨基酸),同时在C端包含3个HMG-CoA结合位点(第647-661, 803-810和857-870位氨基酸)。该蛋白在N端具有7个典型的跨膜结构域,符合典型的动物HMGR蛋白的结构特征。前33个氨基酸为信号肽,第33和34位氨基酸之间为剪切位点。

图1 白背飞虱SfHMGR基因的核苷酸序列和推导的氨基酸序列
将白背飞虱SfHMGR基因所编码的氨基酸序列进行BLAST比对分析,结果表明,SfHMGR与另外两种稻飞虱——灰飞虱Laodelphaxstriatella和褐飞虱Nilaparvatalugens的HMGR具有最高的序列一致性,分别为92.40%和89.25%。系统发育树表明(图2),白背飞虱SfHMGR氨基酸序列与同为稻飞虱的灰飞虱和褐飞虱的序列聚集在同一个分支上,具有较近的亲缘关系,然后再与同为半翅目的温带臭虫Cimexlectularius、茶翅蝽Halyomorphahalys的序列聚集在一起,形成半翅目的一个大分支,再与其他目昆虫的序列依次聚集在一起。

图2 邻接法构建的基于氨基酸序列的白背飞虱SfHMGR与其他昆虫HMGR的系统进化树(1 000次重复)
2.2 SfHMGR基因的时空表达模式
SfHMGR在白背飞虱的各个发育阶段均有表达,并且在4龄第2天若虫以及初羽化(羽化后12 h和1 d)雌成虫中具有最高的转录水平(P<0.05),且随着羽化时间的延长,表达量呈下降趋势(图3: A)。SfHMGR在所测定的各个雌成虫组织中均有一定的转录水平(图3: B),但在肠道中具有最高的转录水平(P<0.05),在脂肪体和卵巢中的表达量次之。

图3 白背飞虱SfHMGR在不同发育阶段(A)和雌成虫不同组织(B)中的表达模式
2.3 SfHMGR基因功能
在注射SfHMGRdsRNA 48 h后SfHMGR的表达水平被显著抑制(P<0.01)(图4: A),相比于对照组(dsGFP处理组),其转录水平下降了70%。单雌产卵量显著降低(P<0.01),仅为对照组的39.6%(图4: B),表明SfHMGR基因的沉默会显著抑制雌虫的产卵。在注射SfHMGRdsRNA后6 d时,注射dsGFP处理中能够清楚地观察到香蕉形的成熟的卵母细胞,而在dsHMGR处理组中则没有明显的香蕉形的成熟卵母细胞出现(图4: C),表明沉默SfHMGR基因后能够显著影响白背飞虱卵巢的发育。
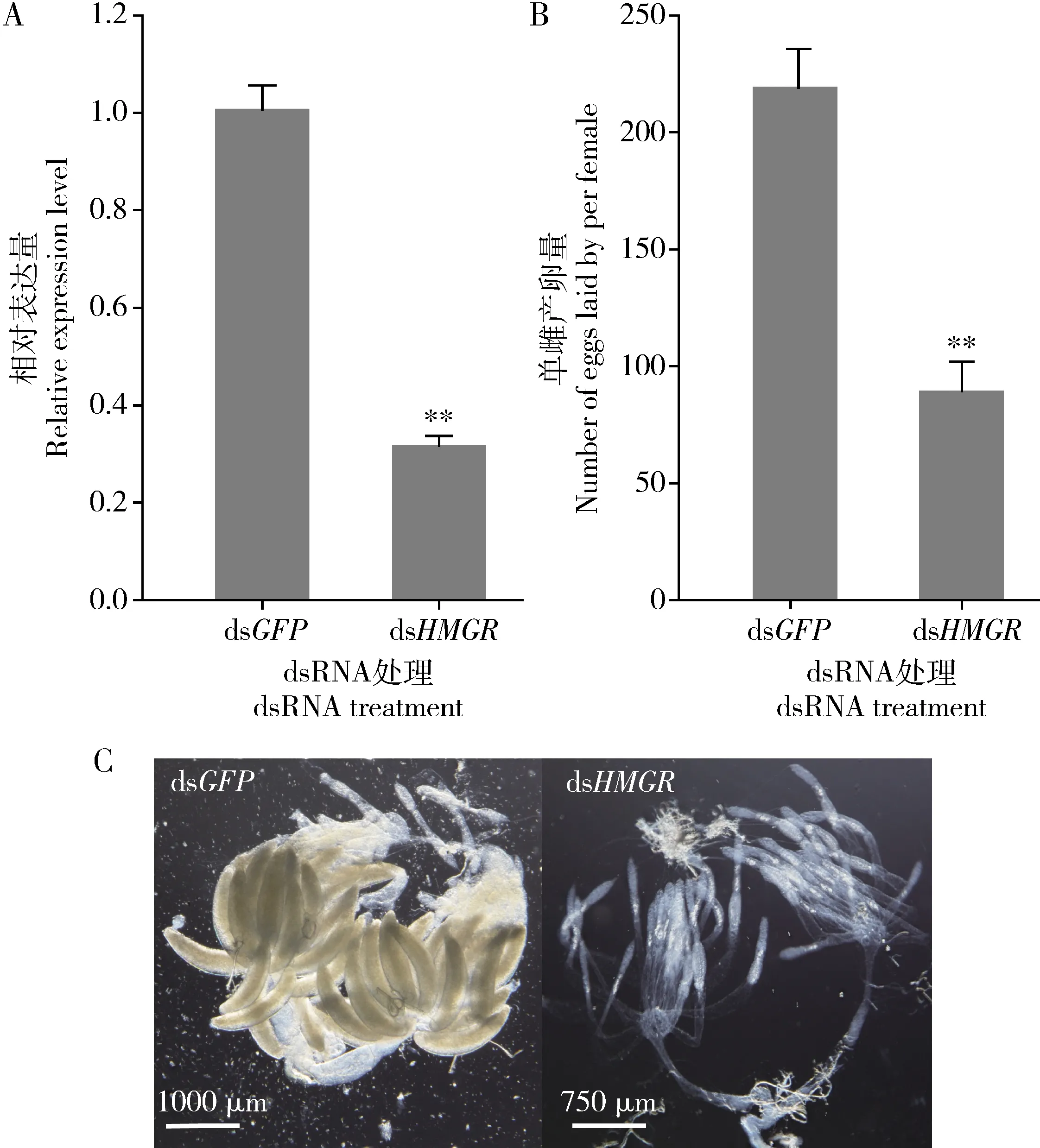
图4 显微注射dsRNA 48 h后白背飞虱体内SfHMGR基因沉默效率(A)、单雌产卵量(B)及雌虫卵巢发育(C)
为明确SfHMGR基因沉默后对白背飞虱生殖影响的机制,靶向沉默SfHMGR基因后测定了下游基因和生殖相关基因的转录水平。结果(图5)表明,SfHMGR基因作为JH生物合成的上游基因,其转录水平被抑制后,会显著抑制JH生物合成下游基因SfJHAMT和SfFAMeT(P<0.05)以及JH信号传导相关基因SfKr-h1的转录水平(P<0.01);另外,SfHMGR基因的沉默,同样也能够显著抑制SfVg(P<0.01)和SfVgR(P<0.05)的转录水平。
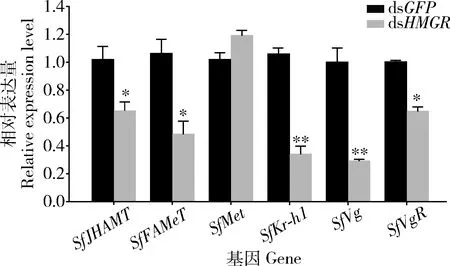
图5 沉默白背飞虱SfHMGR后下游基因和生殖相关基因转录水平
3 讨论
在本研究中,基于已公布的白背飞虱基因组和转录组数据,并结合RT-PCR技术,获得了白背飞虱JH生物合成过程中的关键基因,根据保守结构域和相似性比对,将其命名为SfHMGR(GenBank登录号: MW883397)。保守结构域分析发现,SfHMGR含有典型的HMG-CoA还原酶的保守结构域,同时在C端包含3个HMG-CoA结合位点(图1);序列相似性分析也发现,SfHMGR与同为半翅目的灰飞虱和褐飞虱HMGR氨基酸序列相似性最高。这与麦红吸浆虫Sitodiplosismosellana和桔小实蝇中的研究结果(Yangetal., 2018; 刘禹含等, 2019)一致,表明该基因在进化过程中的结构和功能高度保守。
众所周知,昆虫的变态发育受JH和蜕皮激素的共同调控(周树堂等, 2012; 何倩毓等, 2017)。例如,在白蜡虫Ericeruspela的研究中发现,JH在幼虫中期具有最高的滴度,在末期呈现滴度逐渐降低的变化趋势,出现较低值,这与20E滴度的变化趋势(刘妮, 2018)恰恰相反。在本研究中也发现,SfHMGR基因在白背飞虱的4龄和5龄若虫中期具有较高的转录水平,这与先前发现的JH滴度在发育阶段中期具有最高滴度的结果(刘妮, 2018)一致。在桔小实蝇中也发现,BdHMGR基因在蛹的发育中期具有较高的转录水平(Yangetal., 2018)。但遗憾的是,在本研究中并没有观察到蜕皮前SfHMGR基因转录水平的降低。导致这一结果的原因可能是在取样过程中,着重关注的是SfHMGR基因在雌成虫生殖过程中的作用,忽略了其在蜕皮前(4龄第3天若虫和5龄第4天若虫)样品的获取。在雌成虫中,SfHMGR基因在其羽化后12 h和1 d时具有最高的转录水平(图3: A),这与先前发现白背飞虱SfVg转录水平在雌虫羽化后呈现出逐渐升高的趋势(Zhouetal., 2020)相呼应。在太平洋折翅蠊雌虫中也发现,DpHMGR基因的转录水平变化趋势与DpVg的变化趋势一致(Huangetal., 2015);同样的结果在棉铃虫中也有发现(Wangetal., 2013)。这些研究结果表明,HMGR基因在昆虫Vg合成及其卵巢发育过程中具有重要的作用。
HMGR是甲羟戊酸途径中的关键基因,在昆虫中甲羟戊酸途径的主要功能是产生JH,单萜信息素和防御性分泌物等物质,它们与昆虫的生长、繁殖、化学交流和防御有关(Halletal., 2002; Hojoetal., 2012; Vranováetal., 2013)。在本研究中发现,SfHMGR基因在白背飞虱雌成虫肠道中具有最高的转录水平(图3: B),这与HMGR基因在黄粉虫Tenebriomolitor和华山松大小蠹前中肠中高表达的结果(Yuetal., 2015)一致,出现这一结果的原因可能是由于肠道是信息素前体合成的关键部位。例如,使用原位杂交技术在耶氏松小蠹Dendroctonusjeffreyi和云杉松齿小蠹Ipspini中的研究发现,HMGR在前中肠的特化细胞中高度表达,而该细胞是从头合成单萜类聚集信息素的重要部位(Nardietal., 2002)。另外,SfHMGR基因在脂肪体和卵巢中具有较高的转录水平,这与BdHMGR在桔小实蝇卵巢和脂肪体中高表达的结果(Yangetal., 2018)一致;同样,在马铃薯甲虫不同组织中的表达谱分析中也发现,LdHMGR在卵巢中具有最高的转录水平(Lietal., 2016)。卵巢是卵子发育的关键器官,而脂肪体是卵黄原蛋白合成的重要组织,SfHMGR在卵巢和脂肪体中均有较高的转录水平,暗示着SfHMGR在白背飞虱生殖过程中可能同样具有重要作用。
JH生物合成是调节昆虫发育、变态和繁殖的重要过程,主要包括甲羟戊酸合成途径和异戊二烯分支途径。HMGR是甲羟戊酸合成途径中的关键酶,直接影响JH的生物合成(嵇保中等, 2007; 刘艳等, 2007)。近年来的研究发现,HMGR参与了昆虫的生殖调控过程(Royetal., 2018)。例如:在桔小实蝇中发现,BdHMGR的敲除将显著抑制卵巢的发育和雌虫的产卵量。同样,RNAi介导的棉铃虫蛹中HaHMGR基因的靶向沉默,显著抑制了HaVg基因的转录水平及其雌虫的产卵量(Wangetal., 2013);在太平洋折翅蠊中也有同样的发现(Yangetal., 2018)。在本研究中也发现,SfHMGR沉默后将显著抑制白背飞虱雌成虫的产卵量和卵巢的发育(图4),并且显著抑制了SfVg基因的转录水平(图5),这与沉默SfHMGR下游的SfJHAMT,SfFAMeT,SfMet和SfKr-h1基因的结果(Huetal., 2019a, 2019b, 2020; Zhouetal., 2021)相似。SfHMGR作为JH生物合成的上游关键基因,是否可以通过下游的这些相关基因来调控白背飞虱的生殖?为了明确这一问题,在靶向沉默SfHMGR基因后测定了这些基因的转录水平。结果发现,沉默SfHMGR基因后能够显著抑制SfJHAMT,SfFAMeT,SfKr-h1,SfVg和SfVgR基因的转录水平(图5),证明了先前猜测的正确性。另外,在太平洋折翅蠊中发现,同时沉默HMGR和JHAMT基因后,将显著抑制JH生物合成下游相关基因的转录水平,降低JH生物合成的速率,并抑制脂肪体内Vg的转录水平和雌虫卵巢的发育(Huangetal., 2015)。在先前的研究中也发现,SfJHAMT和SfFAMeT基因被同时沉默后能够显著抑制卵巢的发育和雌虫的产卵量,但是这种抑制作用能够通过体外注射JH类似物烯虫酯(methoprene)得到部分缓解(Zhouetal., 2021)。以上这些结果表明,HMGR通过影响JH生物合成过程及其JH的信号传导来调控昆虫体内Vg的转录水平,进而影响昆虫的卵巢发育和雌虫的产卵量。

