LED蓝光光疗对黑色素合成的作用及机制
杨 莹, 贾冰怡, 张锡梅, 吕金鹏, 宋国强
(常州大学 药学院, 江苏 常州 213164)
人类皮肤色素合成十分复杂,在黑色素的合成过程中酪氨酸酶(TYR)的作用最为重要,是黑色素合成过程中的限速酶[1]。酪氨酸酶氧化羟化酪氨酸得到多巴醌[2-3],多巴醌被进一步合成为褐黑素和多巴色素。大部分多巴色素经过多步催化形成黑色真黑素,少部分催化形成棕色真黑素,人体不同肤色也由此而来。
LED光疗广泛应用于皮肤领域。光的波长不同,人体皮肤受影响的程度不同。人体组织将光能吸收后,进一步转化为各种形式的能,从而引发体内一系列的物理和化学变化[4]。
当前主要有LED红、黄、蓝光3种光源。红光(630~650 nm)光疗、黄光(570~590 nm)光疗通过诱导皮肤新胶原的合成,降低基质金属蛋白酶的表达[5],可起到嫩肤的作用。红光还可通过降低局部PEG-2起到抑制炎症的作用[6-8]。蓝光(400~450 nm)可用于治疗痤疮。痤疮丙酸杆菌会合成并储存内源性卟啉,这是一种内源性的光敏剂,暴露于蓝光下[9-11],受光能激发后转为高能量不稳定的卟啉,与三态氧结合形成不稳定的单态氧,诱导细菌死亡。蓝光光疗在临床上还用于促进白癜风病人的色素合成,但其机制尚未明确。在黑色素的合成和代谢中,MAPK信号通路家族极为重要[12],其中包括ERK1/2,JNK和p38,可通过Western blot检测ERK1/2,JNK和p38的表达以及磷酸化水平。有报道指出选用B16F10细胞进行LED红光处理[13-15],可降低Mitf和酪氨酸酶(TYR)的表达,并发现ERK磷酸化触发Mitf降解[16],最终减少了黑色素的合成[17-19]。因此本课题设计实验探讨LED蓝光光疗对小鼠皮肤黑色素瘤细胞(B16F10)黑色素合成的影响并研究相关机制。
1 实验部分
1.1 实验材料
DMEM培养基、胎牛血清、胰蛋白酶(gibco,美国)、B16F10 小鼠黑色素瘤细胞系(中国科学院上海细胞所,中国)、磷酸盐缓冲液(Biofroxx,德国)、BCA蛋白定量试剂盒、辣根过氧化物酶标记的山羊抗兔IgG和HRP标记山羊抗小鼠IgG(H+L)(碧云天生物有限公司,中国)、β-actin抗体、TYR抗体、p-ERK/ERKMTS抗体、p-p38/p38抗体(Abcam,美国)、Masson-Fontana黑色素胺银染色试剂盒(南京森贝伽生物科技有限公司,中国)。
二氧化碳细胞培养箱(Sanyo,日本)、多功能酶标仪(BioTek,美国)、化学发光成像仪(Tannon,中国)。
1.2 细胞培养
1.2.1 细胞复苏
从-80 ℃冰箱中取出B16F10 黑色素细胞,于37 ℃水浴中快速摇晃至完全溶解。取15 mL离心管,加入全部悬液和10倍以上的高糖培养基(其中含10% FBS)。以1 000 r/min,离心3 min。取离心后沉淀,加入含10%FBS的高糖培养基,反复吹打。取一培养皿,加入全部细胞悬液,静置于恒温培养箱中(37 ℃,5% CO2)培养。
1.2.2 细胞培养
将生长至80%的复苏细胞传至3代以上,进行给药实验。为研究LED蓝光剂量与黑色素降解的相互关系,将细胞分为对照组、LED蓝光光疗处理组(1,5,10,20,40,50,60 J/cm2)。进一步研究LED蓝光光疗影响黑色素降解的具体机制,选取同一LED蓝光光疗照射强度(40 J/cm2),处理细胞的时间分别为0,30,60,120,180,360 min。
1.3 MTT法测定细胞活力
取一个96孔板,消化处于生长细胞对数期的B16F10细胞并种板,每板用6孔,每孔200 μL细胞悬液(含10% FBS),细胞浓度为 1×105个/mL,静置培养24 h。显微镜下观察细胞贴壁后,进行LED蓝光光疗处理。吸出上层液体,每孔加入2 mL无菌1× PBS,进行不同强度的LED蓝光光疗照射(1,5,10,20,40,50,60 J/cm2)。照射结束后吸出PBS,加入含2.5% FBS的DMEM培养基,静置培养24 h。用同样的方法照射3次,最后一次照射结束后静置培养24 h。吸出孔中液体,每孔加入110 μL的混合溶液(V(DMEM)∶V(MTT)=10∶1),于37 ℃的培养箱中恒温培养4 h。吸出上层液体,每孔加入150 μL的DMSO,摇床振摇10 min。于多功能酶标仪中测定每孔的吸光度值(波长570 nm),并计算细胞相对抑制率。
1.4 NaOH 裂解法测定黑色素含量
取一个6孔板,消化处于生长细胞对数期的B16F10细胞并种板,每孔2 mL细胞悬液(含10% FBS),细胞浓度为1×105个/mL,于恒温培养箱(37 ℃,5% CO2)中静置培养24 h。显微镜下观察细胞贴壁后,进行LED蓝光光疗处理。吸出孔中上层液体,每孔加入2 mL无菌1× PBS,进行不同强度的LED蓝光光疗照射(1,5,10,20,40 J/cm2)。照射结束后吸出PBS,加入培养基(含2.5% FBS),静置培养24 h。照射3次,最后一次照射结束后静置培养24 h。吸出上层液体,PBS冲洗两次,于冰上裂解20 min,刮下细胞于1.5 mL离心管中,离心(4 ℃,13 000 r/min,15 min)。吸出上清液于另一离心管中,4 ℃保存。向每支沉淀离心管中加入100 μL 0.1% NaOH裂解液,吹打均匀后于金属浴中加热(80 ℃,1 h),涡旋。将混合液加入96孔板,每孔20 μL,每个样品制备3个复孔,在多功能酶标仪中测定每孔的吸光度值(波长405 nm)。
1.5 Masson-Fontana 黑色素胺银染色
选用10%甲醛水溶液进行固定,提前接种细胞于玻片并进行LED光疗处理。将玻片置于蒸馏水中,取出后加入Fontana 氨银溶液,避光浸染12~24 h。蒸馏水反复冲洗(5,6次为宜)。选用硫代硫酸钠溶液处理 1~5 min,蒸馏水处理3~5 min,加入中性红染色液,复染5 min,蒸馏水冲洗,95% 乙醇、无水乙醇脱水,最后用二甲苯透明封固。
1.6 Western blot检测黑色素相关蛋白表达
LED蓝光光疗处理细胞后,裂解细胞并提取细胞总蛋白质,总蛋白质(40 μg)在SDS-PAGE凝胶上分离,使用电泳转移系统(Bio-Rad,USA)转移到硝酸纤维素滤膜上(NC)。将膜在常温下用含有5% 奶粉的TBST封闭1.5 h,4 ℃下与抗体一起孵育过夜,二抗在常温下孵育1 h,通过增强化学发光显现,检查特征蛋白表达及其下游信号通路激活情况。
1.7 统计学分析
采用GraphPad Prism统计软件处理所有实验数据。本研究的所有数据采用SPSS进行检验,P<0.05 表明数据间的差异具有统计学意义(数据结果来自3次重复实验)。
2 结 果
2.1 对B16F10细胞活力的影响
通过 MMT 法采用不同强度的LED蓝光光疗照射(1,5,10,20,40,50,60 J/cm2)对B16F10细胞进行处理。由图1可见,与空白对照组相比,LED蓝光光疗照射1,5,10,20,40 J/cm2处理B16F10细胞对细胞的增殖和凋亡无明显影响。以剂量依赖的方式继续进行LED蓝光光疗,照射超过40 J/cm2后,即LED蓝光光疗照射强度为50 J/cm2和60 J/cm2时,可观察到细胞的凋亡的增加、活力显著下降。在此基础上,进一步探究LED蓝光光疗照射(1,5,10,20,40 J/cm2)对细胞生物学功能的影响。
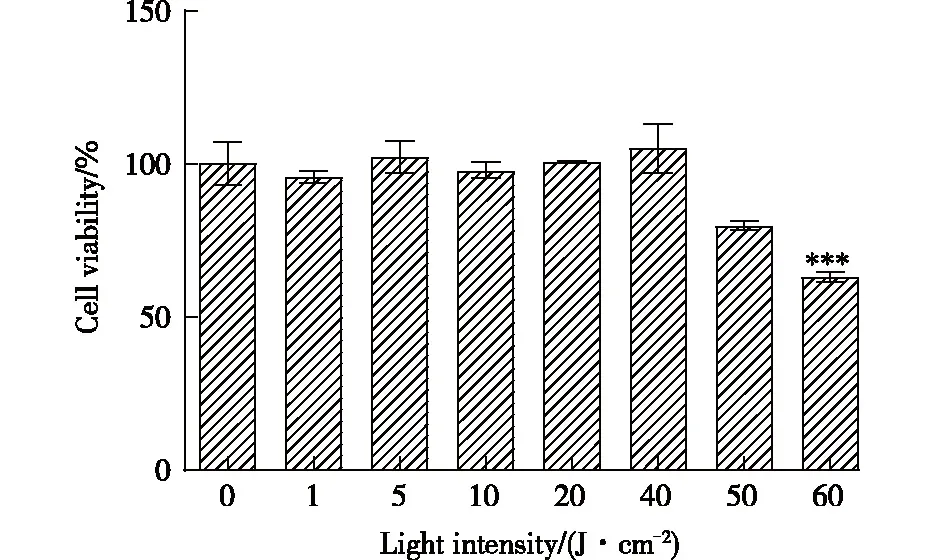
图1 LED蓝光光疗对 B16F10 细胞活力的影响Fig.1 Effects of LED blue on the viability of B16F10 cells
2.2 对B16F10细胞黑色素合成的影响
为研究LED蓝光光疗对B16F10细胞黑色素合成的影响,选取对数生长期的B16F10细胞,进行不同强度的LED蓝光光疗照射给药处理,最后一次照射后于恒温培养箱(37 ℃,5% CO2)中静置培养24 h。NaOH 裂解法测定不同强度的LED蓝光光疗照射(1,5,10,20,40 J/cm2)对B16F10细胞黑色素合成的影响。由图2可见,给药后,相较于空白组,给药组的黑色素含量呈剂量依赖性上升,说明LED蓝光光疗对黑色素合成起促进作用,随着给药强度的增大,促进黑色素生成效果越显著,呈现剂量依赖性。
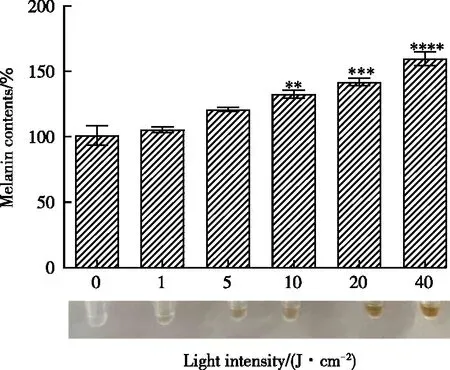
图2 NaOH裂解法测定不同剂量LED蓝光对黑色素合成的影响Fig.2 Effect of different dosages of LED blue on melanin synthesis by NaOH pyrolysis method
通过Masson-Fontana黑色素胺银染色方法观察不同强度的LED蓝光光疗照射(1,5,10,20,40 J/cm2)B16F10细胞的黑色素合成情况。由图3可见,随着LED蓝光光疗剂量的增加,B16F10细胞中黑色素积累变多,细胞相邻树突间传递的黑色素增加,LED蓝光促进黑色素合成以及传递。
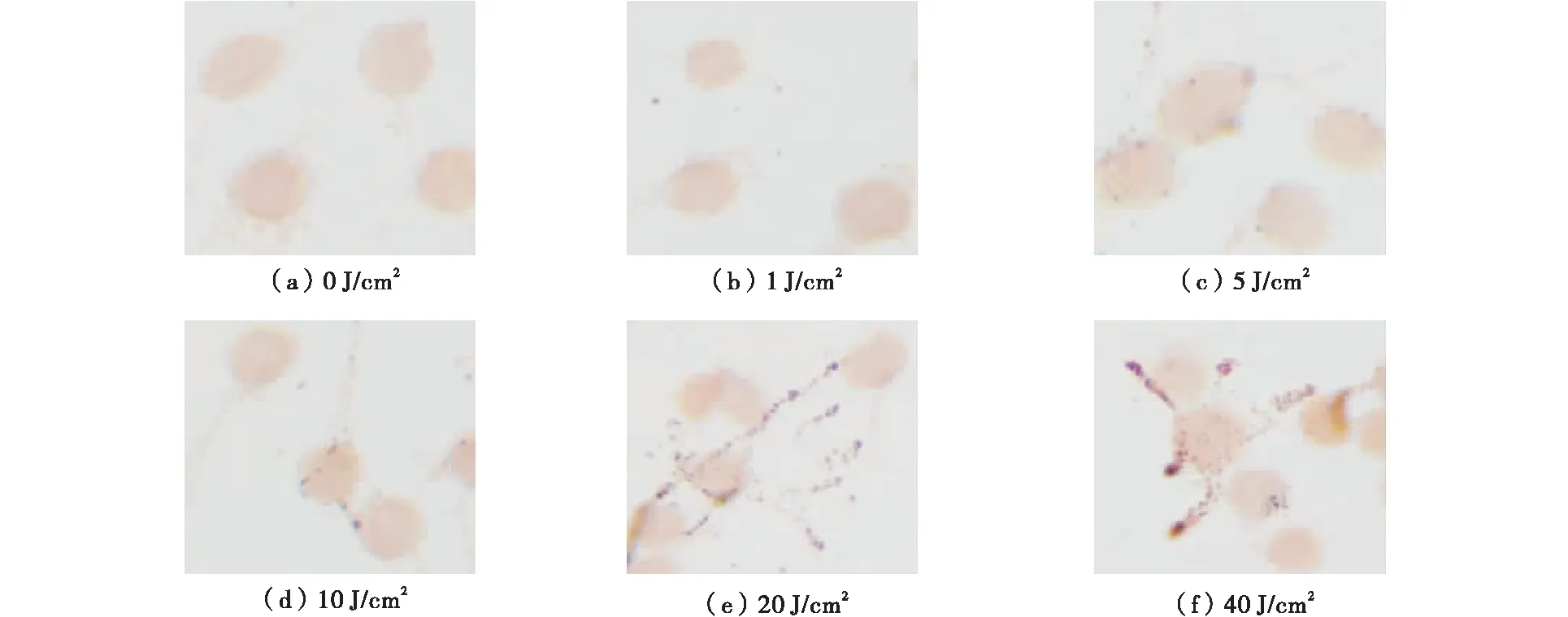
图3 Masson-Fontana 胺银染色法测定不同剂量LED蓝光对黑色素合成的影响Fig.3 Effect of different dosages of LED blue on the synthesis of melanin by Masson-Fontana amine silver staining
2.3 对 B16F10 细胞中黑色素合成相关蛋白 TYR,TRP-1,DCT 表达的影响
采用Western blot研究几种黑色素生成酶在蛋白质水平上的表达。由图4可见,与对照组相比,不同强度的LED蓝光光疗照射(1,5,10,20,40 J/cm2)后,酪氨酸酶(TYR)、相关蛋白(TRP-1)表达显著提高,相关蛋白(DCT)表达没有发生明显变化。关键因子小眼畸形转录因子(Mitf)的表达则发生了显著上调。这些结果表明LED蓝光光疗通过上调酪氨酸酶和Mitf的蛋白水平诱导黑色素合成,并呈剂量依赖性。

图4 不同剂量LED蓝光对酪氨酸酶和Mitf蛋白水平的影响Fig.4 Effects of different dosages of LED blue on tyrosinase and Mitf protein levels
2.4 对 B16F10 细胞中黑色素合成 MAPK 通路相关蛋白表达的影响
为了进一步阐明LED蓝光光疗在黑色素合成中的具体作用机制,以Mitf为最终靶向目标,检测上游信号通路激活情况。选取剂量为40 J/cm2的LED蓝光处理不同时间(0,30,60,120,180,360 min)。由图5可见,MAPK通路被激活。LED蓝光激活p38信号通路,抑制ERK信号通路。研究发现,p38信号通路激活后可促进Mitf的表达,相反ERK信号通路被激活后可促进Mitf的降解。这表明:LED蓝光通过激活p38信号通路,抑制ERK信号通路促进Mitf的表达、抑制降解导致黑色素合成增多。

图5 LED蓝光光疗对 MAPK 通路蛋白活性的影响Fig.5 Effect of LED blue on MAPK pathway protein activity
3 结 论
本研究确定了LED蓝光光疗处理B16F10细胞促进细胞黑色素合成。其特征表现在:与空白对照组相比,不同剂量LED蓝光照射后黑色素合成相关蛋白TYR,TRP-1显著上升,呈现剂量依赖性。小眼畸形转录因子(Mitf)表达明显上升,与之相关的MAPK家族激活,其中p38通路被明显激活、ERK通路降解促进Mitf的表达、抑制降解最终导致黑色素合成增多。
本研究中LED蓝光光疗激活p38信号通路,抑制ERK信号通路。这可能是因为各条MAPK信号通路之间存在内在的负反馈调节。有文献[20]报道,烧伤后大鼠给予微量的H2S使p-ERK 蛋白相对表达量升高,p-JNK和p-p38蛋白相对表达量下降。关于蓝光照射后,p38被激活,ERK被抑制的原因尚需要进一步深入研究。同时在后续的研究中可选取特定抑制剂进一步证实MAPK通路对LED蓝光诱导的黑色素合成的作用。
当前,LED光疗已广泛应用于临床。以LED蓝光为例,可用于治疗白癜风,但机制尚不明确。本实验检测LED蓝光对黑色素合成转运作用的影响及信号通路状态,对蓝光调控黑色素的机制进行深入讨论可进一步推广LED蓝光光疗在临床上的应用。

