阿帕替尼联合多西他赛对晚期NSCLC患者血清肿瘤标记物水平及预后的影响
段玲玲 王艳 梁宪斌 张维真
(河南省郑州市第三人民医院黑色素瘤及肿瘤综合治疗内科 郑州 450099)
肺癌是临床常见的恶性肿瘤,临床以非小细胞肺癌(NSCLC)最为多见,约占所有肺癌的80%[1~2]。NSCLC早期阶段一般无明显症状,多数患者确诊时已处于晚期,部分肿瘤甚至已发生转移[3]。针对晚期NSCLC,临床主要采用放疗、化疗等手段治疗,其中含铂双药化疗是为一线化疗方案,但部分患者存在耐药情况,需更换化疗方案[4]。近年来,抵抗肿瘤血管生长的靶向治疗成为临床抗肿瘤治疗的研究热点。本研究探讨晚期NSCLC患者应用多西他赛联合阿帕替尼治疗的疗效。现报道如下:
1 资料与方法
1.1 一般资料 本研究经医院医学伦理委员会批准(审批号:20221010001)。回顾性分析郑州市第三人民医院2017年1月至2019年1月收治的64例晚期NSCLC患者,按照治疗方式不同分为对照组和观察组,各32例。对照组男19例,女13例;年龄35~78岁,平均(60.30±6.19)岁;KPS评分60~93分,平均(83.40±4.08)分。观察组男20例,女12例;年龄38~75岁,平均(60.54±6.09)岁;KPS评分62~91分,平均(82.79±4.10)分。两组一般资料比较,差异无统计学意义(P>0.05)。
1.2 纳入标准 符合晚期NSCLC的诊断标准[5],且结合影像学及病理学检查确诊;KPS评分≥60分;TNM分期为Ⅲb~Ⅳ期;接受一线含铂双药化疗后病情仍继续进展;预计生存期≥3个月;距末次放化疗>4周;患者知情本研究并签署同意书。
1.3 排除标准 存在不可控制高血压、出血风险、严重凝血功能障碍者;交流障碍或精神异常者;过敏体质者;合并急性血液系统感染者;严重肝肾功能不全者。
1.4 治疗方法 两组患者均于化疗开始前服用醋酸地塞米松片(国药准字H45021604),7.5 mg/次,早晚各1次,连续服用3 d。对照组静脉滴注多西他赛注射液(国药准字H20184140)治疗,给药剂量为75 mg/m2,滴注60 min,1次/3周。观察组加服甲磺酸阿帕替尼片(国药准字H20140103),0.5 g/次,1次/d,3周为一个疗程。两组均连续治疗12周。
1.5 观察指标 (1)近期疗效:症状明显改善,目标病灶完全消失为完全缓解(CR);症状有所改善,生命体征基本稳定,目标病灶长径总和缩小>50%为部分缓解(PR);介于PR和疾病进展(PD)之间为稳定(SD);目标病灶长径总和增加>25%或出现新病灶为PD。CR+PR=客观缓解率(ORR)。(2)血清肿瘤标记物水平:采集患者治疗前、治疗12周后的空腹静脉血4 ml,检测癌胚抗原(CEA)、糖蛋白抗原125(CA125)、鳞状上皮细胞癌抗原(SCC)、细胞角蛋白19片段抗原21-1(CYFRA21-1)水平,检测方法为酶联免疫吸附法。(3)免疫功能:采集患者治疗前、治疗12周后的空腹静脉血3 ml,采用美国贝克曼库尔特有限公司CytoFLEX型流式细胞仪检测T淋巴细胞亚群。(4)基质金属蛋白酶(MMP-9)和血管内皮生长因子(VEGF)水平:于治疗前、治疗12周后采用酶联免疫吸附法检测MMP-9、VEGF水平。(5)预后情况:通过电话随访和定期门诊掌握患者生存情况,比较两组无进展生存时间(PFS)和总生存时间(OS),其中PFS指治疗第1天至第1次记录肿瘤病灶进展/转移或失死亡的时间;OS指第1天开始至患者死亡或末次随访的时间。(6)毒副作用:包括胃肠道反应、神经毒性、骨髓抑制、肝功能损伤等。
1.6 统计学分析 采用SPSS 22.0统计学软件分析处理数据,计量资料以()表示,采用t检验;计数资料以%表示,采用χ2检验;采用Kaplan-Meier生存曲线进行生存分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组近期疗效比较 观察组ORR显著高于对照组(P<0.05)。见表1。
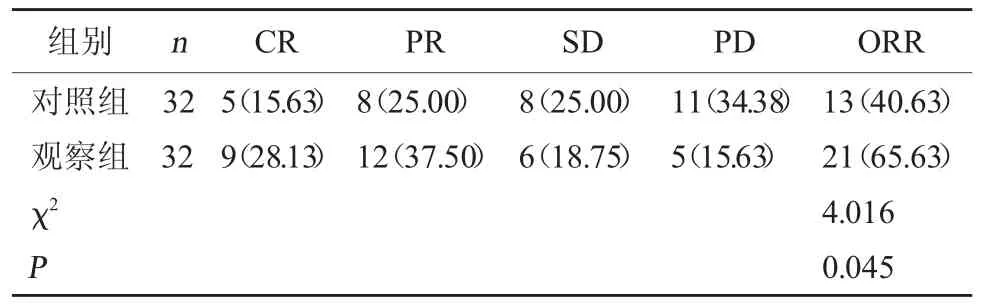
表1 两组近期疗效比较[例(%)]
2.2 两组血清肿瘤标记物水平比较 治疗前,两组患者血清肿瘤标记物水平比较,差异无统计学意义(P>0.05); 治 疗 后 观 察 组SCC、CEA、CA125、CYFRA21-1水平均低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组血清肿瘤标记物水平比较()
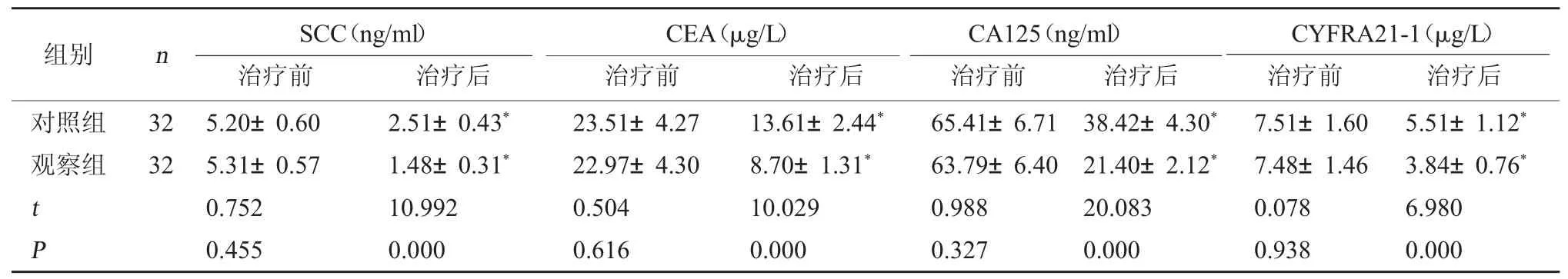
表2 两组血清肿瘤标记物水平比较()
注:与同组治疗前比较,*P<0.05。
CYFRA21-1(μg/L)治疗前 治疗后对照组观察组组别 n SCC(ng/ml)治疗前 治疗后CEA(μg/L)治疗前 治疗后CA125(ng/ml)治疗前 治疗后32 32 t P 5.20±0.60 5.31±0.57 0.752 0.455 2.51±0.43*1.48±0.31*10.992 0.000 23.51±4.27 22.97±4.30 0.504 0.616 13.61±2.44*8.70±1.31*10.029 0.000 65.41±6.71 63.79±6.40 0.988 0.327 38.42±4.30*21.40±2.12*20.083 0.000 7.51±1.60 7.48±1.46 0.078 0.938 5.51±1.12*3.84±0.76*6.980 0.000
2.3 两组免疫功能指标比较 治疗前,两组患者免疫功能指标水平比较,无显著性差异(P>0.05);治疗后观察组CD3+、CD4+、CD4+/CD8+均高于对照组(P<0.05)。见表3。
表3 两组免疫功能指标比较()

表3 两组免疫功能指标比较()
注:与同组治疗前比较,*P<0.05。
CD4+/CD8+治疗前 治疗后对照组观察组组别 n CD3+(%)治疗前 治疗后CD4+(%)治疗前 治疗后32 32 t P 63.19±5.40 63.42±5.61 0.167 0.868 65.25±7.15*68.84±6.85*2.051 0.045 30.59±5.24 30.84±5.30 0.190 0.850 33.34±5.72*35.97±4.22*2.093 0.040 0.97±0.20 0.99±0.22 0.381 0.705 1.19±0.27*1.41±0.30*3.084 0.003
2.4 两组MMP-9、VEGF水平比较 治疗前,两组患者MMP-9、VEGF水平比较,无显著性差异(P>0.05);治疗后观察组MMP-9、VEGF水平均低于对照组(P<0.05)。见表4。
表4 两组MMP-9、VEGF水平比较()
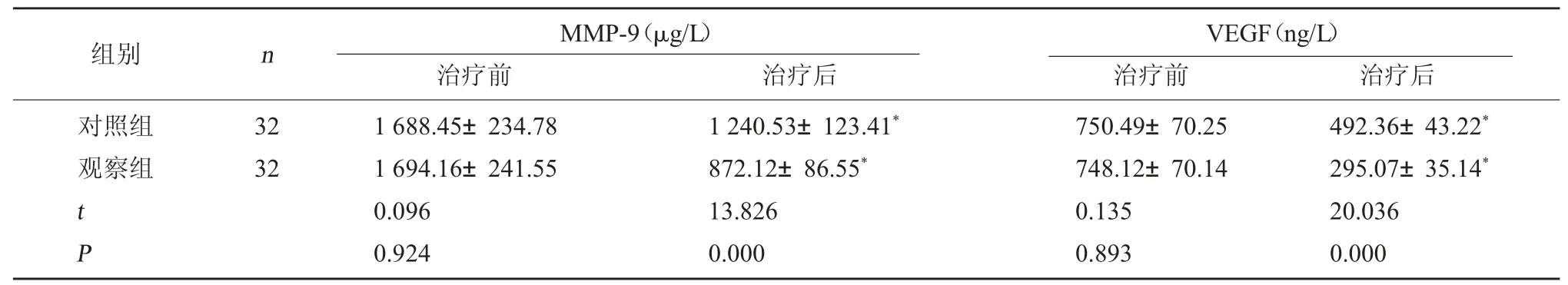
表4 两组MMP-9、VEGF水平比较()
注:与同组治疗前比较,*P<0.05。
VEGF(ng/L)治疗前 治疗后对照组观察组组别 n MMP-9(μg/L)治疗前 治疗后32 32 t P 1 688.45±234.78 1 694.16±241.55 0.096 0.924 1 240.53±123.41*872.12±86.55*13.826 0.000 750.49±70.25 748.12±70.14 0.135 0.893 492.36±43.22*295.07±35.14*20.036 0.000
2.5 两组预后情况比较 对照组中位PFS为13个月,中位OS为29个月,观察组中位PFS为19个月,中位OS为43个月,两组比较差异显著(P<0.05)。见图1~2。
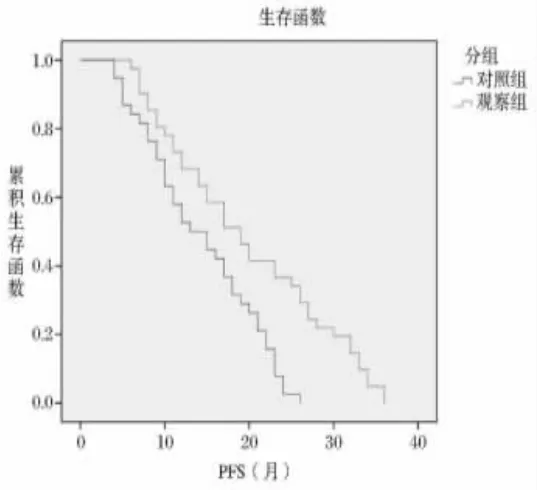
图1 PFS
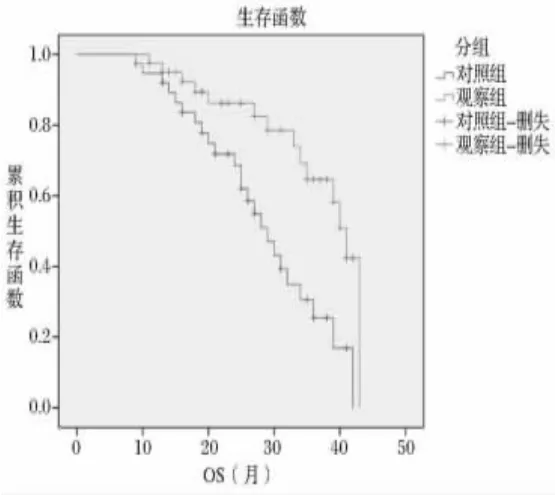
图2 OS
2.6 两组毒副作用比较 两组毒副作用比较,无显著性差异(P>0.05)。见表5。
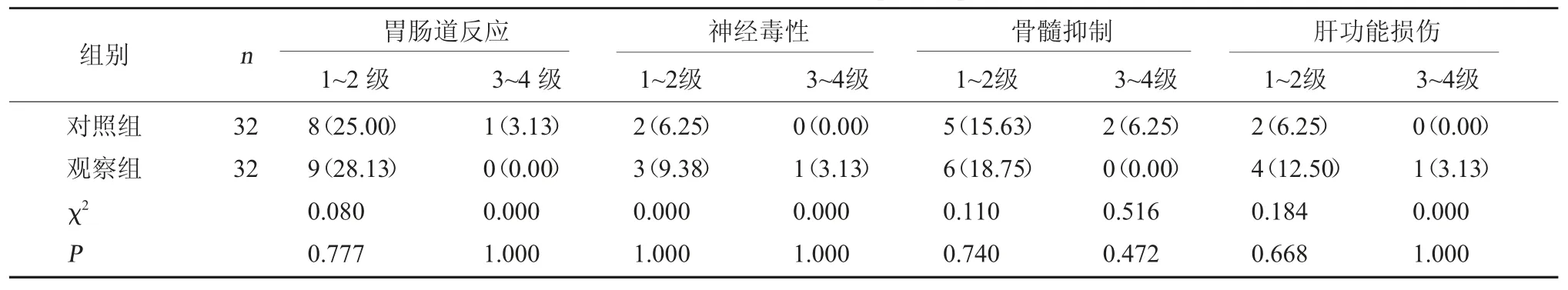
表5 两组毒副作用比较[例(%)]
3 讨论
化疗是治疗晚期NSCLC 患者主要手段,可控制肿瘤细胞转移、增殖,从而延长患者生存时间。临床实践发现,部分患者在使用一线化疗药物治疗后仍然无法获得预期疗效,且存在明显的毒副反应,无法继续治疗,导致化疗失败[6~7]。多西他赛可促进小管聚合成稳定的微管而抑制癌细胞增值和分裂,发挥显著的抗肿瘤作用,延长患者生存时间[8~9]。但相关研究显示,单一采用多西他赛治疗晚期NSCLC患者缓解率较低[10]。
阿帕替尼可高选择性结合血管内皮生长因子受体 -2(VEGFR-2)中的腺苷三磷酸(ATP),进而阻挡肿瘤新生血管,使肿瘤细胞凋亡[11~12]。本研究结果显示,治疗后,与对照组比,观察组ORR 较高,对照组中位PFS 为13 个月,中位OS 为29 个月,观察组中位PFS 为19 个月,中位OS 为43 个月,说明晚期NSCLC 患者应用阿帕替尼联合多西他赛治疗效果确切,可延长患者生存时间。阿帕替尼是一种高效靶向抗肿瘤药物,可促进血管退化,阻断信号通路,抑制血管生长,减少病灶内新微血管生成,阻断癌细胞的营养供应,与多西他赛结合治疗可发挥叠加效果,保证药效最大程度发挥,提升整体治疗效果[13~14]。
肿瘤标志物SCC、CA125 水平变化与病情严重程度密切相关,病情越严重,其水平越高;CEA 水平升高,表明肿瘤细胞增殖活跃;CYFRA21-1 可反映预后情况,水平越高,预后越差。本研究观察组治疗后 SCC、CEA、CA125、CYFRA21-1 水平较对照组低,说明晚期NSCLC 患者应用阿帕替尼联合多西他赛治疗可降低血清肿瘤标志物水平,发挥有效的抗肿瘤作用。究其原因在于:阿帕替尼能够阻断肿瘤病灶微血管形成而发挥抗肿瘤作用,降低血清肿瘤标志物水平,并可逆转耐药基因效应,减轻患者耐药性,提高化疗成功率[15~16]。肿瘤细胞增殖、转移与MMP-9、VEGF 密切相关,其中 MMP-9 可反映肿瘤侵袭性,VEGF 升高可促进肿瘤组织血管生成,加速肿瘤复发与转移。本研究治疗后观察组MMP-9、VEGF 水平较对照组低,说明两药联合应用具有较强的抗肿瘤效果。
观察组治疗后 CD3+、CD4+、CD4+/CD8+较高,说明两者联合应用可改善机体免疫力,提升患者生存质量。究其原因在于:阿帕替尼的抗肿瘤血管生成作用可在一定程度上解除免疫制抑制,改善患者免疫功能,促进机体各项机能恢复[17]。丁婷婷等[18]研究结果显示,与单纯多西他赛相比,联合阿帕替尼治疗晚期NSCLC 患者效果更佳,更有助于改善血清肿瘤标志物水平,增强机体免疫力,与本研究结果具有一致性。从安全性角度分析,两组毒副作用发生率比较,差异无统计学意义,提示两者联合应用短期安全性较好。
综上所述,晚期NSCLC 患者应用阿帕替尼联合多西他赛治疗可降低血清肿瘤标志物水平,改善免疫功能,延长患者生存时间,且短期内不会增加不良反应,具有较高的临床应用价值。
——评《卵巢恶性肿瘤诊疗手册》

