探讨白介素-6对糖尿病周围神经病变的干预性作用及机制
张春风,郑辉*,葛焕琦,谢云,李雪粉,胡睿,郭夏
(1.泰达国际心血管病医院内分泌科,天津 300134;2.天津医科大学朱宪彝纪念医院(天津市内分泌研究所)国家卫生健康委员会激素与发育重点实验室(天津市代谢性疾病重点实验室),天津 300134)
糖尿病是一个严重的公共健康问题,国内流行病学调查显示,中国成年人糖尿病的患病率为11.2%[1],周围神经病变是糖尿病最常见的微血管并发症之一,国外研究证实超过50%的糖尿病患者可诊断为周围神经病变[2]。周围神经病变是导致糖尿病患者足部溃疡、下肢截肢及骨折的危险因素,必须进一步寻找针对神经病变的病因性治疗方法[3]。目前,糖尿病神经病变的发病机制尚未完全明确,已知的是长期高血糖状态及相关代谢紊乱是导致神经病变的主要原因。实验和临床证据表明,长期高血糖状态介导的细胞功能障碍通过氧化应激、细胞因子释放和神经炎症在神经损伤中起关键作用[4-5]。Christian等[6]研究首次证实炎症与糖尿病周围神经病变的相关性,尤其IL-6水平增加与神经病变和神经缺陷明显相关,但该研究是横断面的观察性研究,未能明确炎症因子与神经病变的因果关系且未进行干预性的研究。
IL-6属于IL-6细胞因子家族成员,分子量为21 kD,由184个氨基酸残基组成,并含有2个糖基化位点。IL-6主要由单核巨噬细胞、Th2细胞、血管内皮细胞、成纤维细胞产生,且骨髓细胞和部分肿瘤细胞等也可产生IL-6。IL-6是一种多效性细胞因子,能调节多种细胞功能,包括细胞增殖、细胞分化、免疫防御机制及血细胞生成等。有研究者通过动物试验应用不同剂量IL-6对糖尿病周围神经病变大鼠进行干预后发现,IL-6以剂量依赖的方式提高感觉运动神经纤维传导速度,温度觉感觉过敏,以及坐骨神经内皮血流灌注[7],但该研究未能证实IL-6干预后神经组织病理性改变及其作用机制。
本研究通过对不同水平IL-6对糖尿病大鼠进行干预后观察腓肠神经病理学改变及炎症相关因子NF-κB,IĸBα的表达水平影响,旨在探讨IL-6对周围神经病变的干预性作用及机制。
1 材料与方法
1.1 实验动物及试剂 2015年10月至2018年12月,选取80只健康雄性清洁级wistar大鼠,均购自天津医科大学动物试验中心,体质量为(200±30)g,将大鼠随机分为对照组、糖尿病非干预组、糖尿病低剂量IL-6干预组、糖尿病高剂量IL-6干预组,每组20只。
1.2 制备动物模型及IL-6干预 对照组喂予基础饲料,糖尿病大鼠喂予高脂高糖饲料(20%蔗糖,10%猪油,5%胆固醇,1%胆酸,64%标准饲料)。各组大鼠饲养条件相同,自由摄食、饮水,室温控制在20~25℃,湿度40%~70%,12 h光照/12 h黑暗。
1.2.1 制备糖尿病周围神经病变模型 糖尿病大鼠给予尾静脉注射链脲菌素45 mg/kg,并持续高糖高脂饲料喂养;对照组注射相当剂量的柠檬酸钠缓冲液并予普通饲料。造模1周后尾静脉采血测定随机血糖>16.7 mmol/L为糖尿病造模成功。继续上述喂养方法和条件8周制备周围神经病变模型。
1.2.2 不同剂量IL-6干预 低剂量IL-6干预组给予1μg/kg IL-6,每周3次,皮下注射;高剂量IL-6干预组给予10μg/kg IL-6,每周3次,皮下注射;对照组及非干预组给予等体积0.9%氯化钠溶液皮下注射。干预期4周。对照组共18只完成试验,非干预组有15只完成,低剂量IL-6干预组有16只完成,高剂量IL-6组有16只完成。
1.3 标本处理 大鼠隔夜空腹12 h,心脏取血2管,1管抗凝,1管迅速离心,-4℃保存留检,分离大鼠双侧腓肠神经,液氮保存。
1.4 血液生化指标检测 应用生物素双抗体夹心酶联免疫吸附法(试剂盒购自武汉华美生物工程有限公司)测定大鼠血IL-6的水平;采用高效液相色谱法测定大鼠糖化血红蛋白。
1.5 腓肠神经病理学改变 取一侧腓肠神经,经固定,石蜡包埋,切片,HE染色观察腓肠神经病理学改变。
1.6 大鼠腓肠神经IL-6,NF-κB及IĸBα的mRNA及蛋白表达 取一侧大鼠腓肠神经组织,采用Western blot法测定IL-6、NF-κB及IĸBα蛋白表达水平,相关抗体购自武汉博士得生物工程有限公司。
应用定量实时聚合酶链反应监测大鼠另一侧腓肠神经IL-6、NF-κB及IĸBαmRNA表达量。取冰冻腓肠神经,用超纯RNA提取试剂(TaKaRa Code D9108B)提取组织样本中总RNA。IL-6:F:5'CACTTCACAAGTCGGAGGCT3';R:5'TCTGACAGTGCATCATCGCT3';NF-κB:F:5'GGCATCCACCATGGAAGACA3';R:5'CGTAACCGCGTAGTCGAAGA3';IĸBα:F:5'TGGCAAGGTCATGCTCTCAG3';R:5'GGAAGCAGGAATGGAGCTGA3';内参Actin:F:5'AAGAGGGATGCTGCCCTTAC3';R:5'TACGGCCAAATCCGTTCACA3'。
取5μL RNA用1%琼脂糖凝胶进行电泳,用反转录试剂盒中的gDNA Eraser(TaKaRa code DRRO47A)对RNA中残留的基因组DNA进行消化处理,用反转录试剂盒(TaKaRa code DRRO47A)进行反转录,用ABI 7500型荧光定量PCR仪,采用2-△△CT法进行数据的相对定量分析。
1.7 统计学方法 采用SPSS 17.0统计学软件进行数据分析,计量资料以“±s”表示,多组间比较应用方差分析,两两比较应用LDS法,以P<0.05为差异有统计学意义。
2 结果
2.1 生化指标比较 非干预组、低剂量IL-6组和高剂量IL-6组体质量均低于对照组,糖化血红蛋白水平明显高于对照组,血IL-6水平高于对照组,且低剂量组血IL-6水平低于非干预组,差异有统计学意义(P<0.05),见表1。
表1 4组大鼠生化指标比较(±s)Table1 Comparation of biochemical index among four groups(±s)
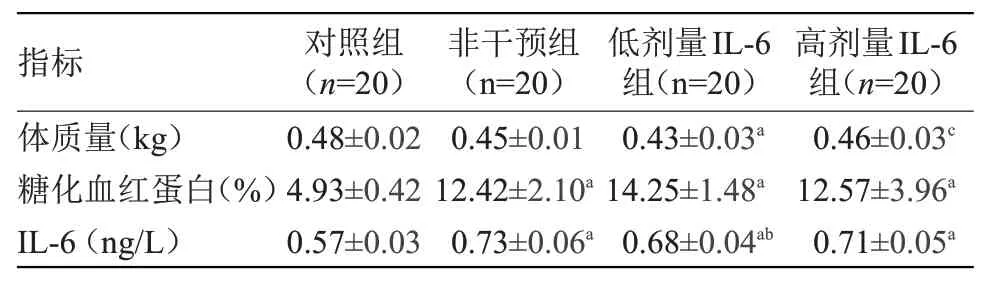
表1 4组大鼠生化指标比较(±s)Table1 Comparation of biochemical index among four groups(±s)
注:IL-6,白细胞介素-6。与对照组比较,a P<0.05;与非干预组比较,b P<0.05;与低剂量IL-6组比较,c P<0.05
?
2.2 4组大鼠腓肠神经病理学改变 对照组大鼠腓肠神经结构清晰,形态正常,未见明显异常;非干预组神经结构清晰,形态正常,纤维密度减少,截面积减小,呈萎缩趋势,神经纤维间隙扩大,密度不均匀,可见少量异常有髓纤维;低剂量IL-6干预组部分神经纤维排列稍紊乱,偶见异常有髓纤维;高剂量IL-6干预组部分神经纤维轻度水肿变性,排列稍紊乱,偶见异常有髓纤维,见图1。
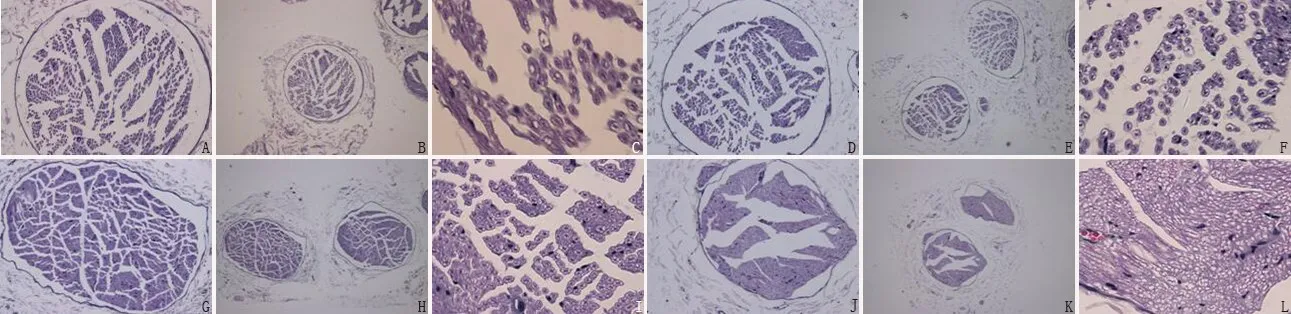
图1 各组大鼠腓肠神经病理改变Table 1 Comparation of biochemical index among four groups
2.3 4组大鼠腓肠神经炎症相关因子mRNA表达水平比较 非干预组、低剂量IL-6组和高剂量IL-6组腓肠神经IL-6、NF-κB及IĸBα的mNRA表达均高于对照组,其中非干预组大鼠的炎症因子mRNA升高最明显,低剂量IL-6组IL-6及IĸBα的mRNA表达与非干预组比较差异有统计学意义(P<0.05);经高剂量IL-6干预后,上述炎症因子mRNA的表达进一步下降,与非干预组比较差异均有统计学意义(P<0.05),见表2。
表2 4组大鼠腓肠神经炎症相关因子mRNA表达水平比较(±s)Table 2 Comparison of mRNA expression of sural nerve inflammation related factors among four groups(±s)
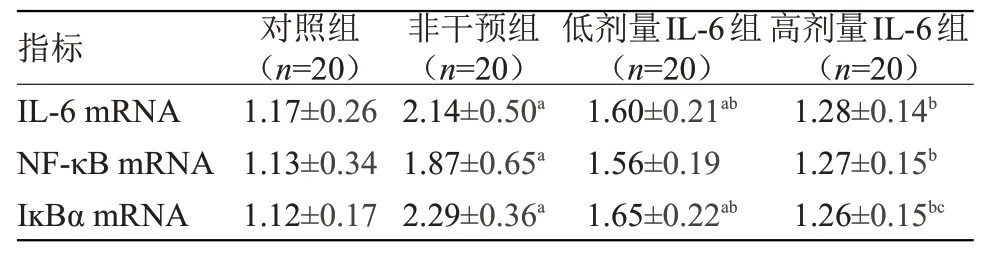
表2 4组大鼠腓肠神经炎症相关因子mRNA表达水平比较(±s)Table 2 Comparison of mRNA expression of sural nerve inflammation related factors among four groups(±s)
注:IL-6,白介素-6;NF-κB,核因子κB;IĸBα,抑制蛋白α。与对照组比较,a P<0.05;与非干预组比较,b P<0.05;与低剂量IL-6组比较,c P<0.05
?
2.4 4组大鼠腓肠神经炎症相关因子蛋白表达水平比较 应用Image J软件分析灰度值,各组大鼠腓肠神经IL-6,NF-κB及IĸBα蛋白表达,见图2。与对照组比较,非干预组、低剂量IL-6组和高剂量IL-6组腓肠神经IL-6、NF-κB及IĸBα蛋白表达水平均升高,差异有统计学意义(P<0.05)。经低剂量IL-6干预后,上述炎症因子蛋白表达水平有下降,其中IL-6和NF-κB表达水平与非干预组比较差异有统计学意义(P<0.05)。经高剂量IL-6干预后,上述炎症因子表达水平进一步下降,与非干预组比较差异有统计学意义(P<0.05),见表3。
表3 4组大鼠腓肠神经炎症相关因子蛋白表达水平比较(±s)Table 3 Comparison of protein expression of sural nerve inflammation related factor among four groups(±s)
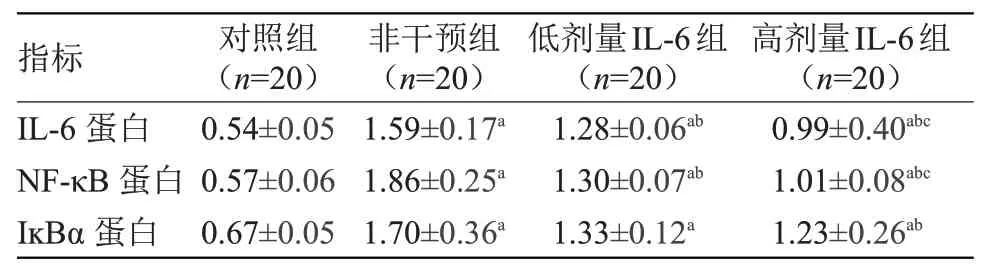
表3 4组大鼠腓肠神经炎症相关因子蛋白表达水平比较(±s)Table 3 Comparison of protein expression of sural nerve inflammation related factor among four groups(±s)
注:IL-6,白细胞介素-6;NF-κB,核因子κB;IĸBα,抑制蛋白α。与对照组比较,a P<0.05;与非干预组比较,b P<0.05;与低剂量IL-6组比较,c P<0.05
?
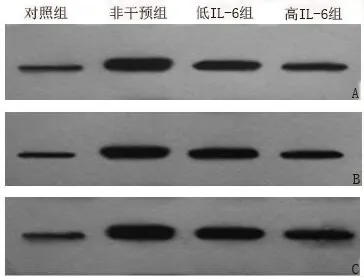
图2 各组大鼠腓肠神经炎症因子蛋白表达水平Figure 2 Protein expression of sural nerve inflammatory factor in each group
3 讨论
在1985年,IL-6首次被确定为B细胞刺激因子,并被描述为启动免疫系统急性期反应的促炎细胞因子[8]。在糖尿病周围神经病变患者的血液中发现IL-6水平升高,提示IL-6可能与神经病变发生发展相关。后续的临床研究中发现在给予糖尿病周围神经病变患者进行运动指导时,血液IL-6水平呈脉冲式升高,且伴随血流量增强和慢性炎症减少,促进周围神经纤维再生的作用;动物实验中经实验性切开轴突后可观察到IL-6在神经中过度表达,从而促进轴突生长,直到与施万细胞建立接触。因此,目前IL-6被理解为一种多功能细胞因子,既可激发炎症,也有抗炎作用[9]。目前比较一致的观点认为,当IL-6的水平达到10~100 pg/ml时(类似于运动时IL-6的短暂脉冲式突然增高),IL-6对于糖尿病神经病变表现为改善和修复作用,然而对于长期慢性低剂量IL-6水平的升高(2~3 pg/ml)时,IL-6表现为炎症效应,可能促进糖尿病神经病变的进一步进展[10]。
本研究结果表明,长期高血糖状态下大鼠血液IL-6水平高于非糖尿病大鼠,然而给予外源性IL-6干预后,大鼠腓肠神经IL-6的mRNA及蛋白表达受到抑制,病理下可见神经结构较前改善,提示IL-6对周围神经病变起到保护性作用。
既往国外动物实验中发现外源性给予IL-6干预后,大鼠周围神经传导速度,热痛觉感知均得到改善,然而并未进一步分析IL-6的作用机制[7]。NFκB被认为是炎症反应的中心环节。NF-κB的过度表达导致神经炎症的发展,促炎细胞因子的产生,神经损伤,运动神经传导速度异常。NF-κB可表达于任何细胞,通常以无活性形式存在,在炎症因子刺激下NF-κB被激活,转运入细胞核内并调控目标基因的表达。本研究结果表明,应用IL-6进行干预后,大鼠腓肠神经NF-κB及IĸBα的mRNA及蛋白表达均受到抑制,并且呈现为剂量依赖方式,提示IL-6可能通过抑制NF-κB的表达从而起到改善神经形态及功能的作用。
既往研究[11]发现IL-6有改善糖代谢及胰岛素敏感性的作用,但本研究中应用IL-6后对于糖化血红蛋白的改善作用不明显,考虑可能与干预时间短相关,关于IL-6与血糖及胰岛素的相关性需要进一步实验证实。
综上所述,IL-6可通过抑制腓肠神经NF-κB的表达,缓解糖尿病大鼠周围神经病变的进展。

