亚麻荠FUS3转录因子的鉴定及功能分析
罗 涛,王计平,高慧玲,崔红利,李润植
(山西农业大学 分子农业与生物能源研究所,山西太谷 030801)
亚麻荠属于十字花科亚麻荠属一年生草本植物,被认为是保健食用油和生物柴油的优质原料[1]。与其他油料作物相比,亚麻荠在生长周期(约90 d)以及抗逆方面具有明显优势[2]。更为重要的是,亚麻荠作为一种古老而又富含研究价值的环境友好型油料作物,其种子含油量较高(种子干重的36%~47%),而且富含多不饱和脂肪酸(PUFA),其中亚油酸(C18:2)约占总含油量的19%,亚麻酸(C18:3)约占32%[3]。植物油脂合成途径主要包括在质体中的从头合成以及内质网上的加工和组装过程[4-5],转录因子可以通过结合顺式作用元件调控下游基因表达,从而调控物质合成与代谢过程。
近年来,转录因子的功能研究越来越多,包括在非生物胁迫[6]、代谢物质积累[7-9]及生长发育[10]等方面。LAFL基因(包括LEC1、LEC2、ABI3和FUS3)调控种子发育的不同阶段,包括胚胎发生和贮藏物质的积累[11-12]。FUS3是可以调控油脂合成基因的植物特异性转录因子之一,它包含一个B3结构域,该结构域能特异性结合RY元件[13],调控下游基因的转录表达。有研究发现,过表达LEC1可以增加拟南芥幼苗的油脂积累,而在FUS3突变体中,LEC1的表达并没有导致油脂含量的明显增加,这说明LEC1的功能部分依赖于FUS3[14];对拟南芥FUS3突变体的研究还发现,拟南芥FUS3突变体中总脂肪酸含量为野生型含量的31%,与ABI3(62%)和LEC2(79%)突变体相比变化更显著,由此说明FUS3在拟南芥油脂积累方面发挥重要调控作用[15]。Elahi等[16]在油菜FUS3突变体中同样发现FUS3能调控油脂的积累;Zhang等[17]过表达FUS3后,激活了烟草BY2细胞和拟南芥幼苗中的TAG生物合成,当FUS3和DGAT1共表达时,又进一步增加了烟草BY2细胞的油脂积累。另外,在拟南芥FUS3突变体中,油酸(C18:1)的去饱和效率较野生型明显降低,并且FUS3在一定程度上也调控超长链脂肪酸的积累[15]。这些研究结果均表明FUS3在调控油脂合成与积累过程中发挥重要作用。
本研究利用生物信息学方法及RT-PCR技术分析鉴定了亚麻荠CsFUS3-1和CsFUS3-2基因,并预测其互作蛋白及下游表达基因,利用实时荧光定量PCR检测CsFUS3基因的时空表达模式,并通过异源表达鉴定CsFUS3基因的功能。该研究为深入解析亚麻荠高油含量的分子机制提供新知识,同时,为进一步筛选和培育优良油料作物新品种提供新的基因元件和技术支撑。
1 材料和方法
1.1 试验材料
供试材料亚麻荠(SC-N1)种植于山西农业大学试验田。试验所用的组织材料(根、茎、叶)取自亚麻荠8~10片真叶的幼苗,花取自亚麻荠盛花期,于亚麻荠花后10、20、30、40 d采集种子。各试验材料采集后液氮速冻,存放于-80 ℃超低温冰箱。
烟草种子、农杆菌感受态细胞(GV3101)均由分子农业与生物能源研究所提供。pCAMBIA3300载体购买自淼灵质粒平台。
1.2 方 法
1.2.1 CsFUS3家族的鉴定及生物信息学分析利用AtFUS3蛋白序列作为种子序列,在亚麻荠基因组库中进行Blastp筛选,初步筛选出2条亚麻荠CsFUS3蛋白序列,分别命名为CsFUS3-1和CsFUS3-2。利用CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、PFAM(https://pfam.xfam.org/)、SMART(http://smart.embl-heidelberg.de/)对两条候选序列进行功能结构域分析。
利用ProtParam(https://web.expasy.org/protparam/)在线数据库分析CsFUS3蛋白序列的基本理化性质;利用在线工具对CsFUS3蛋白进行亚细胞定位(https://psort.hgc.jp/form2.html)、信号肽(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)和跨膜区(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)预测分析;分别利用在线网站SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/interactive)对CsFUS3蛋白序列进行二级和三级结构预测;运用在线网站GSDS2.0(http://gsds.gao-lab.org/)分析CsFUS3的基因结构。
利用DNAMAN对AtFUS3和CsFUS3进行多序列比对分析;运用MEGA7.0对亚麻荠CsFUS3以及其他物种的FUS3蛋白序列(表1)进行系统进化分析,方法为邻接法(Neighbor-joining method);利用在线工具MEME(http://meme-suite.org/tools/meme)对CsFUS3蛋白家族进行保守结构预测分析;利用TBtools提取亚麻荠CsFUS3基因上游2 000 bp的启动子区序列,利用Plant CARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对其进行顺式作用元件预测分析。

表1 各物种FUS3蛋白序列信息
1.2.2 CsFUS3互作蛋白预测为了获得亚麻荠CsFUS3蛋白与其他蛋白之间的互作关系,通过在线网站STRING(https://cn.string-db.org/)进行互作蛋白预测,最小相互作用分值设置为0.7。
1.2.3CsFUS3下游基因预测为研究CsFUS3参与亚麻荠油脂合成的调控机制,进一步分析了油脂合成相关基因的上游启动子序列。根据CsFUS3特异性结合RY元件特性[13],筛选CsFUS3可能调控的下游基因;再从亚麻荠转录组数据[18]中提取这些下游基因在不同发育时期种子中的转录表达数据(FPKM)进行相关性分析,并绘制折线图,分析CsFUS3基因与下游基因的共表达模式。
1.2.4CsFUS3基因的表达模式分析利用试剂盒(9109, TaKaRa)提取亚麻荠不同组织(根、茎、叶、花及不同发育时期的种子)的总RNA,利用反转录试剂盒(RR047A, TaKaRa)将提取的总RNA反转录成cDNA。用Primer 6.0软件设计CsFUS3基因特异性引物,以亚麻荠CsActin作为内参基因(表2),对CsFUS3基因进行RT-PCR分析;用试剂盒(RR820A, TaKaRa)进行qRT-PCR检测,每个样品设置3次重复。采用2-△△Ct计算基因的相对表达量,用SPSS 25.0软件进行显著性分析。

表2 引物信息
1.2.5 烟草瞬时表达表达载体pCAMBIA3300-CsFUS3-1和pCAMBIA3300-CsFUS3-2由苏州金唯智生物科技有限公司构建。利用试剂盒(9760,TaKaRa)提取质粒,将提取的质粒通过热激法转入根癌农杆菌,用引物F(TGTAAAACGACGGCCAGT)和R(CAGGAAACAGCTATGACC)检测后,配制烟草侵染液,用注射器侵染烟草叶片。取侵染3 d后的叶片提取RNA,检测目的基因是否有效表达,所用CsFUS3基因引物见表2,烟草内参基因NtActin引物为F(CAGTGGCCGTACAACAGGTA)和R(AACCGAAGAATTGCATGAGG)。取侵染5 d后的叶片冷冻干燥,保存备用。
1.2.6 总油脂的提取和测定采用氯仿-甲醇法提取烟草叶片的总油脂。称取50 mg粉末,加7.5 mL甲醇:氯仿(2∶1),置于37 ℃摇床振荡反应24 h,离心收集上层有机相。沉淀再用7.5 mL甲醇∶氯仿(2∶1)抽提2 h,收集上层有机相。将收集的上层有机相合并,加入5 mL氯仿和9 mL 1% NaCl溶液,使体系中甲醇∶氯仿∶1% NaCl溶液体积比为2∶2∶1.8,混匀后离心。吸取下层清液于称重后的玻璃管(W1)中,氮吹仪吹干后,置于真空干燥箱中4 h,称重(W2)。总油脂含量=(W2-W1)/0.05。
2 结果与分析
2.1 亚麻荠CsFUS3蛋白的理化性质分析
利用AtFUS3蛋白序列进行本地Blast,鉴定出2条亚麻荠CsFUS3蛋白序列,均与拟南芥AtFUS3属于B3蛋白家族,分别命名为CsFUS3-1和CsFUS3-2,蛋白长度分别为310和311个氨基酸,分子量分别为34.98和35.03 kD,理论等电点分别为5.65和5.55,均为酸性蛋白。CsFUS3-1和CsFUS3-2蛋白不稳定指数各为45.43和45.57,均属于不稳定蛋白。2个CsFUS3蛋白均无跨膜区和信号肽,不属于分泌蛋白。通过亚细胞定位发现,2个CsFUS3蛋白与拟南芥AtFUS3均位于细胞核。经比较CsFUS3和AtFUS3蛋白的理化性质基本一致(表3)。
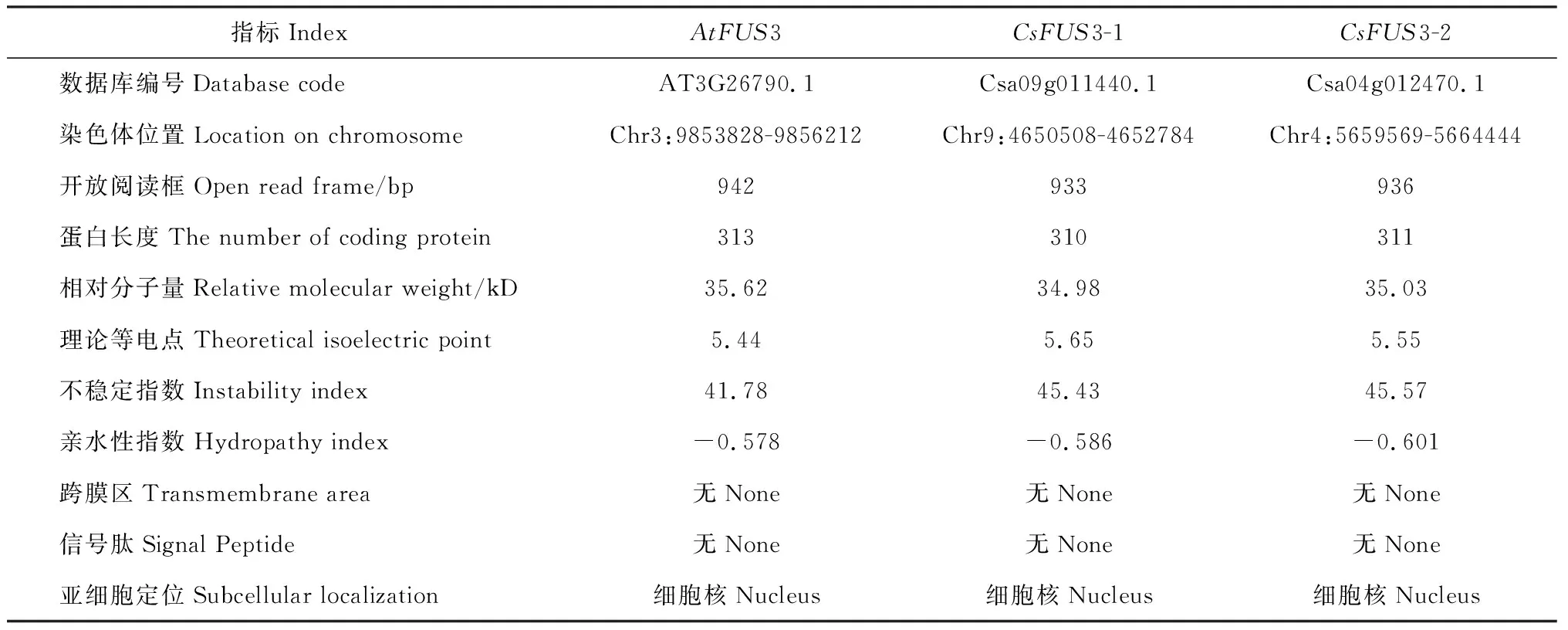
表3 亚麻荠CsFUS3基因及编码蛋白的基本信息
2.2 CsFUS3基因及编码蛋白结构预测
基因结构(图1)比较发现,CsFUS3和AtFUS3基因的结构相似,3个基因均含有6个外显子,其中CsFUS3-1和AtFUS3包含5个内含子,而CsFUS3-2除了编码区含有5个内含子外,5′端非编码区还存在1个内含子。
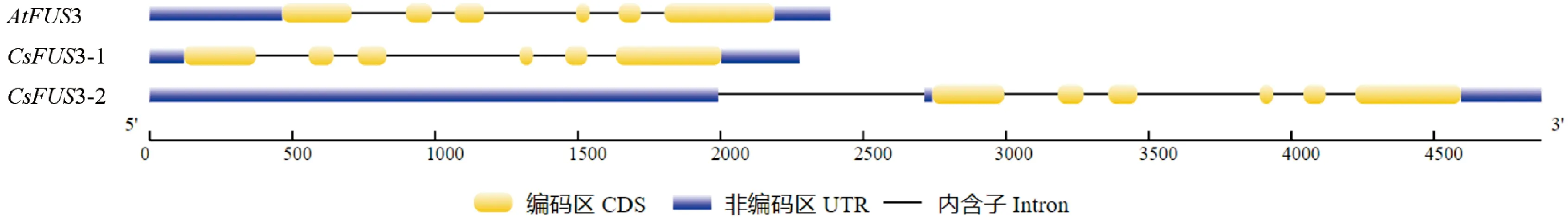
图1 亚麻荠CsFUS3与拟南芥AtFUS3基因结构比较Fig.1 Gene structure of CsFUS3 from C. sativa and AtFUS3 from Arabidopsis thaliana
二级结构预测(图2)发现,亚麻荠CsFUS3-1蛋白的二级结构包括无规则卷曲47.42%、α-螺旋29.35%、延伸链17.1%和β-转角6.13%;CsFUS3-2蛋白的二级结构包括无规则卷曲45.98%、α-螺旋26.37%、延伸链18.65%和β-转角9%。2个CsFUS3蛋白与拟南芥AtFUS3的二级结构组成(无规则卷曲46.96%、α-螺旋27.48%、延伸链19.17%、β-转角6.39%)类似,其中无规则卷曲的占比最高,其次是α-螺旋和延伸链,而β-转角占比最小。3个FUS3蛋白的二级结构相似,只是在各组成结构占比上存在一定差异。

图2 亚麻荠CsFUS3与拟南芥AtFUS3蛋白的二级结构比较Fig.2 Secondary structure of CsFUS3 proteins from C. sativa and AtFUS3 protein from A. thaliana
对CsFUS3与拟南芥AtFUS3蛋白进行同源建模比较(比对模板编号:5z00.1.C),结果见图3,CsFUS3-1和CsFUS3-2的序列相似度分别为0.4和0.41,覆盖度均为0.35,都是以同源四聚体形式发挥作用。与AtFUS3蛋白一样,构成CsFUS3蛋白的多肽链不存在配体。

图3 亚麻荠CsFUS3与拟南芥AtFUS3蛋白的三级结构比较Fig.3 Tertiary structure of CsFUS3 proteins from C. sativa and AtFUS3 protein from A. thaliana
2.3 CsFUS3蛋白的多序列比对、系统进化及保守基序分析
与AtFUS3蛋白进行序列比对(图4)发现,2个CsFUS3与AtFUS3蛋白序列相似性极高,均包含一个高度保守的B3结构域。系统进化分析(图5,A)发现,各物种的FUS3蛋白大致分为三类,CsFUS3蛋白与拟南芥、白菜型油菜、蓖麻和麻风树FUS3聚类于同一分支,且CsFUS3与拟南芥AtFUS3的亲缘关系最近,可能具有相同的进化来源。

图4 亚麻荠CsFUS3与拟南芥AtFUS3蛋白序列比对Fig.4 Multiple sequence alignment of CsFUS3 proteins of C. sativa and AtFUS3 protein from A. thaliana
在MEME网站进行保守结构域(图5,B)预测分析,发现亚麻荠CsFUS3与同属于十字花科的拟南芥和白菜型油菜FUS3具有相同的保守域且分布一致。与其他物种的FUS3蛋白相比,十字花科植物的FUS3中包含独有的motif 8,该motif可能是十字花科物种FUS3蛋白在进化上的关键氨基酸残基位点。

AtFUS3. 拟南芥;BrFUS3a、BrFUS3b. 白菜型油菜;RcFUS3. 蓖麻;JcFUS3. 麻风树;AhFUS3. 花生;GmFUS3a、GmFUS3b. 大豆;GsFUS3. 野大豆;HvFUS3. 大麦图5 各物种FUS3蛋白的系统进化树和保守基序分析AtFUS3. Arabidopsis thaliana;BrFUS3a, BrFUS3b. Brassica rapa;RcFUS3.Ricinus communis;JcFUS3. Jatropha curcas;AhFUS3. Arachis hypogaea;GmFUS3a, GmFUS3b. Glycine max;GsFUS3. Glycine soja;HvFUS3. Hordeum vulgareFig.5 Phylogenetic tree and conserved motif analysis of FUS3 proteins from various species
2.4 CsFUS3启动子元件分析
提取CsFUS3基因上游2 000 bp序列进行启动子元件分析,结果见表4,两个CsFUS3基因包含相同的功能元件,分别是启动子基本元件CAAT-box和TATA-box、参与胚乳特异性负表达元件、参与防御和应激反应的顺式作用元件、厌氧诱导所必需的顺式调节元件、光响应元件、与光反应有关的MYB结合位点和α-淀粉酶启动子保守序列。

表4 亚麻荠CsFUS3基因上游启动子顺式作用元件
2.5 CsFUS3与油脂合成相关蛋白的互作分析
利用STRING在线数据库进行互作蛋白预测发现(图6),CsFUS3与WRI1、AGL15、ABI5和BBM蛋白之间存在互作关系。WRI1在脂肪酸合成途径中发挥重要作用[19],而另外3个蛋白主要与植物的生长发育调控相关[20-23]。

图6 亚麻荠CsFUS3与相关蛋白间的相互作用网络Fig.6 Interaction network between CsFUS3 and related proteins in C. sativa
2.6 CsFUS3的组织表达特异性
为了探究CsFUS3基因在亚麻荠各组织中的功能,分别检测了2个CsFUS3基因在亚麻荠的根、茎、叶、花以及不同发育时期的种子中的表达量,发现CsFUS3基因仅在种子中表达(图7),并且随着种子的发育成熟,CsFUS3-1和CsFUS3-2基因表达量均呈现先增高后降低的变化趋势,在花后30 d基因表达量达到最高,随后逐渐降低。

不同小写字母表示在P< 0.05水平上差异显著图7 亚麻荠CsFUS3基因表达分析Different normal letters indicate significantly different at P < 0.05Fig.7 Expression analysis of CsFUS3 genes of C. sativa
2.7 CsFUS3下游靶基因预测
根据CsFUS3特异性结合RY元件的特性,对油脂合成相关基因的上游启动子进行分析,发现6个可能的靶基因(表5)。转录组数据显示,这些基因在种子中特异性表达。根据OLE1、OLE2、OLE3、ABI3-1、ABI3-2和ABI3-3基因在不同发育时期的种子中的FPKM值,预测其与CsFUS3基因的共表达模式,结果如图8所示,4个基因(OLE1、OLE2、OLE3和ABI3-3)与CsFUS3基因的表达量变化趋势显著相关(P<0.01),在花后30 d时表达量均达到最高。因此,推测在亚麻荠种子发育时期CsFUS3直接调控OLE1、OLE2、OLE3和ABI3-3基因的转录表达。
表5 预测基因在亚麻荠数据库中的编号
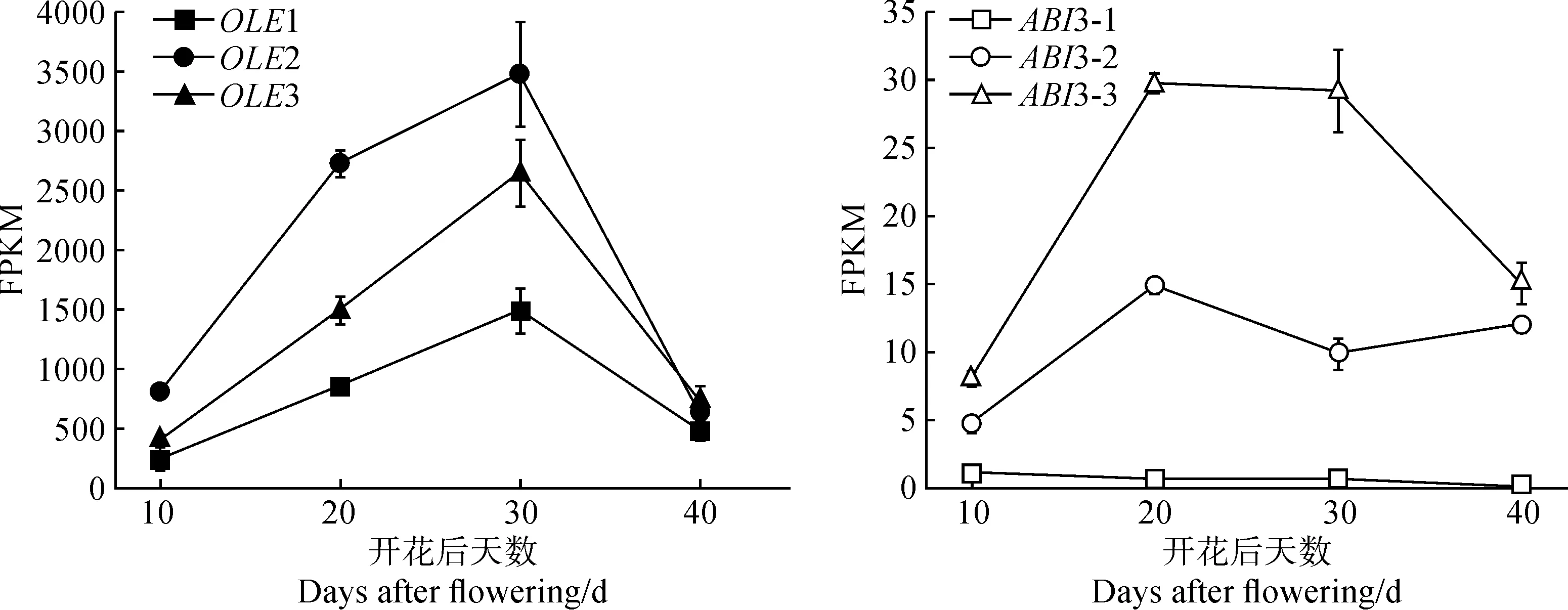
图8 预测基因在亚麻荠不同发育时期种子中的FPKM变化趋势Fig.8 FPKM variation trend of predicted genes at different seed developmental stages of C. sativa
2.8 过表达CsFUS3促进烟叶总油脂含量积累
为解析CsFUS3是否具有调控油脂合成的功能,分别构建植物表达载体pCAMBIA3300-CsFUS3-1和pCAMBIA3300-CsFUS3-2(图9,A),通过双酶切验证(图9,B、C)载体正确后,转化根癌农杆菌,得到阳性单克隆(图9,D、E)。利用农杆菌介导烟草叶片瞬时表达CsFUS3基因,侵染3 d后,提取叶片RNA,RT-PCR检测显示,CsFUS3-1和CsFUS3-2基因在烟草叶片中有效表达(图10)。
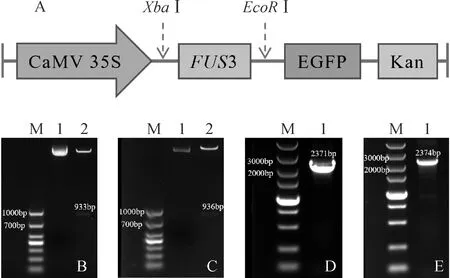
A. 植物重组表达载体示意图; B~C. 载体双酶切验证:M. DL2000;1. pCAMBIA3300-CsFUS3-1(B)和pCAMBIA3300-CsFUS3-2(C);2. 双酶切;D~E. 农杆菌转化:M. DL5000;1. 农杆菌阳性单克隆,pCAMBIA3300-CsFUS3-1(D)和pCAMBIA3300-CsFUS3-2(E)图9 植物重组表达载体构建及验证A. Schematic diagram of plant recombinant expression vector;B-C. Double restriction enzyme digestion verification of vector: M. DL2000;1. pCAMBIA3300-CsFUS3-1(B) and pCAMBIA3300-CsFUS3-2(C);2. Double digested; D-E. Detection of Agrobacterium transformants: M. DL5000;1. The positive Agrobacterium clones,pCAMBIA3300-CsFUS3-1(D) and pCAMBIA3300-CsFUS3-2(E)Fig.9 Construction and verification of plant recombinant expression vector

M. DL1000;A. 烟草内参基因RT-PCR检测: 1、2. CsFUS3-1转基因叶片;3、4. CsFUS3-2转基因叶片;B. CsFUS3-1基因RT-PCR检测;C. CsFUS3-2基因RT-PCR检测图10 烟草叶片瞬时表达RT-PCR检测M. DL1000;A. RT-PCR detection of tobacco reference genes:1,2. CsFUS3-1 transgenic leaves;3,4. CsFUS3-2 transgenic leaves;B. RT-PCR detection of CsFUS3-1;C. RT-PCR detection of CsFUS3-2Fig.10 RT-PCR detection of transient expression in tobacco leaves
选取野生型及转CsFUS3-1和CsFUS3-2基因的烟草叶片进行总油脂含量测定。结果显示(图11),与野生型相比,转CsFUS3-1和CsFUS3-2基因的叶片总油脂含量分别提高了0.95%和1.12%,但差异不显著。

不同小写字母表示在P< 0.05水平上差异显著图11 过表达CsFUS3基因的烟叶总油脂含量Different normal letters indicate significantly different at P < 0.05Fig.11 Total oil content in tobacco leaves overexpressing CsFUS3 genes
3 讨 论
3.1 CsFUS3基因序列结构特征及高度保守性
FUS3是一类植物特异性转录因子,仅存在于种子植物中[24-25],并在种子成熟过程中发挥作用[26]。目前对该基因的研究主要在拟南芥[27-29]、油菜[16,30]和花生[31]等植物中,而亚麻荠FUS3基因的研究鲜有报道。本研究利用AtFUS3蛋白序列,在亚麻荠基因组数据库中鉴定出2条完整的CsFUS3蛋白序列,这两条序列均包含一个B3结构域,属于B3家族蛋白[32]。系统发育显示CsFUS3与同属十字花科的拟南芥和白菜型油菜AtFUS3蛋白亲缘关系最近,并且这些蛋白包含的保守基序高度一致,说明FUS3蛋白的进化高度保守。
亚麻荠CsFUS3基因启动子区涉及到参与胚乳特异性调控、防御和应激反应、厌氧诱导和光响应元件,以及MYB结合位点和α-淀粉酶启动子保守序列。众多调控因子参与植物细胞胚胎发育,其中包括FUS3[33],如韦云婷等[30]对甘蓝型油菜分析发现,FUS3对胚胎发育具有重要作用;另有研究表明,与MYB有关的一些结合元件大多与植物的干旱反应相关[34],在甘蓝型油菜中BnaFUS3可以响应多种非生物胁迫[35];推测亚麻荠CsFUS3基因可能响应逆境胁迫,并参与植物胚胎发生过程。
3.2 CsFUS3在亚麻荠种子中特异表达
本研究发现,CsFUS3基因在亚麻荠种子中特异性表达,并在种子的四个发育时期中表达量呈先升高后降低的趋势,与花生和油用牡丹种子中FUS3基因的表达模式相同[31,36]。CsFUS3基因在亚麻荠种子发育中后期的表达量最高,推测CsFUS3基因在该时期通过调控相关基因表达来控制种子中油脂的合成与积累。
3.3 CsFUS3基因调控网络
在拟南芥中,由LEC1、ABI3、FUS3和LEC2组成的LAFL调控网络,是激活种子发育成熟的主调控因子[15]。FUS3基因直接作用ABI3参与种子储藏蛋白和油体蛋白的合成[29]。FUS3与质体脂肪酸生物合成基因的转录表达也表现出一定的诱导关系[37]。本研究结果推测,CsFUS3直接调控ABI3-3和OLE基因表达促进种子TAG积累。
互作蛋白预测分析发现,CsFUS3与WRI1蛋白相互作用参与种子油脂合成调控,FUS3与AGL15、BBM、ABI5蛋白之间的互作,可能在植物胚胎发生、种子发育等方面发挥重要作用[4,29]。
3.4 CsFUS3基因促进烟草叶片油脂积累
本研究构建植物表达载体,在烟草叶片中异源表达CsFUS3-1和CsFUS3-2基因,发现转基因叶片中总油脂含量比野生型高,但差异不显著,表明CsFUS3基因可能会促进细胞油脂合成积累,我们将进一步转化亚麻荠及拟南芥验证其功能。

