小反刍兽疫病毒抗体ELISA 试验测量不确定度评估
王治维,图门巴雅尔,孙 娜,胡明明,孙 杰,宁 艳,雷 冲,王 锦,赵 凯,张 昱,雷宇平,陈 勇,王仲兵
(1.山西省动物疫病预防控制中心,山西太原 030027;2.山西农业大学,山西晋中 03080 1;3.磐石市农业综合行政执法大队,吉林磐石 132300)
测量不确定度简称不确定度,是指根据所用到的信息,表征赋予被测量值分散性的非负参数(JJF 1059.1—2012)或表示与测量结果相关联的参数,表征合理地赋予被测量值的分散性(CNASGL043:2020)[1-2]。其本质为表征结果的分散性,根据计算公式,其必然为非负数。具体而言,不确定度包括由系统影响引起的若干分量。测量结果包括估计值和测量不确定度,而不确定度反映了测量结果的可信程度[3]。
ELISA 试验因操作相对简便,检测敏感性和特异性较高,成为近年来兽医系统实验室常用的检测方法之一。随着检测实验室认证认可要求的提高,测量不确定度评估在兽医实验室越来越被接受及应用。口蹄疫、禽白血病抗体ELISA 检测已经开展了相应测量不确定度评估[4-5]。
本研究利用ELISA 试验测定小反刍兽疫病毒(PPRV)抗体,并对测量不确定度进行了评定和计算,提供了测量过程中各分量的组成和计算方法,科学评定了此方法的准确性,以期为兽医实验室测量不确定度评估提供参考。
1 材料与方法
1.1 材料
1.1.1 样品与试剂 PPRV 阻断ELISA 抗体检测试剂盒(批号20200701),购自武汉科前生物股份有限公司,包括试剂盒自带的阴性和阳性对照样品;5 份待测羊血清样品,来源于山西省动物疫病预防控制中心兽医实验室,均为留样样品,其中3份阳性、2 份阴性。
1.1.2 主要仪器酶标仪(型 号CYTATION5),为美国BioTek 公司产品;移液器(量程20~200 μL),为Eppendorf 公司产品;恒温培养箱(型号SPX-150B III),为天津泰斯仪器有限公司产品。
1.2 检测方法
按照《小反刍兽疫诊断技术》(GB/T 27982—2011),应用ELISA 试验检测血清中PPRV 抗体。
2 结果及分析
2.1 被测量的数学模型
根据试剂盒说明书中提供的公式进行计算和判定。被测量的数学模型为PB=(1-S/N)×100%。式中,PB 为阻断率,S和N分别为样品和阴性对照在450 nm 波长处的吸光度(OD450nm)。
2.2 不确定度来源分析
根据检测的方法原理,影响不确定度的因素有移液器、加样时间、孵育温度、孵育时间、试剂盒质量和酶标仪精度等。对各不确定度分量的来源进行分析并建立相应数学模型,此试验不确定度分量的来源主要为样品(T)和阴性对照(N)的不确定度,分别由uT、uN表示。
2.2.1uT的来源 根据检测原理及试剂盒说明书,样品(T)OD450nm的不确定度分量有:孔间试剂OD450nm的不确定度(uT1);样品加样量带入的不确定度(uT2),包括移液器相对误差、加样量、温度效应分别引入的不确定度uT2-1、uT2-2、uT2-3;样品加样时间带入的不确定度(uT3);酶标仪带入的测量不确定度(uT4),包括OD450nm值准确度、重复性引入的不确定度uT4-1、uT4-2以及校准酶标仪时所使用的标准物质引入的不确定度uT4-3;孵育时间引入的不确定度(uT5),包括第1 次孵育60 min、第2 次孵育30 min 引入的不确定度uT5-1、uT5-2;孵育温度引入的不确定度(uT6),包括第1、2 次孵育引入的不确定度uT6-1、uT6-2。
2.2.2uN的来源 主要包括阴性对照(N)OD450nm重复性引入的不确定度uN-1以及酶标仪的测量不确定度uT4。
2.3 测量不确定度分量评定
2.3.1 孔间试剂吸光度值不确定度(uT1)试剂反应孔间的不确定度可通过实验室试验获得,结果见表1。依据JJF 1059.1—2012 中A 类合并样本标准差的方法,取m=5,可得到试剂孔间OD450nm的标准不确定度:

表1 批内精密性数据
2.3.2 样品加样量引入的不确定度(uT2)
2.3.2.1 移液器相对误差引入的不确定度(uT2-1)移液器校准证书中在100 μL 量程处的RE(relative error,相对误差)为0.2%。根据JJF 1059.1—2012,进行B 类不确定度评定,假设移液器的误差均匀分布,即等概率地落在区间内,uT2-1=a/k,k=根据公式可得出移液器100 μL 量程处的RE 引入的不确定度为0.115 μL。同理,50 μL 量程处的RE 为0.3%(按照0.2%~0.4%平均值计算),可得出uT2-1-1=0.086 6 μL。
2.3.2.2 移液器加样引入的不确定度(uT2-2)根据移液器100 μL 量程处的相关数据,其准确度为2%,试验中每次的加样量为100 μL,按照矩形分布,移液器加样引入的标准不确定度uT2-2=(100 μL×2%)=1.15 μL。同理,50 μL 量程的准确度为3%(按照2%~4%平均值计算),ELISA试验中加样量为50 μL,按照矩形分布,移液器加样引入的标准不确定度uT2-2-1=(50 μL×3%)=0.866 μL。
2.3.2.3 移液器温度效应引入的不确定度(uT2-3)容量器皿在20 ℃被校准,根据实验室实际工作温度在(20±4)℃波动,水的膨胀系数为2.1×10-4/℃,按照矩形分布,在100 μL 量程处移液器由温度效应引入的标准不确定度uT2-3=100×4×2.1×10-4=0.084 μL,在50 μL 量程处的标准不确定度uT2-3-1=50×4×2.1×10-4=0.042 μL。
2.3.3 样品加样时间引入的不确定度(uT3)每次检测的样品加样时间不超过10 min,假设样品的加样时间等概率落在0~10 min 区间内,则uT3=a/k=(10/2)=2.887 min。
2.3.4 酶标仪引入的测量不确定度(uT4)根据CYTATION5 酶标仪的校准证书,OD450nm准确度为±0.005,OD450nm测量重复性为0.1%(技术要求为≤1.0%)。假设酶标仪测量的OD450nm重复性均匀分布,可得出OD450nm准确度引入的不确定度uT4-1=a/k=(0.005/2)=0.001;OD450nm重复性引入的不确定度uT4-2=a/k=(1×0.1%/2)=0.000 3;酶标仪的校准证书给出检定用标准物质的吸光度U=0.01A(k=2),则标准物质引入的标准不确定度uT4-3=a/k=0.006。
2.3.5 孵育时间引入的测量不确定度(uT5)根据ELISA 试剂盒说明书,试验中孵育时间分别为(60±3)min 和(30±3)min,按照均匀分布计算,标准差==1.732 min。uT5=
2.3.6 孵育温度引入的测量不确定度(uT6)根据ELISA 试剂盒说明书,试验中孵育温度均为(37±t)℃,根据均匀分布计算,其标准差为=±1 ℃,所以孵育温度的相对不确定度uT6=
2.3.7 阴性对照吸光度值引入的不确定度(uN)本研究设置19 个阴性对照,阴性对照OD450nm及SD值见表2。根据贝塞尔公式,计算出阴性对照的标准不确定度uN-1==0.071。阴性对照引入的不确定度(uN)由重复性不确定度uN-1及uT4两个分量组成,因此

表2 阴性对照及阳性对照孔数据
2.4 合成标准不确定度评定
2.4.1 样品加样量引入的合成标准不确定度(uT2)对于ELISA 试验,测定OD 时,样品孔中液层由底物溶液(V底)和终止液(V终)组成,加入100 μL底物(V底)引起的标准合成不确定度u(V底)==1.159 μL。同理,加入50 μL终止液(V终)引入的标准合成不确定度u(V终)==0.871 μL。因为u(V底)和u(V终)是两个相互独立的分量,由加样量引入的合成标准不确定度uT2=
2.4.2 酶标仪引入的合成标准不确定度(uT4)由于各分量互不相关,故酶标仪的测量标准不确定度0.006 09。
2.4.3 检测样品OD450nm的合成不确定度(uT)根据经验值确定:(1)样品加样量每±1 μL,样品(T)的吸光度值±0.020,故uT2灵敏系数为0.020;(2)样品加样时间每±1 min,样品(T)的吸光度值±0.010,故uT3的灵敏系数为0.010;(3)样品孵育时间每±1 min,样品(T)的吸光度值±0.012,故uT5的灵敏系数为0.012;(4)样品孵育温度每±1 ℃,样品(T)的吸光度值±0.001,故uT6的灵敏系数为0.001。检测样品(T)OD450nm的不确定度(uT)分量见表3。因各分量互不相关,均相互独立,合成检测样品(T)OD450nm的标准不确定度uT=0.086 3。
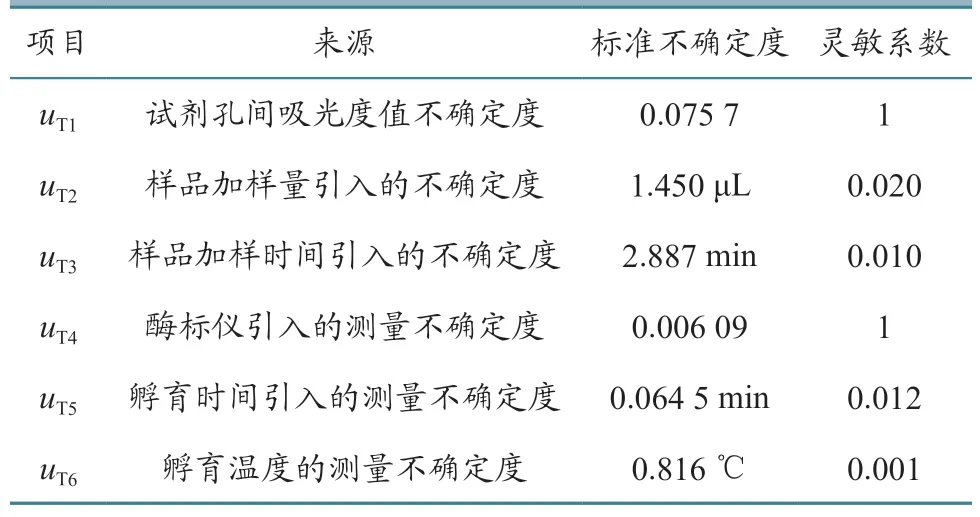
表3 检测样品(T)OD450nm 的不确定度评定一览表
2.4.4 合成样品(T)OD450nm与阴性对照的比值(S/N)的不确定度(uS/N)根据公式uS/N=,经过计算,(1)样品OD450nm引入的不确定度的灵敏系数为0.011;(2)阴性对照OD450nm引入的不确定度的灵敏系数为0.11。本研究中样品的OD450nm为0.168,阴性对照的OD450nm均值为1.531,S/N值为89.03%。S/N值的标准不确定度uS/N
2.5 扩展不确定度评定
取k=2,则uS/N的扩展不确定度U=ku=1.36%(k=2)。
3 讨论
不确定度表征被测量值可能出现的范围,代表着测量结果质量。测量结果附上不确定度才更完整、有意义。ELISA 试验引入不确定度后,提升了测量结果的可信性,有效降低了误判风险。本研究中,根据ELISA 抗体检测试剂盒说明书中判定标准,若PB ≥50%,则判定为PPRV 抗体阳性;若PB <50%,则判定为PPRV 抗体阴性。若考虑其测量不确定度对结果的影响,则PB±U≥50%,判定为PPRV 抗体阳性;PB±U<50%,判定为PPRV 抗体阴性。这一研究表明,在PB±U区间内样品应判定为阳性,可有效减少假阴性样品出现概率,有助于精确评估免疫效果,避免过度免疫;也有助于小反刍兽疫退出强制免疫的评估。杜鹃[4]研究了口蹄疫病毒O型抗体测量不确定度的引入,并分析了各不确定度分量在整体不确定度值中所占的比例,有效降低了假阳性、假阴性结果的出现概率,抗体效价判定更为准确。李雪莲等[5]将测量不确定度引入ELISA检测活疫苗中病毒污染研究,对生产使用真正纯净疫苗具有重要意义。史喜菊等[6]在牛布鲁氏菌补体结合试验中引入测量不确定度,提高了测量结果质量。因此,研究不同试验方法的测量不确定度,可以逐步构建动物疫病检测领域试验的不确定度评定体系。
通过对构成不确定度的各分量进行详细分析,并分析各分量在整体不确定度值中所占的比例,可直观了解对检测结果质量影响最大的因素,在对这些因素针对性地改进后,可以有效提高检测质量。本研究中,影响ELISA 检测结果质量的主要因素为试剂孔间吸光度值和酶标仪的测量。可以通过严格按照酶标仪相关规程进行核查和维护,合理利用校准数据来降低酶标仪引入的不确定度。因ELISA试验中孔间OD 值引入的不确定度很难进行较大改善,只能通过选用敏感性、特异性等更好的试剂进一步减小不确定度。

