酸性H2 O2 氧化预处理浮选金精矿及其机理研究
支永祥 唐 云 邓政斌 李 帅 李宜昌 吴 波
(1.贵州大学矿业学院,贵州 贵阳 550000;2.贵州紫金矿业股份有限公司,贵州 黔西南 562400;3.贵州省非金属矿产资源综合利用重点试验室,贵州 贵阳 550000)
截至2020 年底,我国黄金资源量为14 727.16 t,世界排名第9 位[1-2]。在我国已探明储量的金矿资源中,难选金矿约占总量的四分之一[3]。自然金与黄铁矿成矿关系密切,几乎所有的金矿床中都有黄铁矿与金共生或伴生,黄铁矿是金矿床中重要的载金矿物[4]。在难选金矿中,微细浸染型金被黄铁矿、毒砂等硫化矿包裹而不能与浸金剂接触反应,阻碍了金的有效浸出[5-6]。欲使难选金矿获得较理想的回收率,在氰化浸金前需进行氧化预处理,通过一系列氧化反应使载金矿物溶蚀。
目前,工业上传统的难选金矿预处理方法主要有焙烧法、加压氧化法、生物氧化法和化学氧化法等[7-8],而传统的浸金预处理方法虽各具特点但都存在一定的局限性。笔者在高级氧化体系中已经开展了过硫酸盐体系氧化预处理黄铁矿试验,采用Fe2+为引发剂引发过硫酸根产生极具强氧化性的中间体·氧化黄铁矿,黄铁矿的氧化预处理取得了较为理想的效果[9-10]。由于氧化预处理中引入铁盐,增加了体系中铁离子的浓度,增大浸渣渣量或消耗更多的浸金剂。鉴于此,本文利用H2O2在酸性条件下氧化预处理浮选金精矿,黄铁矿是浮选金精矿中最主要的载金矿物,故以黄铁矿的氧化浸出过程分析浮选金精矿的氧化预处理机理。本文通过分析氧化浸出过程中不同存在形态Fe和S 元素的浓度,以及测定Fenton 反应中产生中间体·OH 的浓度,并结合XPS、XRD 表征和E-pH 分析,揭示酸性H2O2氧化预处理黄铁矿的机理,为以载金黄铁矿为主的微细浸染型金矿氧化预处理提供依据。
1 试验原料及试验方法
1.1 试 样
纯矿物试验所用黄铁矿富块矿杂质少、结晶较完整,试样破碎后人工挑选出脉石矿物,通过碎磨后筛分至-0.18 mm,摇床富集得到黄铁矿纯矿物,用玛瑙研磨机研磨并筛分至0.075 ~0.045 mm,低温烘干并真空保存,通过半熔重量法分析,其纯度94.18%,符合纯矿物试验要求。实际矿石试验试样来源于黔西南某微细浸染型金矿浮选金精矿,其化学多元素和矿物组成分析结果如表1、图1所示。浮选金精矿金品位为13.10 g/t,主要富集于黄铁矿中。

图1 浮选金精矿XRD 图谱Fig.1 XRD spectrum of flotation gold concentrate

表1 浮选金精矿主要化学成分分析结果Table 1 Main chemical composition analysis results of flotation gold concentrate %
1.2 试验方法
1.2.1 氧化预处理试验
将黄铁矿或浮选金精矿与H2O2配制成矿浆于250 mL 锥形瓶中,放入磁力搅拌子并盖上橡胶塞保证矿浆浓度恒定,锥形瓶置于水浴加热磁力搅拌器恒温槽内,实现试验过程中的搅拌和恒温。开始氧化浸出反应时计时,定时取样过滤并分析。对所取溶液中的Fe 离子(Fe2+、Fe3+)、硫氧根离子(SnOx)以及羟基自由基(·OH)浓度进行测定;Fe 离子浓度采用国家标准GB/T 3049—2006进行分析;S2-、及采用碘量法结合分光光度法进行分析[11-12],采用国家标准GB 13580.2 进行分析。氧化浸出试验结束立即过滤,将浸渣烘干、称重并计算试样氧化浸出过程的试样失重率,对浸渣进行XPS和XRD 表征分析。以浸出液中Fe 浸出率和试样失重率作为氧化浸出效果的评价指标。
试样中Fe 浸出率(ηFe)和试样失重率分别采用式(1)和式(2)计算:
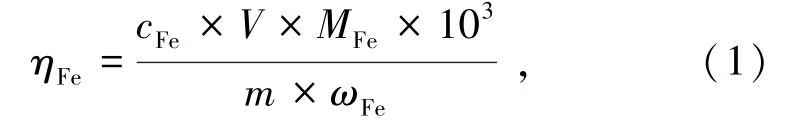
式中,cFe为浸出液中铁离子浓度,mol/L;V为溶液体积,mL;MFe为铁相对原子质量,g/mol;m为预处理前黄铁矿纯矿物的质量,g;ωFe为黄铁矿纯矿物中铁的质量分数,%。

1.2.2 氧化预处理浸出液中·OH 的测定
H2O2氧化预处理黄铁矿过程中,H2O2与Fe2+构成Fenton 试剂,Fenton 反应生成强氧化性的·OH,见反应式(3)。试验以性能较稳定的亚甲基蓝(MB)作为·OH 捕获剂,·OH 与MB 能够快速生成无色羟化亚甲基蓝(MB—OH),见反应式(4),采用分光光度法检测·OH 对MB 的降解情况,在反应时间内生成·OH 的浓度计算见式(5)。通过光谱扫描可知MB溶液在664 nm 具有最大的吸光度,因此·OH 测定波长设为664 nm,拟合工作曲线为y=0.184 6x-0.028 5,R2=0.999。

2 试验结果与讨论
2.1 黄铁矿氧化预处理机理分析
2.1.1 黄铁矿在不同体系中氧化预处理
在黄铁矿矿浆浓度10 g/L 条件下,不同氧化预处理体系对Fe 浸出率的影响如图2所示。黄铁矿在去离子水(H2O)中缓慢氧化生成FeSO4和H2SO4,FeSO4与H2O2反应又生成Fe2(SO4)3和H2O,同时黄铁矿与H2SO4反应再生成FeSO4和H2S2,氧化预处理120 min,Fe 浸出率仅有1.11%。黄铁矿在初始浓度0.12 mol/L 稀硫酸(H2O+H2SO4)中氧化过程亦是如此,H2SO4的加入使黄铁矿氧化速率小幅提升,氧化120 min,Fe 浸出率为5.61%。黄铁矿在初始浓度1.76 mol/L H2O2中Fe 浸出率为29.98%,在H2O2初始浓度1.76 mol/L 以及H2SO4初始浓度0.12 mol/L 的酸性过氧化氢(H2O2+H2SO4)中Fe 浸出率高达80.11%。较前2 个体系,后2 个体系中黄铁矿氧化效果明显较好,H2O2属于强氧化剂可以氧化黄铁矿,加入H2SO4使H2O2和Fe3+具有更强的氧化能力[13]。此外,H2O2与Fe2+组合为Fenton 试剂并发生反应生成具有强氧化性的·OH,并有O2、·O-2和·HO2等氧化性物质伴随着生成,黄铁矿在这些氧化剂共同作用下循环氧化。发生的反应见式(6)~式(16)。
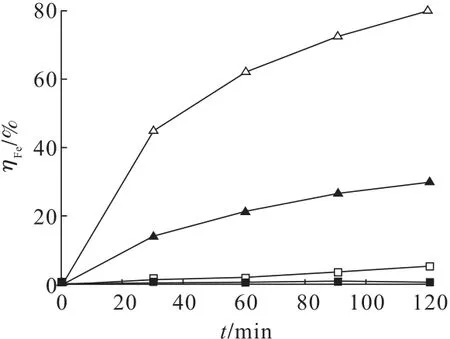
图2 不同体系对黄铁矿氧化预处理的影响Fig.2 Effects of different systems on pyrite oxidation pretreatment

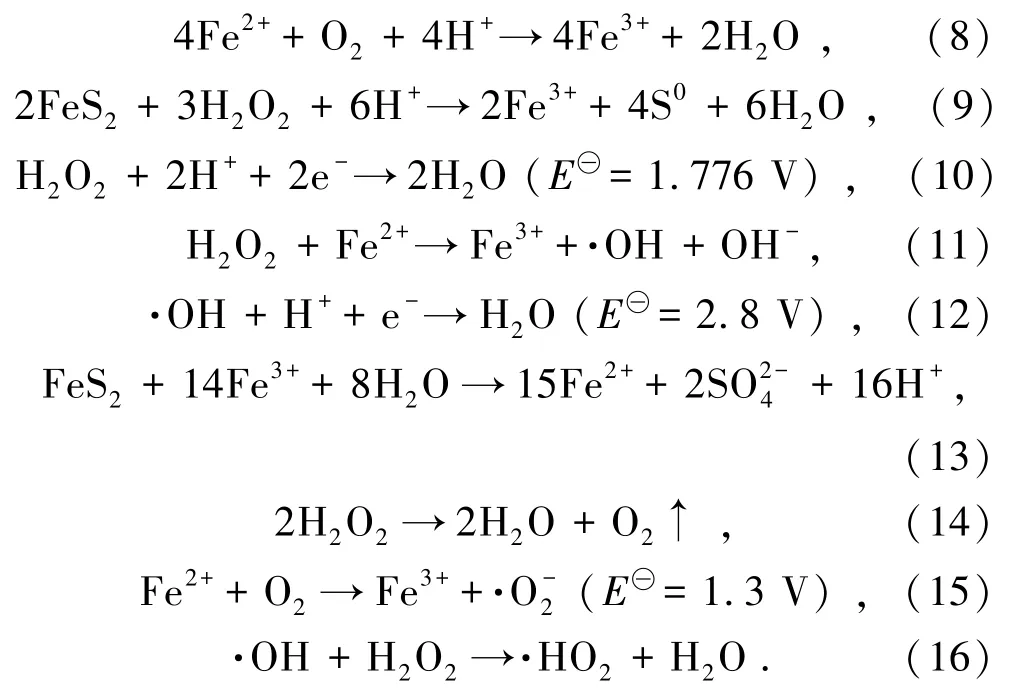
2.1.2 黄铁矿氧化预处理过程中Fe 离子浓度变化
分别测定了H2O2和H2O2+H2SO4体系中黄铁矿氧化预处理浸出过程中Fe2+和Fe3+浓度变化,结果如图3所示。在H2O2体系中,随着黄铁矿氧化浸出时间增加,浸出液中Fe2+和Fe3+浓度均持续升高,Fe2+浓度始终高于Fe3+浓度,当反应80 min 后Fe2+浓度开始下降,而Fe3+浓度仍持续增长;溶液中Fe 离子来自于黄铁矿氧化溶解,且Fe2+和Fe3+可相互转化,前80 min Fe2+生成速率大于Fe3+生成速率,黄铁矿氧化以H2O2和·OH 氧化为主;80 min 后,随着Fe2+和H2O2浓度逐渐降低,Fenton 反应新生成·OH 数量随之减少,Fe3+氧化黄铁矿逐渐替代H2O2和·OH 对黄铁矿的氧化。在H2O2+H2SO4体系中,Fe2+和Fe3+浓度同样随浸出时间延长而持续升高,相较于H2O2体系,H2O2+H2SO4体系中Fe3+浓度远大于Fe2+浓度;氧化120 min 时,2 个体系中Fe2+浓度相近;H2O2+H2SO4体系中黄铁矿氧化主要生成Fe3+。因此,H2O2+H2SO4体系中黄铁矿主要被酸性H2O2、Fe3+以及·OH 氧化。

图3 黄铁矿氧化浸出过程中Fe 离子浓度的变化Fig.3 Variation of Fe ion concentration during oxidation leaching of pyrite
2.1.3 黄铁矿氧化预处理过程中S 存在形态变化
为了探究H2O2和H2O2+H2SO4体系中黄铁矿氧化预处理浸出液中S 的存在形式,分别测定了氧化预处理浸出液中S2-、的含量。首先测定黄铁矿浸出液中S2-、含量,黄铁矿氧化预处理120 min 时取样过滤。在14 个50 mL 容量瓶中,依次加入20.00 mL KH2PO4-Na2HPO4缓冲溶液、0.50 mL EDTA 溶液、2.00 mL 碘标准溶液,并在两个体系中分别加入一定体积的浸出液,充分反应后加入3.00 mL 淀粉溶液,定容至刻度线并摇匀,显色10 min,加入浸出液体积对吸光度影响见表2。

表2 不同体积浸出液与碘-淀粉混合液的吸光度Table 2 Absorbance of different volumes of leaching solution and iodine starch mixture
当浸出液中存在S2-、或时,能使碘-淀粉溶液吸光度降低。由表2 可知,随着加入的浸出液体积增大,H2O2和H2O2+H2SO4体系吸光度均未减小,与没有加氧化预处理浸出液的碘-淀粉混合液吸光度大小相同(约为0.5)。因此,黄铁矿在H2O2和酸性H2O2氧化预处理过程中S 均未以S2-、和的形式进入溶液。由于H2O2+H2SO4体系中添加了H2SO4,因此仅测定H2O2体系下黄铁矿预处理浸出液中的含量。根据标准GB 13580.2计算黄铁矿在H2O2体系中氧化预处理浸出的浓度随时间的变化关系,如图4所示。浓度随氧化预处理时间增大而升高,氧化预处理120 min,浓度为665 μg/mL。综上,黄铁矿在H2O2氧化预处理过程中生成了H2SO4,黄铁矿中S 以形式存在于溶液中。

图4 H2O2 氧化预处理体系中浓度与时间的关系Fig.4 Relationship between concentration and time in H2O2 oxidation pretreatment system
2.1.4 不同氧化预处理体系中·OH 浓度测定
根据1.2.2 中试验方法测定黄铁矿氧化预处理浸出过程中·OH 浓度变化情况,在H2O2初始浓度0.88 mol/L、H2SO4初始浓度0.12 mol/L和矿浆浓度5 g/L 的条件下,分别探究了8.10 mg/L 的MB 溶液在H2O2、H2O2+H2SO4、H2O+H2SO4、H2O+FeS2、H2O2+FeS2及H2O2+FeS2+H2SO4体系中的降解情况,结果如图5所示。

图5 不同氧化预处理体系降解MB 情况及生成·OH 浓度Fig.5 Degradation of MB and concentration of generated ·OH in oxidation pretreatment system
由图5(a)可知,经过30 min 的降解,MB 在H2O+FeS2、H2O+H2SO4、H2O2和H2O2+H2SO4体系中的浓度分别为8.00、7.86、7.66和6.176 mg/L,MB 浓度分别降低了0.10、0.24、0.48和1.93 mg/L,MB 并未得到有效降解,原因是这4 个系统中并未同时存在Fenton 试剂(Fe2+和H2O2),没有发生Fenton 反应,上述体系中均未生成·OH(如图5(b)),因此不能有效地氧化降解MB。由图5(c)可知,经过10 min 的降解,MB 在H2O2+FeS2和H2O2+FeS2+H2SO4体系中的浓度分别为0.45、2.09 mg/L,MB 浓度分别降低了7.65和6.01 mg/L;与图5(a)中4 个体系相比,图5(c)中MB 的降解效果得以显著提升,由于这2 个体系中均满足Fenton 反应发生的条件,Fenton 反应产生的·OH 与MB 生成无色的MB-OH(如图5(d))。另外,图5(c)中H2O2+FeS2体系中MB 的降解效果优于H2O2+FeS2+H2SO4体系,表明加入H2SO4在一定程度上抑制了MB 的降解,因为H2SO4的加入使体系中的Fe2+浓度降低,Fenton 反应受到抑制。
2.1.5 黄铁矿氧化预处理前后XPS 分析
黄铁矿在H2O2+H2SO4体系中具有较高的氧化浸出率,对该体系中黄铁矿氧化渣进行XPS 分析,结果如图6所示。
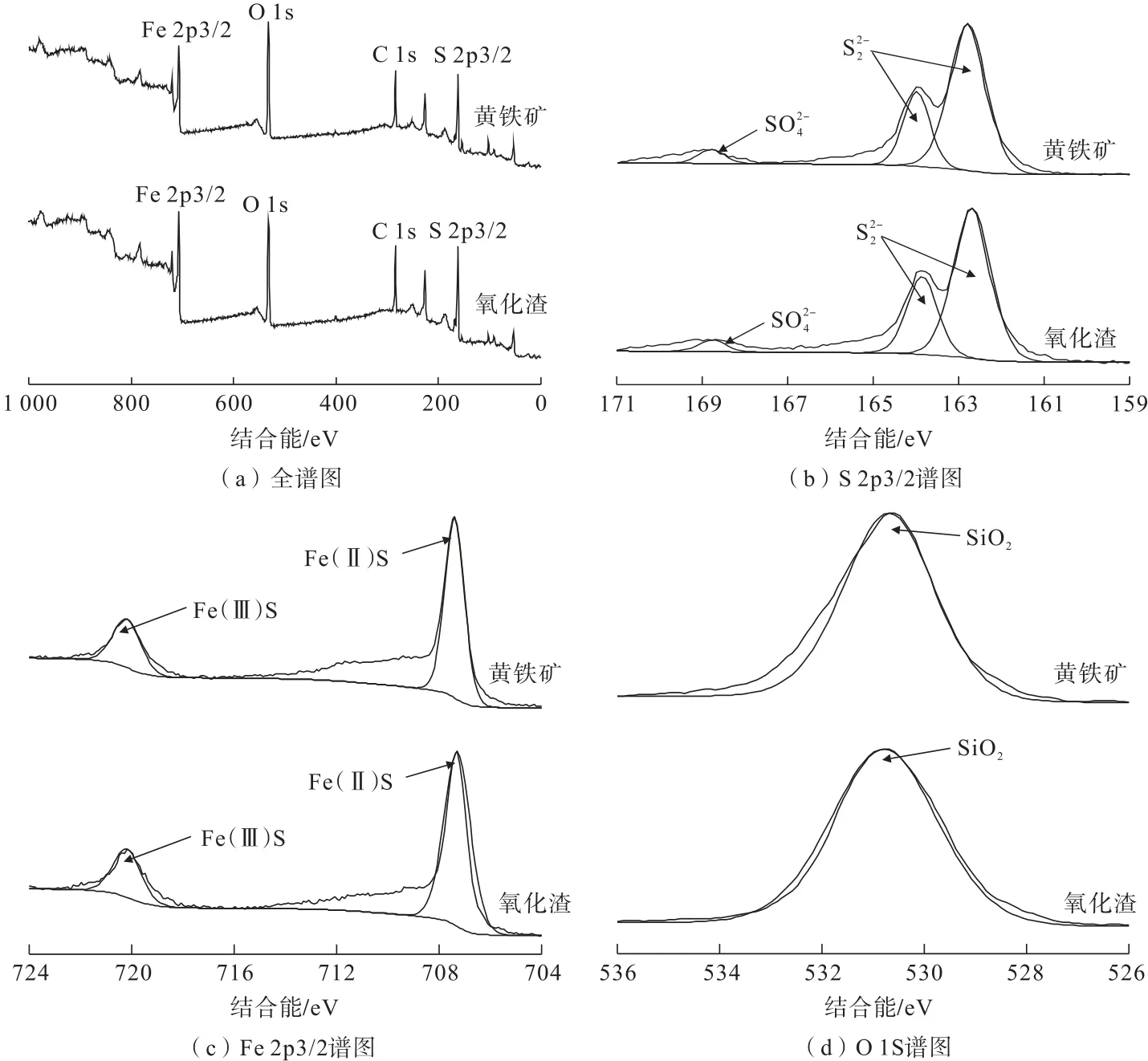
图6 黄铁矿及其氧化预处理渣XPS 谱图Fig.6 XPS spectra of pyrite and its oxidized slag
由图6 可知,黄铁矿及氧化渣均在结合能为708、532、284和163 eV 处出现光谱峰,分别为Fe 2p3/2、O 1s、C 1s和S 2p3/2 光电子能谱特征峰。为了探究黄铁矿及氧化渣表面的元素特征,对Fe 2p3/2、S 2p3/2和O 1s 进行了分峰拟合。
由图6(b)可知,分峰拟合后黄铁矿及氧化渣中的S 2p3/2 均在结合能162.6、164.0和168.3 eV 处出现特征峰,其中结合能162.6 eV 处峰面积最大,此处结合能对应的物质为黄铁矿,虽然黄铁矿在氧化体系中溶解,但其氧化渣的主要成分仍然是黄铁矿,并没有生成其他固相物质,这与XRD 分析结果吻合。S 2p3/2 谱图在结合能164.0 eV 处出现特征峰,推测氧化渣表面覆盖有、S0或两者均存在[14-15],文献表明、S0在同一体系中可以互相转化[16-17],但S0亦可在酸性H2O2溶液中溶解,因此,164.0 eV 处出现的特征峰主要是产生的。在结合能168.3 eV处出现较小特征峰,主要是氧化渣表面覆盖的产生的[15,18]。图6(c)是黄铁矿及氧化渣Fe 2p3/2的分峰拟合,氧化预处理浸出前后Fe 2p3/2 谱图极其相似,拟合峰结合能主要出现在707.2和719.9 eV处,前者主要是黄铁矿结构中Fe和S 形成Fe(Ⅱ)S产生的,后者主要由Fe(Ⅲ)S 产生[18]。由O 1s 的分峰拟合图可知(图6(d)),拟合峰结合能出现在530.7 eV 处,该处峰由SiO2产生,说明黄铁矿纯矿物中含有石英。其主要反应式见式(17)~式(19)。

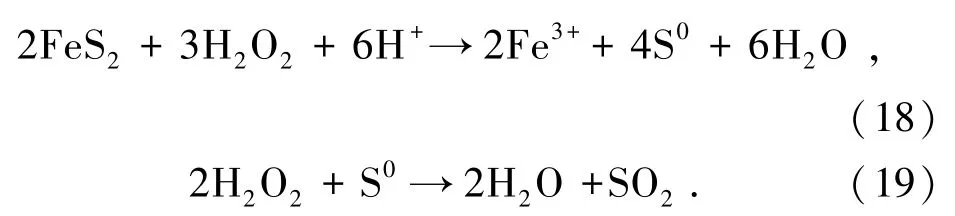
2.1.6 黄铁矿氧化预处理前后XRD 分析
对黄铁矿以及H2O2、H2O2+H2SO4体系氧化预处理黄铁矿60 min 后的氧化渣进行了XRD 分析,结果如图7所示。2 个体系的氧化渣中均只检测到黄铁矿和杂质石英晶型特征峰,并未检测到其他固相生成物的特征峰。黄铁矿氧化过程中会生成较多Fe3+,Fe3+具有很强的水解能力并生成FeOOH 或Fe(OH)3,见反应式(20)和(21)。由2.1.3 可知体系中还存在大量的,而在实际矿山环境中,Fe3+易发生反应生成KFe3(SO4)2(OH)6,见反应式(22)。KFe3(SO4)2(OH)6是矿山废水中常见的二次矿物[19],但在氧化预处理渣中未检测到FeOOH、Fe(OH)3和KFe3(SO4)2(OH)6等水解产物的特征峰,由于黄铁矿氧化预处理后使体系呈酸性,一方面,酸(H+)能够抑制Fe3+水解,使反应(20)和(21)不能朝正向进行;另外,Fe3+水解生成热力学不稳定的FeOOH,而且酸性体系中水电离受到抑制,导致OH-浓度较低。通过XRD 半定量分析,H2O2体系下氧化渣中黄铁矿含量为85.6%、石英为14.4%,而H2O2+H2SO4体系下氧化渣中黄铁矿含量为78.9%、石英为21.1%。结果表明氧化渣中黄铁矿含量低于浸出前的,而石英含量升高,且H2O2+H2SO4体系氧化预处理黄铁矿效果优于H2O2体系,说明酸性H2O2体系能有效氧化黄铁矿。
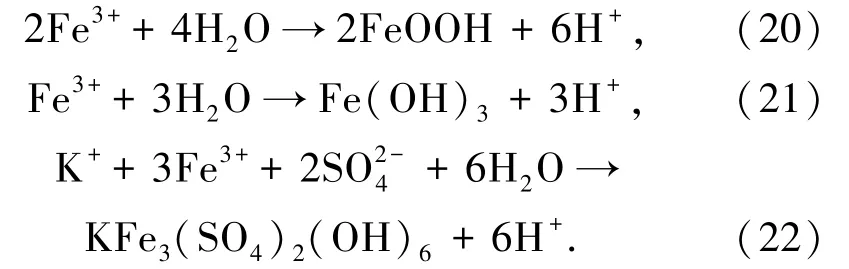
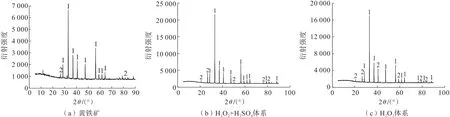
图7 黄铁矿及其氧化渣的XRD 谱图Fig.7 XRD spectra of pyrite and its oxidized slag
2.1.7 黄铁矿氧化预处理过程E-pH 分析
金属在水溶液氧化腐蚀过程中,平衡电位与溶液pH 值关系分为3 种类型:仅与电极电位有关(只有电子交换)、仅与溶液pH 值有关(无电子参与反应)或与两者均有关。H2O2+FeS2体系中氧化预处理过程可能存在物质的标准生成吉布斯自由能(ΔrG⊖)如表3所示[20]。
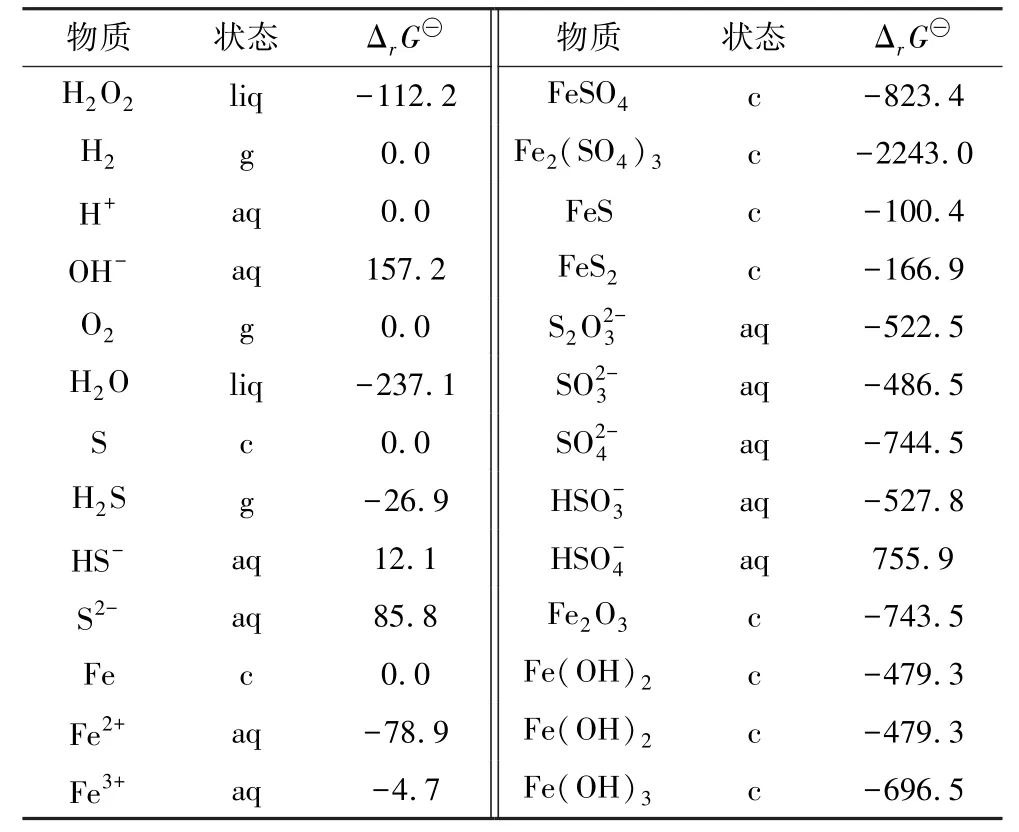
表3 H2O2+FeS2 体系中各物质状态以及ΔrG⊖值Table 3 States of substances in H2O2 + FeS2 system and ΔrG⊖value kJ/mol
湿法冶金反应过程可用通式(23)表示[21]:

当反应只有电子交换且与pH 值无关时,m=0;反应只与pH 值有关而与电位无关时,Z=0。根据电化学与热力学之间的关系:
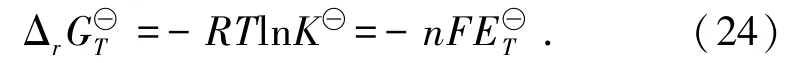
根据能斯特方程式(24)可简化为:

在常温常压下,设各离子的活度系数为1,将T=298.15 K 代入H2O2+FeS2体系中各反应的E-pH 计算式。其中:

根据表3 及式(25)计算,即可绘制出H2O2+FeS2体系的E-pH 图,如图8所示。黄铁矿在酸性H2O2溶液中可以被氧化溶解,在氧化过程中若要生成S0,则黄铁矿应处于酸度极强的溶液环境中,并且S0稳定区域很小。在黄铁矿氧化渣的XPS和XRD 表征分析中并未检测到S0,尽管黄铁矿氧化属于产酸反应,但其生成酸不足以使体系达到生成S0的酸度,因此黄铁矿氧化初期S 以SO2-4 形式稳定存在于溶液中,随着反应的进行,当体系pH<2 时,S 将以形式存在于溶液中。在H2O2体系中Fe2+浓度高于Fe3+,原因是H2O2体系酸度未达到Fe3+稳定存在的强度。而在H2O2+H2SO4体系中,由于H2SO4的加入使溶液酸度大幅度增强,氧化还原电位也有所升高(E⊖=1.776 V),Fe3+可以稳定存在于溶液中且浓度大于Fe2+浓度。在H2O2+H2SO4体系中E和Fe3+浓度均高于H2O2体系,因此黄铁矿在H2O2+H2SO4体系中Fe 浸出率高于H2O2体系。此外,当体系处于微酸或碱性环境时,黄铁矿溶解的Fe3+将发生水解生成Fe(OH)3沉淀,而浸金需要在碱性环境中完成。因此,建议含金矿石氧化预处理后应进行脱水,其脱出的水在氧化预处理系统中循环使用,降低预处理中H2SO4用量,同时也减少铁离子进入浸金作业,避免了后续浸金过程对碱的过度消耗或减少浸金剂的用量。
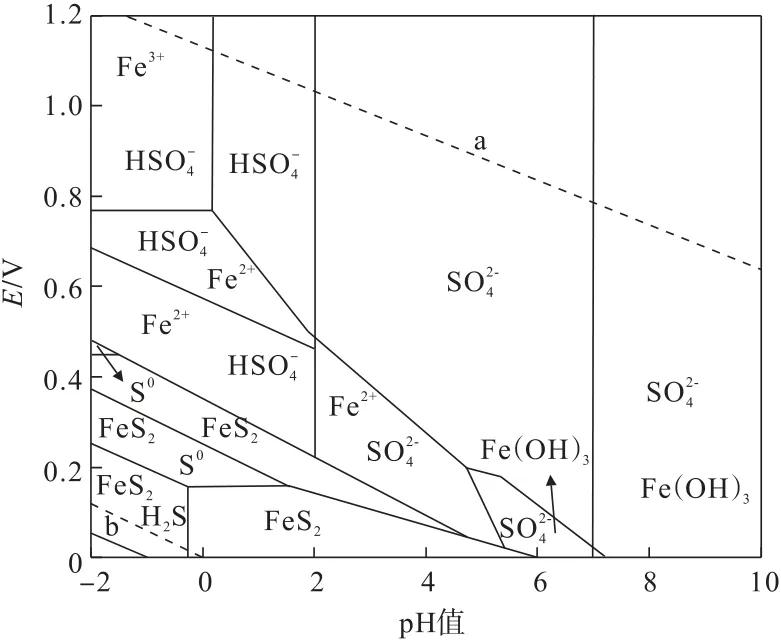
图8 H2O2+FeS2 体系中E-pH 图Fig.8 E-pH diagram of H2O2+FeS2 system
2.2 浮选金精矿氧化预处理条件试验
在浮选金精矿粒度0.075 ~0.045 mm、搅拌速度500 r/min和氧化预处理时间2 h 的条件下,考察H2O2体系中氧化预处理温度、矿浆浓度、H2SO4初始浓度以及H2O2初始浓度对浮选金精矿预处理效果的影响。
2.2.1 氧化预处理温度试验
H2O2初始浓度1.76 mol/L、H2SO4初始浓度0.12 mol/L和矿浆浓度100 g/L,探究氧化预处理温度对浮选金精矿氧化预处理效果的影响,结果如图9所示。随着氧化预处理温度的升高,Fe 浸出率和试样失重率均先增加后降低,适当升高温度有利于H2O2与浮选金精矿中黄铁矿发生氧化还原反应,但随着氧化预处理温度升高(>30 ℃),H2O2分解速率逐渐加快,氧化预处理效果有所下降。当氧化预处理温度在10 ~30 ℃时,Fe 浸出率和试样失重率分别为65.73%~85.26%和27.65%~40.02%。

图9 温度对浮选金精矿浸出率及失重率的影响Fig.9 Influence curve of temperature on leaching rate and weight loss rate of gold concentrate
2.2.2 矿浆浓度试验
在H2O2初始浓度1.76 mol/L、H2SO4初始浓度0.12 mol/L和氧化预处理温度20 ℃条件下,探究矿浆浓度对浮选金精矿氧化预处理效果的影响,结果如图10所示。
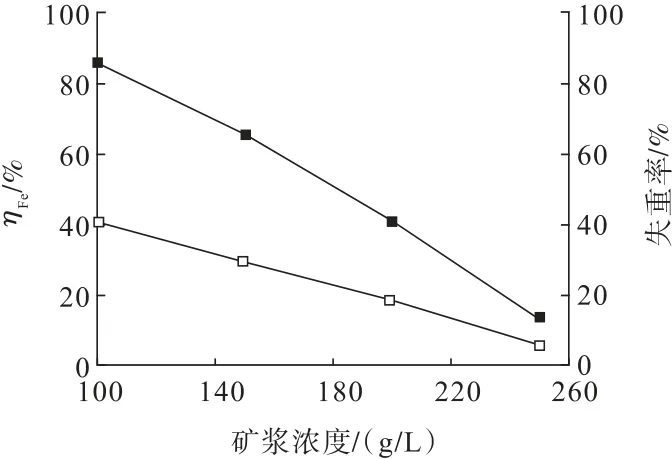
图10 矿浆浓度对浮选金精矿浸出率及失重率的影响Fig.10 Influence curve of pulp concentration on leaching rate and weight loss rate of gold concentrate
从图10 可以看出,随着矿浆浓度的增加,浮选金精矿中Fe 浸出率和试样失重率均随之降低。当矿浆浓度为100 g/L 时,Fe 浸出率和试样失重率分别为85.76%和40.37%;当矿浆浓度升至250 g/L 时,Fe浸出率和试样失重率分别降至12.81%和5.55%。
2.2.3 H2SO4 初始浓度试验
在H2O2初始浓度1.76 mol/L、氧化预处理温度20 ℃和矿浆浓度100 g/L 条件下,探究H2SO4初始浓度对浮选金精矿氧化预处理效果的影响,结果如图11所示。

图11 H2SO4 初始浓度对浮选金精矿浸出率及失重率的影响Fig.11 Influence curve of initial concentration of H2SO4 on leaching rate and weight loss rate of gold concentrate
从图11 可以看出,随着H2SO4初始浓度的增加,Fe浸出率和试样失重率均随之增加。当H2SO4初始浓度为0.03 mol/L 时,Fe 浸出率和试样失重率分别为15.50%和5.11%;当H2SO4浓度升至0.18 mol/L 时,Fe 浸出率和试样失重率分别增至89.34%和41.39%。
2.2.4 H2O2 初始浓度试验
在氧化预处理温度20 ℃、矿浆浓度100 g/L和H2SO4初始浓度0.12 mol/L 条件下,探究H2O2初始浓度对浮选金精矿预处理效果的影响,结果如图12所示。

图12 H2O2 初始浓度对浮选金精矿浸出率及失重率的影响Fig.12 Effect of initial concentration of H2O2 on leaching rate and weight loss rate of gold concentrate
从图12 可以看出,随着H2O2初始浓度的增加,Fe 浸出率和试样失重率均随之增加。当H2O2初始浓度为0.44 mol/L 时,Fe 浸出率和试样失重率分别为19.25%和9.67%;当矿浆浓度升至1.77 mol/L时,Fe 浸出率和试样失重率分别升至83.75%和38.88%。
2.2.5 正交试验
为了提高浮选金精矿氧化预处理效果,进行了浮选金精矿氧化预处理正交试验。以温度、矿浆浓度、H2SO4初始浓度、H2O2初始浓度为考察因素(依次为因素A、B、C、D),每个因素各取3 个水平,采用正交表安排试验。在浮选金精矿氧化预处理过程中,Fe浸出率与试样失重率具有相同的变化趋势,因此,采用Fe 浸出率评价浮选金精矿的预处理效果。正交试验因素水平表见表4,试验结果列于表5。

表4 正交试验的因素与水平表Table 4 Factors and levels of orthogonal trial
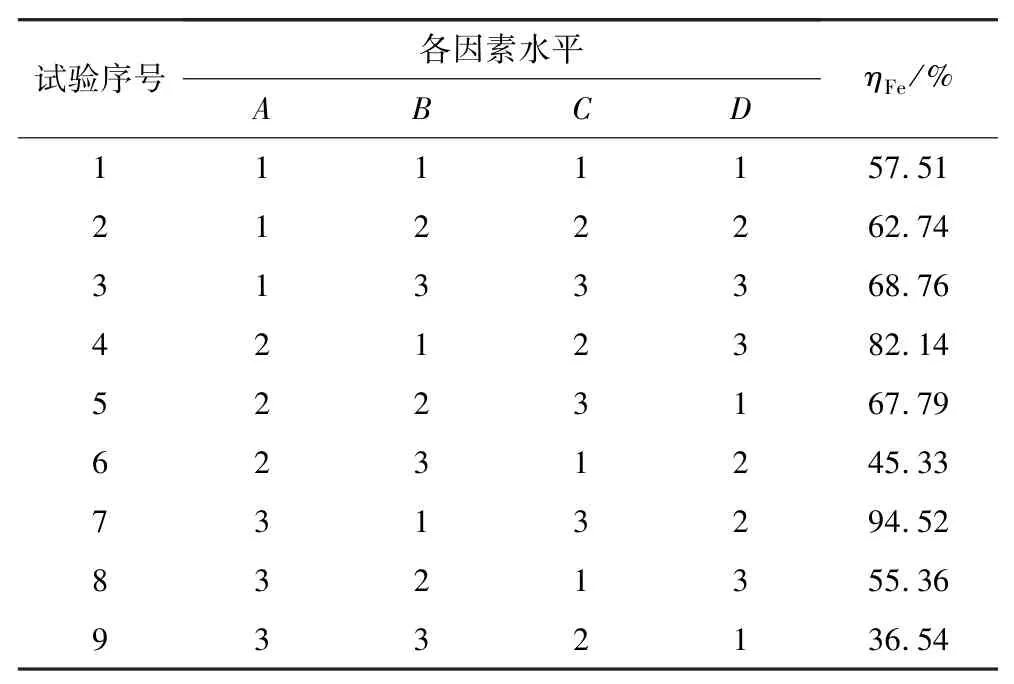
表5 正交试验结果Table 5 Orthogonal trial results
极差R表示对应影响因素对氧化预处理的影响程度。对表5 结果进行极差分析,结果见表6。
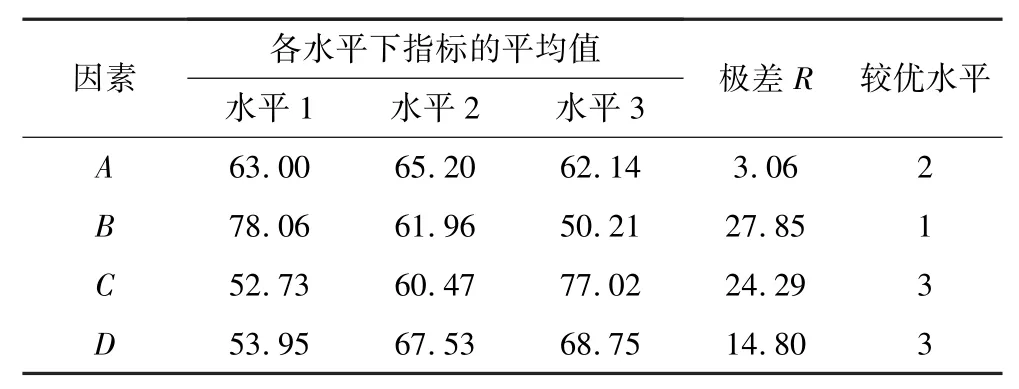
表6 正交极差分析结果Table 6 Orthogonal trial range analysis results
由表6 可知,各因素对浮选金精矿氧化预处理中Fe 浸出率影响显著程度为B>C>D>A。A2B1C3D3为较优水平组合。按照A2B1C3D3组合条件对浮选金精矿进行氧化预处理试验,获得的浮选金精矿Fe 浸出率为95.33%,试样失重率为51.42%。
在温度30℃,矿浆浓度10%,H2SO4和H2O2初始浓度分别为0.18、1.76 mol/L 的条件下,对浮选金精矿进行氧化预处理2 h 后,再加入10 kg/t 的NaOH、10 kg/t 的浸金剂浸出2 h,获得的金浸出率为92.69%,而未经预处理的浮选金精矿中金浸出率仅有11.68%。浮选金精矿经过酸性H2O2氧化预处理可大幅度提高金回收率,因此,酸性H2O2体系是一种有效的难选金矿氧化预处理方法。
3 结 论
(1)黄铁矿氧化预处理浸出液中Fe 离子浓度随着反应进行而增高,H2O2氧化预处理体系中Fe2+浓度高于Fe3+,H2O2+H2SO4氧化预处理体系中Fe3+浓度高于Fe2+;Fe2+与H2O2发生Fenton 反应生成了·OH,黄铁矿被酸性H2O2、Fe3+和·OH 等共同氧化;H2O2氧化预处理体系中S 以SO2-4 形式存在,H2O2+H2SO4氧化预处理体系中S 以或的形式存在。黄铁矿氧化预处理渣XPS和XRD 分析表明:氧化预处理渣中主要成分仍是黄铁矿与少量石英,较未氧化前,氧化预处理渣中黄铁矿含量降低,石英含量升高,氧化预处理体系中没有其他固相物生成。E-pH 图解释了Fe和S 在氧化预处理体系中的存在形式。
(2)酸性H2O2氧化预处理浮选金精矿试验结果表明:浮选金精矿中Fe 浸出率、试样失重率与H2O2初始浓度、H2SO4初始浓呈正相关,与矿浆浓度呈负相关,随着预处理温度升高,浮选金精矿中Fe 浸出率和试样失重率也随之升高,但随着温度升高,H2O2分解速率加快,H2O2浓度降低,浮选金精矿中Fe 浸出率和试样失重率随之降低。
(3)正交试验得出浮选金精矿氧化预处理最优条件为:温度30 ℃、矿浆浓度10%、H2SO4初始浓度0.18 mol/L 以及H2O2初始浓度1.76 mol/L,在最优的氧化预处理条件下浮选金精矿Fe 浸出率为95.33%、试样失重率为51.42%。浮选金精矿经最优条件氧化预处理后进行非氰化浸出,金浸出率达到92.69%,未经氧化预处理的浮选金精矿浸出率仅有11.68%。酸性H2O2氧化法是一种有效的难选金矿预处理方法。

