光环境下Irgarol 1051与紫外辐射对不同粒径硅藻光系统Ⅱ的耦合效应
丁佩建, 曹黎鑫, 贾 非, 徐军田, 吴亚平
光环境下Irgarol 1051与紫外辐射对不同粒径硅藻光系统Ⅱ的耦合效应
丁佩建, 曹黎鑫, 贾 非, 徐军田, 吴亚平
(江苏海洋大学 海洋科学与水产学院, 江苏 连云港 222005)
Irgarol 1051是一种常见的船舶防污剂, 主要作用于光系统Ⅱ来抑制藻类在船舶表面的生长。本研究通过模拟原位海洋环境, 在考虑阳光紫外辐射的基础上, 于室外培养了3种不同粒径的硅藻, 光系统Ⅱ初始光化学效率QY均介于0.60~0.70, 表明藻细胞活性良好。在短期实验中加入Irgarol后, 发现较低质量浓度(0.2 μg/L)已经显著抑制了硅藻光系统Ⅱ的活性, 浓度升高后抑制效应随之升高, QY降至0.32左右, 相对抑制率最高可达42%。通过比较分析不同光学处理下硅藻的响应, 微弱的紫外辐射对3种硅藻光系统Ⅱ的抑制率很低, 最高约为5%左右, 而对于粒径最大的斑点海链藻基本不受影响。当在有Irgarol存在的情况下, 紫外辐射抑制率明显升高, 且粒径越小抑制率越大, 最高约为10%。表明二者即使在低剂量情况下也会发生协同作用, 这对真光层低光区域浮游植物群落的粒径结构和初级生产过程有潜在影响。
硅藻; Irgarol 1051; 光合作用; 紫外辐射
自2008年国际上全面禁止三丁基锡(TBT)以来, Irgarol 1051(2-methylthio-4-tert-butylamino-6-cyclopropylamino-s-triazine)的使用量连年增加[1]。尽管Irgarol 1051(以下简称Irgarol) 在海水中的溶解度很低, 但根据国际标准化组织(ISO)的评估体系, Irgarol仍会以大约5.0 μg/(cm2·d)的速率从防污涂漆中渗透到海洋环境中[2]。近海, 特别是航运发达的区域, 其质量浓度可高达4.2 μg/L, 远超其对光合生物的效应浓度[3]。已有的研究表明, Irgarol在20 ng/L即对浮游植物产生明显抑制作用[4]。除了独立效应之外, Irgarol还会与其他因子发生交互作用, 对藻类植物产生复合效应。同时添加Irgarol与苯脲类化合物, 对浮游植物及大型海藻光合活性抑制呈现叠加效应[5]。然而在考虑理化因子情况下, 如温度、盐度升高后, 则显现出协同效应, 使Irgarol对浮游植物的毒性显著增强[6]。最新研究显示, Irgarol还会抑制大型海藻石莼()的光保护机制, 使之更易受酸化影响[7]。因此作为当前海洋环境的一类重要有机污染物, Irgarol偏向于和其他物理性因子发生耦合作用。
海洋中初级生产者主要为浮游植物, 它们利用阳光驱动光合作用为生态系统源源不断地提供有机物。阳光光谱范围很广, 其中光合有效辐射(PAR)指的是太阳辐射中400~700 nm的光谱, 可被光合生物有效利用进行光合作用, 到达地球表面的紫外辐射(UVR)范围为280~400 nm[8], 其中可分为UV-A (Ultraviolet radiation A, 320~400 nm)和UV-B (Ultraviolet radiation B, 280~320 nm)。自1998年联合国环境署评估报告发表至今, 关于UVR持续开展的许多研究结果表明从1970年左右到20世纪末大气臭氧量和UV-B之间呈反比关系[8, 9], 在北纬中纬度地区, 1997年—2000年间的臭氧层损失较1980年上升约6%, 这会导致UV-B值增加12%[10]。以往的研究发现, UVR可以抑制藻类的生长及光合固碳, 同时对藻类细胞的结构以及DNA造成损伤, 然而在低剂量情况下UVR也会表现出正面效应, 对浮游植物固碳起到促进作用[11]。
海洋浮游植物不仅是海洋食物网的基础, 也是生物碳泵的主要驱动因素, 对海洋生物地球化学循环有着重要影响[12], 硅藻(Diatom)在此过程中扮演着核心角色, 因为它们是当今海洋中最主要的初级生产者之一, 贡献了海洋初级生产力的40%[13, 14]。特别在近海海域, 硅藻经常在浮游植物群落占据绝对优势。因此, 硅藻对近海多重环境压力的响应会直接影响到近海初级生产过程, 具有极其重要的意义[15]。在复杂的浮游植物群落中, 硅藻的细胞粒径差异最大, 从几微米到几百微米不等, 比其他主要浮游植物如甲藻(Diatom)、颗石藻(Coccolithophores)等的范围更广[16], 不同细胞粒径的硅藻对UVR的生理响应不同[17-18]。前期研究表明硅藻细胞粒径是决定UVR对浮游硅藻损害程度的关键因素之一, 一般来说细胞越小影响更大[19], 室内研究即表明, UVR对不同粒径硅藻的抑制率与细胞粒径成负相关[20]。
鉴于近海区域同时受全球及区域性环境变化的影响, 浮游植物的响应与适应将是海洋生态系统正常运转的关键影响因素。为此, 本研究选取了3种硅藻, 通过模拟弱光环境, 以期探讨防污剂Irgarol与低剂量UVR对硅藻光合作用的耦合效应及与粒径的关系。
1 材料和方法
1.1 藻种的活化和预培养
实验开始于2019年7月, 选取3种不同粒径的硅藻, 分别为假微型海链藻()(直径约4 μm)、威氏海链藻()(直径约14 μm)和斑点海链藻()(直径约50 μm)。将藻细胞预接种到聚碳酸酯培养瓶中并加入500 mL灭菌天然海水(盐度31‰, F/2培养基加富), 然后置于室外恒温水槽中, 温度控制在20±1 ℃(森森集团股份有限公司, HYH-2DR-B)。为了避免过高阳光的直射, 在培养瓶上方盖3层遮光网。藻液每24 h用新鲜培养基稀释1次, 大约留30%的藻液, 然后加入新鲜海水至500 mL, 使细胞保持在指数生长期, 培养瓶每天手动摇晃3次并随机放置于水槽中。预培养周期取决于硅藻的生长速率, 即保证每一种硅藻适应8代以上。由于半连续培养下硅藻一直处于指数生长期, 所以不同日期所取样品都具有一致的生理状态和可比性。
1.2 实验试剂和实验设置
称量Irgarol 溶于DMSO(二甲基亚砜)中, 定容至最终质量浓度为0.1 mg/mL作为母液。实验根据预培养所需时间, 依次以假微型海链藻、威氏海链藻和斑点海链藻分3批次进行实验, 预实验显示, 5%体积比的DMSO对3种硅藻的光合活性没有显著影响。正式实验开始前, 将预培养的硅藻分装至18只40 mL 石英管中, 并在(20±1)℃条件下黑暗处理15 min后取2 mL藻液, 使用AquaPen叶绿素荧光仪(AP-C 100, PSI, 捷克)测量其最大光化学效率(F/F), 然后立即置于室外水浴槽中。石英管中的样品同时还进行如下光学处理: (1)PAB组(PAR+UVR), 在石英管上方加盖ZJB280滤光板; (2)PAR组, 在石英管上方加盖ZJB400滤光板。为了模拟硅藻处于弱光层环境中, 在滤光板上方遮盖5层遮光网, 光强约为2 780 Lux。接着加入Irgarol 母液使每组的最终浓度控制在0、0.2 或0.4 μg/L。以上处理一共6组, 分别为PAR-0、PAR-0.2、PAR-0.4、PAB-0、PAB-0.2和PAB-0.4, 每组设3个平行(表1)。之后立即在第0、9、18、27、36、48、60、75、90、105、120分钟时测量其有效光化学效率(F′/F′)。
表1 不同处理组对应的环境变量

Tab.1 Environmental variables corresponding to different treatments
1.3 叶绿素荧光测定
硅藻细胞经过处理后, 使用叶绿素荧光仪测定其光系统Ⅱ的光化学效率(Quantum Yield, QY)。表达式为:
F/F=(F–F)/F, (最大光化学效率),
F′/F′ =(F′–F)/F′(有效光化学效率),
其中,F表示藻细胞暗适应的最大荧光值,F′表示光照情况下最大荧光值,F是用调制测量光测量的最小荧光(0.1 μmoL photons m−2s−1)。
1.4 数据处理和分析
运用SPSS 22(IBM, 美国)对实验数据进行双因素方差分析(Two-way ANOVA)、检验(-test), 显著性水平设为<0.05。所得数据以平均值±标准偏差表示。
根据下式, 计算UVR和Irgarol分别对光化学效率的相对抑制作用:
紫外相对抑制率= (PAR−PAB)/PAR×100%,
Irgarol相对抑制率= (C−I)/C×100%,
其中,PAR和PAB分别表示PAR和PAB处理下的光化学效率,C和I分别表示对照组和不同Irgarol浓度处理下的光化学效率。
2 结果
2.1 Irgarol和阳光辐射对3种硅藻光系统Ⅱ的影响
实验期间水槽温度维持在(20±1)℃, 假微型海链藻暴露光强范围为1 279~4 003 Lux(图1a); 威氏海链藻暴露光强范围为2 502~4 448 Lux (图1b); 斑点海链藻暴露光强范围为1 279~3 002 Lux (图1c)。实验结果表明总体上3种硅藻对Irgarol高度敏感, 在经过120 min阳光辐射和Irgarol暴露处理之后,F′/F′值显著降低, 当暴露于更高浓度Irgarol下时,F′/F′进一步降低。对于假微型海链藻, PAR-0组和PAB-0组F′/F′值随着时间增加而缓慢升高, PAB-0组F′/F′值总体显著低于PAR-0组; PAR-0.2组和PAB-0.2组在暴露的27 min内,F′/F′值分别急剧降低至初始值的65%和58%并在36~120 min时分别缓慢降低至初始值的60%和55%, PAB-0.2组F′/F′值低于PAR-0.2组, 差异性显著(图1a); PAR-0.4组和PAB-0.4组在0~36 min时F′/F′值分别急剧降低初始值的57%和51%, 并在36~120 min时趋于平缓最终分别达到初始值的53%和48%, PAB-0.4组F′/F′值明显低于PAR-0.4组, 差异性显著, 表明UVR加剧了Irgarol对假微型海链藻光系统Ⅱ的抑制效应; 对于威氏海链藻, 其趋势与假微型海链藻的结果相似(图1b); 而在斑点海链藻的结果中, PAR-0组和PAB-0组中F′/F′值趋于稳定, PAR-0.2和PAB-0.2组中F′/F′值在0~75 min时分别逐渐降低至初始值的70%和62%, 在75~120 min时趋于平稳; PAR-0.4和PAB-0.4组中F′/F′值在0~36 min时分别急剧降低至初始值的61%和59%, 在48~120 min时趋于稳定于62%和61% (图1c)。无Irgarol处理的斑点海链藻F′/F′在PAB和PAR下无显著差异, 而加入Irgarol后, 在某些时间点, 特别是PAB-0.4处理组,F′/F′显著低于PAB-0处理组。
注: 竖线代表标准偏差,=3(图2、图3同)
2.2 PSⅡ的相对抑制率
2.2.1 PAR下Irgarol对硅藻PSⅡ的相对抑制率
实验期间, 对于假微型海链藻, Irgarol质量浓度为0.2 μg/L时, 其相对抑制率开始时随着时间增加而提高,在36~120 min之间逐渐平稳, 最高抑制率为30%; Irgarol质量浓度为0.4 μg/L时, 相对抑制率随着时间增加而提高, 在36~120 min之间逐渐平缓。在各时间段, 其相对抑制率均高于质量浓度为0.2 μg/L时的相对抑制率, 最高抑制率为37% (图2a)。对于威氏海链藻, 趋势与假微型海链藻相似, Irgarol质量浓度为0.4 μg/L时的相对抑制率均高于质量浓度为0.2 μg/L时的相对抑制率, 低浓度Irgarol条件下最高抑制率为23%, 而在高浓度下为35%。与假微型海链藻不同之处是在75 min后, 相对抑制率逐渐降低(图2b)。对于斑点海链藻, 低浓度Irgarol条件下最高抑制率为23%, 而在高浓度下为32% (图2c)。以上结果表明, 在PAR条件下, Irgarol对3种硅藻的抑制效应随着处理时间及Irgarol质量浓度的升高而升高。
2.2.2 PAB下Irgarol对硅藻PSⅡ的相对抑制率
在PAB处理下, 对于假微型海链藻, 相对抑制率随着时间增加而提高, Irgarol质量浓度为0.2 μg/L时, 最高抑制率为36%, Irgarol质量浓度为0.4 μg/L时, 最高抑制率为43% (图3a)。对于威氏海链藻, 在0~75 min之间, 相对抑制率逐渐升高并在75~120 min之间逐渐降低, Irgarol质量浓度为0.2 μg/L时, 最高抑制率为25%, Irgarol质量浓度为0.4 μg/L时, 最高抑制率为35% (图3b)。对于斑点海链藻, 在0~48 min时, 相对抑制率随着时间增加而升高, 并在48~120 min之间保持稳定, Irgarol质量浓度为0.2 μg/L时, 最高抑制率为23%, Irgarol质量浓度为0.4 μg/L时, 最高抑制率为31% (图3c)。
2.2.3 UVR对硅藻PSⅡ的相对抑制率
由于弱光下UVR相对抑制率较低, 同时光强的波动影响较大, 因此本文将整个实验期间的UVR抑制率以平均值表示。总体上来说, 无Irgarol时UVR引起的相对抑制率对假微型海链藻约为5%, 高于另外两种硅藻, 而对粒径最大的斑点海链藻, 相对抑制率基本接近0, 即UVR对该3种硅藻的抑制率与细胞粒径成反比(图4a)。对于不同Irgarol质量浓度处理, 质量浓度为0.2 μg/L时, UVR相对抑制率有所升高(图4b), 质量浓度为0.4 μg/L时, UVR对不同粒径硅藻的抑制效应均显著高于对照组1倍以上(图4c)。
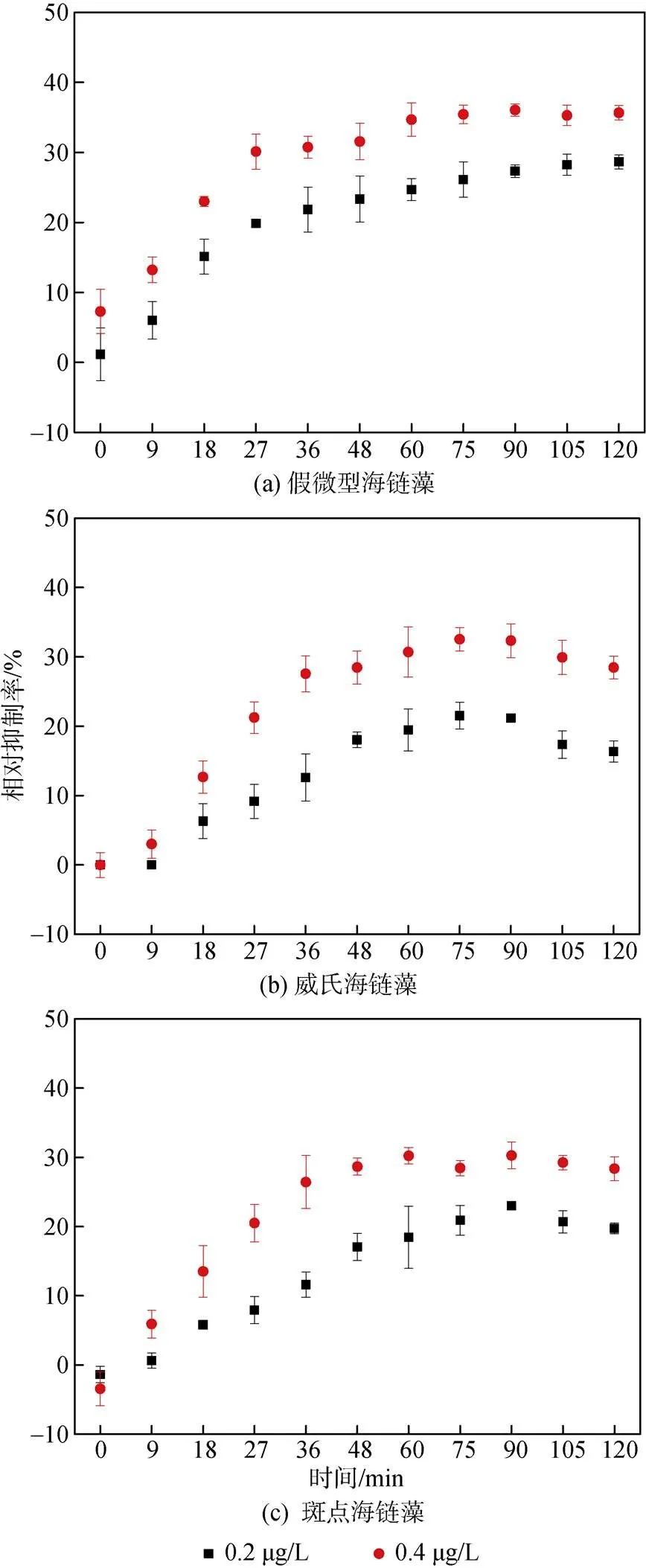
图2 PAR条件下不同质量浓度Irgarol对3种硅藻光系统Ⅱ活性的相对抑制率
3 讨论
作为现今使用最广泛的防污剂, Irgarol本质上是一种三嗪类化合物, 主要作用位点在光合自养型生物光系统Ⅱ, 通过抑制藻类光合作用与生长, 从而防止船舶表面污损生物附着[21]。三嗪类化合物广泛应用于农业及水产养殖业中杂草、杂藻等生物的杀灭, 模拟培养实验显示, 质量浓度为0.5 μg/L的Irgarol明显抑制了颗石藻生长[22], 而于珊瑚(Anthozoa)共生的虫黄藻(Zooxanthella), 质量浓度20 ng/L已显著抑制其光合作用[4]。本研究结果表明, Irgarol对3种硅藻光系统Ⅱ活性均具有显著抑制效应, 最大抑制率与粒径呈现负相关关系, 这可能与硅藻光合器官组成形式不同有关。前期研究表明, 细胞粒径越大, 其胞内的叶绿素打包效应也越显著[23], 光系统外围的色素堆叠形式可能会减缓Irgarol与光系统相关蛋白的结合过程, 从而降低Irgarol的抑制作用。

图3 PAB条件下不同质量浓度Irgarol对3种硅藻光系统Ⅱ活性的相对抑制率

图4 不同Irgarol质量浓度下UVR对3种硅藻光系统Ⅱ活性的相对抑制率
注: 不同字母代表显著性差异
在海洋真光层, 浮游植物暴露于复杂的光环境中, 与可见光相比, UVR绝大多数情况下是负面作用, 其通常对细胞的多种代谢过程, 如光合作用、二氧化碳浓缩机制和细胞组分合成及DNA等产生负面影响[8, 11]。关于UVR的正面作用也有报道, 如有研究表明较低强度的UV-A可以刺激微藻和大型藻类的光合作用和生长[24]。本研究采用3种硅藻, 模拟海洋深水区弱光环境进行实验, 发现由于UVR强度很弱, 对硅藻光系统Ⅱ活性的抑制率都很低, 特别是斑点海链藻, 基本上没有受到影响, 但未见之前报道的正面促进作用, 这可能间接说明, 低剂量UVR的正面效应有可能通过促进光合作用暗反应, 而不是光反应产生的。在复合Irgarol条件下, UVR抑制效应明显显现, 表明在海洋环境污染日趋严重的情况下, 弱光环境下UVR对光合固碳的效应会由正转负, 从而会对海洋初级生产过程有明显调控作用。
浮游植物光合作用受到多重环境因子的影响, 由于近岸和远洋环境的不同, 一般来说大洋水域浮游植物平均粒径较小, 而近岸水域以大粒径浮游植物, 如硅藻为主。随着UVR在不同水层的衰减, UVR会对不同深度以及不同粒径的硅藻产生影响[25]。浮游植物对UVR的耐受程度在不同粒径浮游植物之间存在差异[26], 同时, 光能利用效率随着细胞粒径的减小而增强[27], 因此, 不同粒径硅藻对UVR的响应可能会影响初级生产力和碳输出。理论上, 体积更大的硅藻由于打包效应, 对UVR会具有更强的抵抗力。近些年的研究表明, 细胞大小和紫外线敏感度之间具有相关性, 但研究的结果各不相同。一些研究表明, 细胞大小并不是紫外线敏感度的良好指标[19], 但也有研究指出小型浮游硅藻比大型浮游硅藻对UVR更敏感。本研究结果表明, 不同细胞粒径硅藻对UVR的响应有明显差异, 特别是在低剂量UVR与Irgarol的耦合作用下, 即使是粒径最大的硅藻, 其光系统Ⅱ也会受到UVR的抑制, 表明随着近海有机污染的加剧, 浮游植物的粒径结构与生态功能会受到一定影响[18, 25]。尽管在蒙特利尔议定之后, 全球氯氟碳化合物的排放有所减缓, 但由于氯氟碳化合物的难降解特性, 臭氧层仍然持续损耗, 海洋浮游生物仍将面临增强的UVR带来的负面影响[28]。在此背景下, UVR耦合Irgarol可能会进一步加剧对浮游植物的抑制作用[29]。
4 总结
污损生物附着是一种复杂的现象, 虽然目前关于环境友好型防污涂料的研究日益丰富, 然而尚无商业化产品问世, 现有防污涂料的继续使用将会对水生生态系统产生深远的负面影响[30]。本论文针对不同粒径硅藻探讨了防污剂Irgarol和UVR的耦合作用, 发现即使是微弱的UVR, 其抑制效应在Irgarol存在的情况下也会显现, 说明二者的耦合对海洋真光层中下层区域的初级生产过程有一定的负面影响。然而, 本研究的时间尺度较短, 未来有必要进行中长期的实验, 考虑更多环境因子, 探讨长期暴露于多重环境压力下浮游植物的响应过程与适应机理。
[1] GIPPERTH L. The legal design of the international and European Union ban on tributyltin antifouling paint: Direct and indirect effects[J]. Journal of Environmental Management 2009, 90: 86-95.
[2] OMAE I. General aspects of tin-free antifouling paints[J]. Chemical Reviews, 2003, 103(9): 3431-3448.
[3] BASHEER C, TAN K S, LEE H K. Organotin and Irgarol-1051 contamination in Singapore coastal waters[J]. Marine Pollution Bulletin, 2002, 44(7): 697-703.
[4] KAMEI M, TAKAYAMA K, IIHIBASHI H, et al. Effects of ecologically relevant concentrations of Irgarol 1051 in tropical to subtropical coastal seawater on hermatypic coral Acropora tenuis and its symbiotic dinoflagellates[J]. Marine Pollution Bulletin, 2020, 150: 110734.
[5] CHESWORTH J C, DONKIN M E, BROWN M T. The interactive effects of the antifouling herbicides Irgarol 1051 and Diuron on the seagrass(L.)[J]. Aquatic Toxicology, 2004, 66(3): 293-305.
[6] DELORENZE M E, DANESE L E, BAIRD T D. Influence of increasing temperature and salinity on herbicide toxicity in estuarine phytoplankton[J]. Environmental Toxicology, 2013, 28(7): 359-371.
[7] SOUSA G T, NETO M C L, CHOUERI R B, et al. Photoprotection and antioxidative metabolism inexposed to coastal oceanic acidification scenarios in the presence of Irgarol[J]. Aquatic Toxicology, 2021, 230: 105717.
[8] FEMANDA PESSOA M. Harmful effects of UV radiation in algae and aquatic macrophytes - A review[J]. Emirates Journal of Food and Agriculture, 2012, 24(6): 510-526.
[9] BJÖRN L O. Stratospheric ozone, ultraviolet radiation, and cryptogams[J]. Biological Conservation, 2007, 135(3): 326-333.
[10] ARRÓNIZ-CRESPO M, NÚÑEZ-OLIVERA E, MARTÍNEZ- Abaigar J. Hydroxycinnamic acid derivatives in an aquatic liverwort as possible bioindicators of enhanced UV radiation[J]. Environmental Pollution, 2008, 151(1): 8-16.
[11] GAO K, WU Y, LI G, et al. Solar UV radiation drives CO2fixation in marine phytoplankton: A double-edged sword[J]. Plant Physiology, 2007, 144(1): 54-59.
[12] GEIDER R J, DELUCIA E H, FALKOWSKI P G, et al. Primary productivity of planet earth: biological determinants and physical constraints in terrestrial and aquatic habitats[J]. Global Change Biology, 2001, 7(8): 849-882.
[13] SARTHOU G, TIMMERMANS K R, BLAIN S, et al. Growth physiology and fate of diatoms in the ocean: a review[J]. Journal of Sea Research, 2005, 53(1/2): 25-42.
[14] 袁悟飚. 阳光UV辐射、升温及氮限制对硅藻光合生理影响的研究[D]. 武汉: 湖北工业大学, 2018.
YUAN Wubiao. Effects of solar UV radiation, ocean warming and nitrogen limitation on photophysiology of diatom species[D] Wuhan: Hubei University of Technology, 2018.
[15] MILLER G H, ALLEY R B, BRIGHAM-GRETTE J, et al. Arctic amplification: can the past constrain the future?[J]. Quaternary Science Reviews, 2010, 29(15/16): 1779-1790.
[16] BEARDALL J, ALLEN D, BRAGG J, et al. Allometry and stoichiometry of unicellular, colonial and multicellular phytoplankton[J]. New Phytologist, 2009, 181: 295-309.
[17] FINKEL Z V, BEARDALL J, FLYNN K J, et al. Phytoplankton in a changing world: cell size and elemental stoichiometry[J]. Journal of Plankton Research, 2009, 32(1): 119-137.
[18] KEY T, MCCARTHY A, CAMPBELL D A, et al. Cell size trade-offs govern light exploitation strategies in marine phytoplankton[J]. Environmental Microbiology, 2010, 12(1): 95-104.
[19] LAURION I, VINCENT W F. Cell size versus taxonomic composition as determinants of UV-sensitivity in natural phytoplankton communities[J]. Limnology and Oceanography, 1998, 43(8): 1774-1779.
[20] WU Y, LI Z, DU W, et al. Physiological response of marine centric diatoms to ultraviolet radiation, with special reference to cell size[J]. Journal of Photochemistry and Photobiology B: Biology, 2015, 153: 1-6.
[21] 邓祥元, 成婕, 高坤, 等. 防污剂Irgarol 1051在水环境中的生态效应[J]. 环境化学, 2015, 34(9): 1735-1740.
DENG Xiangyuan, CHENG Jie, GAO Kun, et al. Ecological impacts of antifouling agent Irgarol 1051 in aquatic environment[J]. Environmental Chemistry, 2015, 34(9): 1735-1740.
[22] BUMA A G J, SIOLLEMA S B, VAN DE POLL W H, et al. Impact of the antifouling agent Irgarol 1051 on marine phytoplankton species[J]. Journal of Sea Research, 2009, 61(3): 133-139.
[23] MARAÑÓN E, STEELE J, THORPE A, et al. Phytoplankton size structure[J]. Elements of Physical Oceanography, 2009, 85: 12-14.
[24] XU J, GAO K. UV-A enhanced growth and UV-B induced positive effects in the recovery of photochemical yield in(Rhodophyta)[J]. Journal of Photochemistry and Photobiology B: Biology, 2010, 100(3): 117-122.
[25] LI G, GAO K. Cell size-dependent effects of solar UV radiation on primary production in coastal waters of the South China Sea[J]. Estuaries and Coasts, 2013, 36(4): 728-736.
[26] LI G, GAO K, GAO G. Differential impacts of solar UV radiation on photosynthetic carbon fixation from the coastal to offshore surface waters in the South China Sea[J]. Photochemistry and photobiology, 2011, 87(2): 329-334.
[27] FUJIKI T. Variability in chlorophyll a specific absorption coefficient in marine phytoplankton as a function of cell size and irradiance[J]. Journal of Plankton Research, 2002, 24(9): 859-874.
[28] MONTZKA S A, DUTTON G S, YU P, et al. An unexpected and persistent increase in global emissions of ozone-depleting CFC-11[J]. Nature, 2018, 557(7705): 413-417.
[29] HOU R, WU Y, XU J, et al. Solar UV radiation exacerbates photoinhibition of a diatom by antifouling agents Irgarol 1051 and diuron[J]. Journal of Applied Phycology, 2020, 32(2): 1243-1251.
[30] PINTEUS S, LEMOS M F L, ALVES C, et al. The marine invasive seaweedsandas targets for greener antifouling solutions[J]. Science of The Total Environment, 2021, 750: 141372.
Interactive effect of Irgarol 1051 and ultraviolet radiation on photosystemⅡof three diatoms in a low-light environment
DING Pei-jian, CAO Li-xin, JIA Fei, XU Jun-tian, WU Ya-ping
(College of Marine Science and Fisheries, Jiangsu Ocean University, Lianyungang 222005, China)
As a commonly used antifoulant, Irgarol 1051 can act on the photosystemⅡ(PSⅡ) of photoautotrophs to inhibit the growth of algae on the surface of ships. In the present study, we cultivated three diatoms under natural sunlight and applied a neutral density screen to create a low-light environment. The dark-adapted photochemical yields were in the range of 0.60–0.70, which indicated that all cultures grew well. When the antifoulant was added, it significantly inhibited the PSII even at a low concentration (0.2 μg/L). Moreover, the photochemical yields decreased while the relative inhibition on PSII increased up to 42%. By analyzing the response of the diatoms under different radiation treatments, we found that the weak ultraviolet radiation (UVR) only had a slight inhibition on two small diatoms and that it had no effect on the largest diatom, with the maximal value being only 5%. However, the relative ultraviolet inhibition increased significantly in the presence of Irgarol 1051, and the smallest cells showed the highest inhibition of 10%. Results indicated a synergistic effect between Irgarol 1051 and low-level UVR that could potentially influence the size structure and primary production of phytoplankton assemblages in the low-light region of the euphotic zone.
diatom; Irgarol 1051; photosynthesis; ultraviolet radiation
Feb. 1, 2021
P76; Q945.11
A
1000-3096(2022)1-0123-08
10.11759/hykx20210201002
2021-02-01;
2021-03-22
国家自然科学基金资助项目(41876113); 江苏省自然科学基金资助项目(BK20181314); 江苏省研究生科研与实践创新计划项目(KYCX19-2285)
[Natural Science Foundation of China, No. 41876113; Natural Science Foundation of Jiangsu Province No. BK20181314; Postgraduate Research&Practice Innovation Program of Jiangsu Province, No. KYCX19- 2285]
丁佩建(1993—), 男, 江苏省泰州人, 硕士研究生, 主要从事海洋藻类生理学研究, 电话: 18360537743, E-mail: 614699841@ qq.com
(本文编辑: 谭雪静)

