小细胞肺癌经安罗替尼治疗后的特殊影像学评价*
王宁军,高业博,马银杰,薛 鹏,高 音,周 磊,朱世杰
(中国中医科学院望京医院肿瘤科,北京 100102)
肺癌是世界范围内发病率和病死率最高的恶性肿瘤[1]。在肺癌的各种亚型中小细胞肺癌占15%~20%[2]。化疗目前仍是小细胞肺癌的一线治疗方式。小细胞肺癌一线治疗后具有易复发的特点,需接受二线治疗,但二线治疗存在有效率低、不良反应重等缺点。因此,小细胞肺癌的二线治疗是目前研究的重点。在众多的二线方案中,抗血管生成药物是研究的热点之一,治疗药物包括大分子单克隆抗体如贝伐珠单抗和小分子络氨酸激酶抑制剂如安罗替尼。小细胞肺癌接受抗血管生成治疗后在评估疗效时,影像学检查仍是最重要的方法。因抗血管生成药物与化疗药物具有不同的作用机制,因而其治疗后影像学表现与化疗后比较会出现不同形式的变化。本研究观察了小细胞肺癌患者接受抗血管生成药物——安罗替尼治疗后肺部肿瘤在影像学方面的不同表现形式,并探讨了其发生机制,旨在为精准评价安罗替尼的疗效提供影像学证据。
1 资料与方法
1.1 一般资料
选取2018年6月至2020年9月在本院肿瘤科住院治疗的广泛期小细胞肺癌患者36例作为研究对象,其中男20例,女16例;年龄:>70岁22例,≤70岁14例;功能状态评分(PS评分):0分6例;1分22例,2分8例;肿瘤直径:>5 cm 22例,≤5 cm 14例;复发类型:难治性6例,敏感性17例,耐药性13例;吸烟26例,脑转移9例。纳入标准:(1)经组织学或细胞学病理检查诊断为广泛期小细胞肺癌,一线治疗后出现进展者;(2)有影像学可评估的病灶;(3)美国东部肿瘤协作组(ECOG) 评分小于或等于2分;(4)预计生存期大于3个月;(5)不合并其他肿瘤,无明显器官功能障碍;(6)签署本研究知情同意书。排除标准:(1)合并严重心、脑、肝、肾疾病,有症状的脑转移者;(2)伴上腔静脉综合征,需行放疗缓解症状者;(3)伴难治性高血压、活动性出血等;(4)ECOG评分大于2分;(5)合并其他癌症。
1.2 方法
1.2.1治疗方案
36例患者均接受盐酸安罗替尼胶囊(江苏正大天晴药业公司)口服进行二线治疗。初次服用盐酸安罗替尼选用每粒10 mg剂型口服,观察患者服药后耐受性。若耐受性好可改为每粒12 mg剂型口服;若耐受性差、不良反应重可改为每粒8 mg剂型口服;若仍不能耐受每粒8 mg剂型者则停药。具体服药方法:餐前1 h或餐后2 h口服,每天服药时间固定,连续用药2周,停药1周,3周为1个周期。盐酸安罗替尼治疗前行CT扫描作为基线资料,2个治疗周期后行胸部CT扫描评估疗效。疗效评估参照RECIST1.1标准,病灶与治疗前比较缩小或稳定且能耐受药物不良反应者继续使用,病灶进展或不能耐受不良反应者停用。胸部CT检查扫描采用Siemens 128排螺旋CT机。扫描体位采用仰卧位,双臂上举,扫描范围从肺尖至肺底,扫描时屏住呼吸。扫描顺序为先行平扫,再行增强扫描;增强对比剂选用碘海醇注射液(350 mgI/mL),总量80~100 mL,由高压注射器经肘静脉注射后行增强扫描,注射速度为2.5 mL/s。扫描时相包括动脉期和静脉期。
1.2.2图像分析
由2名主治医师或以上专业技术职务医师在治疗前后分别独立观察图像并记录相关数值。记录内容包括病灶部位、数量、大小、形态、密度(CT值)、增强后CT值变化情况等。治疗前后测量数值均取2名医师测量的平均值。
1.2.3疗效评估
根据RECIST1.1标准进行疗效评价:(1)完全缓解(complete response,CR):所有目标病灶完全消失,目标结节缩小至正常大小(短轴小于10 mm);(2)部分缓解(partial response,PR):所有可测量目标病灶直径总和低于基线30%及以上,目标结节总和使用短径,而所有其他目标病灶的总和使用最长直径;(3)疾病进展(progressive disease,PD):以入组病例中所有测量的靶病灶直径之和的最小值作为参照,直径和相对增加至少20%(如基线测量值最小就以基线值作为参照),此外必须满足直径和的绝对值增加至少5 mm(出现1个或多个新病灶也视为PD);(4)疾病稳定(stable disease,SD):靶病灶减小程度没达到PR,增加程度也没达到PD水平,介于二者之间,研究时可以直径之和的最小值作为参考。36例患者2个用药周期后进行影像学检查,评价病灶变化情况。疗效评估后计算客观有效率(ORR)和疾病控制率(DCR),ORR=(CR例数+PR例数)/总例数×100%,DCR=(CR例数+PR例数+SD例数)/总例数×100%。
1.2.4随访
36例患者均获定期随访,随访起始日期为开始口服安罗替尼时间,2021年3月31日为最后随访日期,未出现失访病例。
1.3 统计学处理
2 结 果
2.1 疗效评价
36例患者中CR 0例(0%),PR 10例(27.78%),SD 11例(30.56%),PD 15例(41.67%)。ORR为27.78%,DCR 为58.33%。
2.2 肺部肿瘤影像学变化
PR患者中影像学改变表现为肿瘤缩小6例,肿瘤内部形成空洞4例,见图1、2;SD患者中按RECIST1.1标准肿瘤大小既没有达到PR标准也没有达到PD标准,但治疗前后肿瘤内部密度(CT值)有明显变化。11例SD患者治疗前肺部肿瘤平扫瘤体内部平均CT值为(36.94±4.89)Hu,治疗后同一病灶内部平均CT值为(32.17±5.05)Hu,治疗前后CT值比较,差异有统计学意义(t=3.05,P=0.02),见图3。15例PD患者中表现为病灶直径增大11例,达到PD标准;病灶直径稳定4例,但出现新发病灶。

A:治疗前(肺窗);B:治疗前(纵隔窗)。图1 治疗前图像

A:治疗后(肺窗);B:治疗后(纵隔窗)。图2 口服安罗替尼治疗2周期后图像
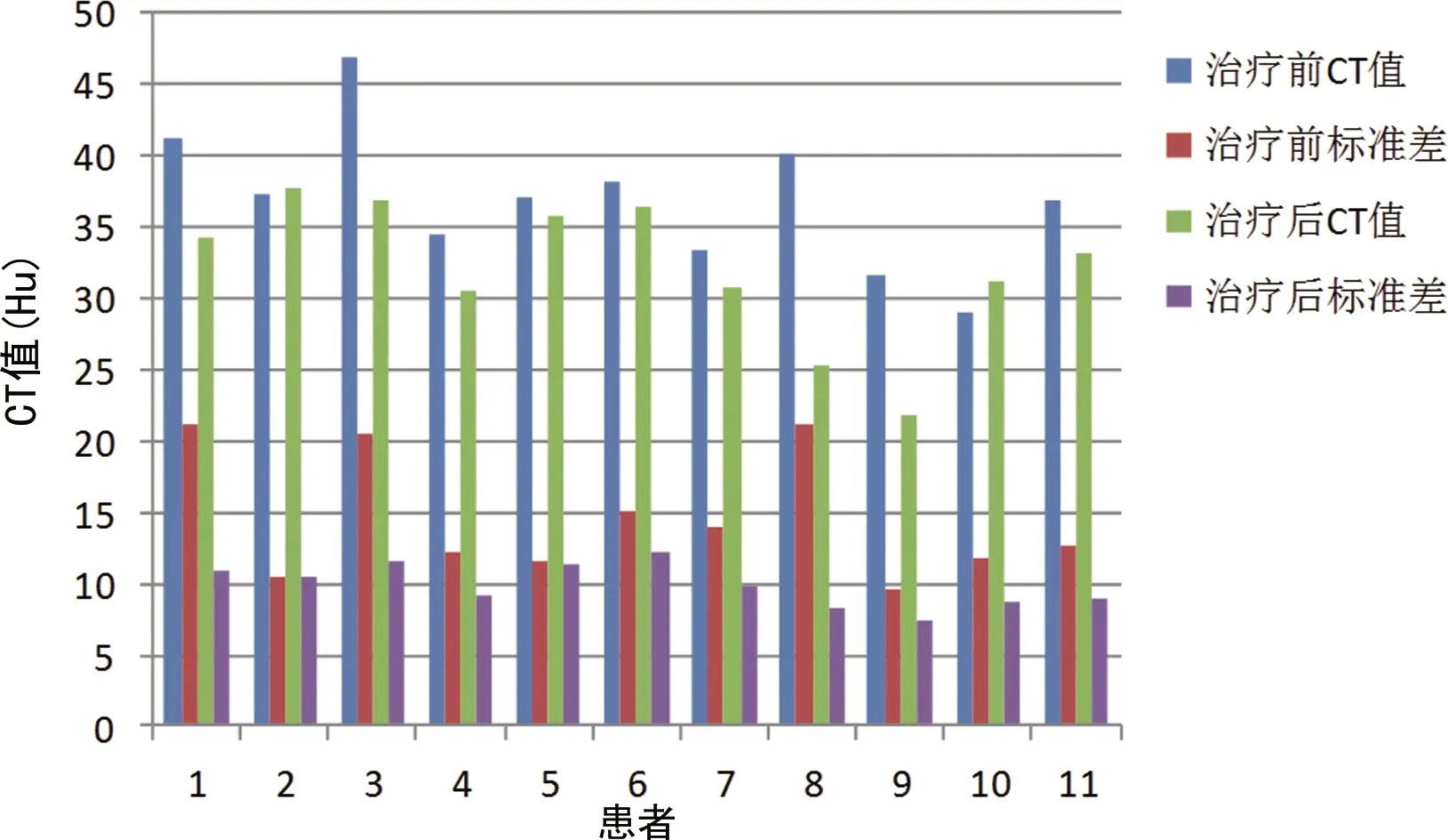
图3 SD患者治疗前后CT值比较
3 讨 论
肺癌是我国发病率居第1位的肿瘤。在肺癌的病理分型中小细胞肺癌是一种较为独特的病理亚型,其生物学特点是恶性程度高、侵袭性强、病情进展快、早期即可出现远处转移[3-4]。迄今为止,化疗仍是小细胞肺癌的首选治疗方法[5]。依托泊苷联合铂类化疗是小细胞肺癌的一线标准治疗方案[6-7]。虽然初期小细胞肺癌患者对放化疗敏感,但大部分患者会在2年内出现复发或转移而导致死亡,因而小细胞肺癌的二线及后线治疗也是能否延长患者生存期的重点所在。因此,研发新的后线治疗药物是复发性或难治性小细胞肺癌患者的迫切需求。
血管生成是恶性肿瘤的重要特征之一。新生的肿瘤血管不仅可以为肿瘤细胞的生长提供营养,而且可以分泌各种生长因子促进肿瘤细胞增殖,对肿瘤的生长、侵袭和转移具有重要作用[8-9]。阻断肿瘤的血液供应,不仅可以切断肿瘤生长所必需的营养物质,同时还可以减少促进肿瘤生长的各种生物因子的分泌,促进肿瘤的凋亡。因此,抗血管生成治疗小细胞肺癌也一直是研究的方向之一。盐酸安罗替尼是我国制药企业自主研发的小分子多靶点酪氨酸激酶抑制剂,具有抗肿瘤血管生成和抑制肿瘤生长的作用[10-11]。安罗替尼的抗肿瘤血管生成机制主要为该药物能进入细胞内通过与血管内皮生长因子受体2和原癌基因(c-Kit)激酶结合,阻断与血管生成相关的信号通路,最终抑制肿瘤血管生成[12]。安罗替尼还能通过抑制c-Kit激酶阻断其介导的Janus激酶(JAK)/信号传导及转录激活蛋白(STAT) 、磷酸肌醇-3激酶/蛋白激酶B、鼠肉瘤病毒子代基因(Ras)-细胞外调节蛋白激酶(Erk)等信号通路,使肿瘤生长信号无法传至细胞核内,从而抑制肿瘤增殖和侵袭。通过以上2种作用机制,安罗替尼最终能够引起肿瘤细胞凋亡,减少肿瘤细胞数量,降低肿瘤负荷。
国内开展了大量安罗替尼治疗小细胞肺癌的临床研究。ALTER 1202研究是安罗替尼对照安慰剂治疗小细胞肺癌的随机、双盲、多中心Ⅱ期临床试验。该试验结果显示,与安慰剂比较,安罗替尼能明显延长小细胞肺癌患者的无进展生存期(分别为4.1、0.7个月),降低PD风险(危害比=0.19,P=0.000 1),提高DCR(分别为71%、13%)。杨琳[13]、李丽等[14]和王微等[15]研究也表明,安罗替尼在小细胞肺癌二线以后的治疗中可取得良好疗效。
基于前述研究结果,本研究选择盐酸安罗替尼作为小细胞肺癌的二线治疗药物,取得了27.78%的ORR和58.33%的DCR,再次验证了安罗替尼在小细胞肺癌中的良好疗效。在本研究实施过程中观察到,由于安罗替尼独特的作用机制,小细胞肺癌患者的肺部肿块在治疗后所表现出来的影像学变化与化疗药物治疗后的影像学变化不尽相同。这些差异主要体现在2个方面:(1)治疗后肿瘤负荷减小的形式不同,不仅可以表现为肿瘤瘤体缩小,还可以表现为瘤体内部空洞形成;(2)治疗后部分肿瘤瘤体内部的密度发生变化,具体表现为瘤体CT值较治疗前明显降低。本研究10例患者肺部病灶经治疗后依据RECIST 1.1标准可评价为PR。在这10例PR患者中有6例患者肺部肿块表现为瘤体缩小并达到PR标准,与化疗后瘤体缩小具有相同的影像学表现;有4例患者肺部病灶经治疗后瘤体直径在缩小的同时还伴有瘤体内部较大范围的空洞形成(图2),残留肿瘤负荷较治疗前明显减少。治疗后瘤体内部出现空洞这种变化在以往的化疗时并非完全不会出现,但出现的概率非常低,主要见于瘤体较大或肿瘤合并感染的病例;同时化疗后肿瘤内部所形成的空洞多位于瘤体中心,范围较小,外周残留肿瘤较多,为厚壁空洞。本研究中4例患者形成空洞的瘤体直径均未超过5 cm,瘤体内部所呈现的空洞范围均较大,几乎达肿瘤边缘,所形成的空洞为薄壁空洞,外周残留肿瘤较少。从形态学上比较,安罗替尼治疗后所形成的薄壁空洞与化疗后所形成的厚壁空洞具有明显的区别,在影像上非常容易鉴别。本研究中10例PR患者中有4例患者瘤体内部形成空洞,发生率为40.0%,与以往化疗后瘤体内出现空洞的概率比较,发生率明显升高。对这种空洞形成的病灶进行疗效评价时测量方法非常重要,既要测量目标病灶的直径总和,也要测量残余病灶直径总和。目标病灶的直径总和是包括空洞在内的整个病灶的直径之和,残余病灶直径总和则是空洞壁最大直径之和。只要目标病灶的直径总和或残余病灶直径总和减少值符合RECIST1.1标准,即可评价为PR。
本研究中有11例患者治疗后依据RECIST 1.1标准评价为SD。在测量患者肺部病灶内部的CT值时发现,与治疗前比较,治疗后瘤体内部CT值较治疗前明显减低,治疗前后CT值比较,差异有统计学意义(t=3.05,P=0.02)。11例患者中有3例患者治疗后再次接受了正电子发射断层扫描/电子计算机断层扫描(positron emission tomography/computed tomography,PET/CT)检查,结果显示,患者肺内病灶标准摄取值(SUV值)均有不同程度的下降。11例患者治疗后复查肿瘤标志物——神经元特异性烯醇化酶和胃泌素释放肽前体,其中10例患者2种肿瘤标志物均呈不同程度下降,仅1例患者2种肿瘤标志物较前升高,但其PET/CT检查显示病灶内SUV值较前下降。综合以上影像学及实验室检查结果,作者认为,11例患者接受安罗替尼治疗后肺部病灶也得到一定程度的控制,肿瘤负荷减小,应考虑为治疗有效,可以继续接受安罗替尼治疗。本研究中15例PD患者治疗后瘤体内部CT值也呈不同程度下降,但因其被RECIST 1.1标准评估为PD,此时治疗前后CT值变化的评估作用则退居次要地位,仅作为综合评估因素供参考。
小细胞肺癌经安罗替尼治疗后有效的患者可表现为病灶内出现空洞,也可表现为病灶内部CT值减低。治疗后病灶是表现为空洞形成,还是表现为病灶内部CT值减低主要与以下两方面因素有关:(1)病灶内部血供情况,主要体现在CT值的大小。CT值是反映肿瘤病灶内密度的1个指标,除与肿瘤的质地有关外,还与肿瘤内部微血管密度有关,微血管密度越高,CT值也越高。病灶内部微血管密度在影像学上主要体现在增强后病灶内部CT值的升高程度:增强后CT值升高的程度越高提示病灶内部血供越丰富。而微血管密度高的病灶在接受抗血管生成治疗后瘤体内血供减少的程度也就越重。本研究中治疗后病灶内出现空洞的患者,其基线资料显示增强扫描时肿瘤病灶内部强化程度较高。(2)影响治疗后影像学变化的另一个因素是安罗替尼的2种作用机制在抗肿瘤过程中的强度差异。如安罗替尼抑制肿瘤血管生成作用和抑制肿瘤的增殖作用均很强,则治疗后所表现出来的结果就是肿瘤缩小或空洞形成。如安罗替尼抑制肿瘤血管生成作用和抑制肿瘤的增殖作用较弱,则治疗后所表现出来的结果就是肿瘤密度减小,即肿瘤病灶内部CT值降低。体现安罗替尼3种作用机制强度的指标为口服剂量值。本研究中治疗后病灶内出现空洞的患者服用安罗替尼的剂量均为12 mg,提示安罗替尼高剂量给药时,其抗血管和抑制肿瘤增殖的作用均很强,可形成病灶内部空洞这一特殊影像学表现。而治疗后病灶内部CT值降低的患者,其服用安罗替尼的剂量则以10 mg居多,11例患者中有9例患者服用的是10 mg剂型,提示降低安罗替尼给药剂量时,其抗血管和抑制肿瘤增殖的作用也减弱,影像学检查主要以病灶内部密度减低为主要表现。
目前,针对实体肿瘤疗效评价应用最广泛的是RECIST 1.1标准,在评价肿瘤靶向治疗疗效时似乎不够全面。这是因为靶向药物主要是通过抑制肿瘤细胞各种信号传导通路引起肿瘤细胞凋亡,因而疗效不仅表现为肿瘤大小的改变,还包括形态和密度的变化。本研究10例CR患者中有4例患者病灶内出现空洞,与以往化疗后出现的影像学变化具有明显的差异,提示空洞是服用安罗替尼治疗后的特殊影像学改变。本研究不足之处在于入组病例数较少,在今后的研究中可继续扩大样本量,进一步观察和总结空洞形成这一特殊的影像学改变在安罗替尼治疗中出现的概率和规律,为精准评估靶向治疗的疗效提供依据。

