Gab1在胃癌组织中表达分析及通过PI3K/AKT通路调控转移的机制研究
李拓键
陆军军医大学第一附属医院健康管理中心,重庆 400038
一项全球性的调查研究显示,2020年胃癌的新发病患者共约103万例,占所有恶性肿瘤的5.7%,死于胃癌的患者共约78万例,占8.2%[1]。我国胃癌发病率较高,虽然新的靶向疗法、免疫疗法、个性化治疗等策略不断被应用于临床,但是胃癌的复发率和病死率仍然较高,探究胃癌发生和发展的机制是寻找新的诊断和治疗靶点的重要手段[2]。Grb2相关结合蛋白1(Gab1)是细胞的骨架蛋白,参与细胞形态的维持,并且在口腔鳞状细胞癌、肝细胞癌等疾病中具有促癌作用[3-4]。PI3K/AKT通路的激活是促进胃癌转移的重要信号通路,并且与胃癌的复发有关[5]。近年来研究发现,Gab1也可以作为信号通路中的“放大器”,通过激活通路促进肿瘤细胞的生长并抑制其凋亡,FAN等[6]的研究显示,Gab1可能通过激活PI3K/AKT通路抑制软骨肉瘤细胞凋亡。然而,关于Gab1在胃癌中的表达特点及对胃癌细胞生物学行为的影响尚不清楚。本文主要分析Gab1在胃癌中的临床意义,并分析Gab1通过PI3K/AKT通路调控转移的机制,为临床更好地治疗胃癌提供新思路。现报道如下。
1 材料与方法
1.1材料来源 收集2015年3月至2018年3月在陆军军医大学第一附属医院进行胃癌切除术新鲜胃癌组织及癌旁正常组织(距离肿瘤组织距离>5 cm)标本各70份。纳入标准:(1)经过术后病理学检测确诊为胃腺癌;(2)入组前未经过化疗、放疗、靶向治疗;(3)知情同意。排除标准:(1)合并其他恶性肿瘤;(2)合并其他严重基础疾病。本研究经过陆军军医大学第一附属医院伦理委员会批准。
1.2仪器与试剂 人胃腺癌细胞系AGS细胞来自美国典型培养物保藏中心。DMEM培养基、胎牛血清、L-谷氨酰胺、青霉素和链霉素来自美国Thermo Fisher公司。PI3K/AKT抑制剂LY294002购自中国Selleck公司。pCMV6-entry-Gab1重组质粒及相应的阴性对照质粒购自美国OriGene公司。Lipofectamine 2000试剂来自美国Thermo Fisher公司。细胞计数试剂盒-8(CCK-8)来自中国Beyotime生物技术研究所。Transwell小室及配套试剂来自美国BD Biosciences公司。PCR引物由中国Genewiz公司设计和合成。Trizol试剂来自美国Invitrogen公司。反转录cDNA试剂盒和SYBR Green PCR Master Mix qPCR试剂盒来自瑞士Roche公司。ABI 7500 PCR检测系统来自美国Life technology公司。RIPA裂解缓冲液来自中国Beyotime公司。BCA蛋白测定试剂盒和ECL试剂盒来自中国Applygen公司。Gab1免疫组化染色试剂盒购自美国Abcam公司。Gab1、GAPDH抗体和二抗来自美国Abcam公司。PVDF膜来自美国Bio-Rad公司。
1.3方法
1.3.1免疫组织化学实验检测胃癌组织和癌旁组织中Gab1表达情况 将标本组织经过梯度乙醇脱水、透明处理后包埋至蜡块中,冷冻后切成4 μm厚切片。将组织脱蜡并再水化。使用3%的过氧化氢甲醇溶液封闭内源性过氧化物酶活性。使用蒸锅在95 ℃下于0.01 mol/L柠檬酸盐缓冲液(pH=6.0)中对切片进行热诱导的抗原回收。在切片标本中加入Gab1一抗(1∶50稀释)并在室温下孵育45 min,加入生物素标记的IgG抗体(1∶50稀释)孵育30 min。滴加DAB显色5~6 min后加入苏木紫染色20 min。脱水透明化处理、封片。使用显微镜观察染色结果。通过半定量法评估:颜色深浅为0~3分,染色范围为0~4分,二者相乘之积作为染色强度。并根据染色强度评分的中位数,将胃癌组织分为Gab1低表达和高表达。
1.3.2细胞培养及Gab1干扰AGS细胞的建立 为与临床标本对应,选择胃腺癌细胞进行研究。AGS细胞在含有10%胎牛血清、2 mmol/L-谷氨酰胺、1%青霉素(100单位/毫升)和链霉素(100 μg/mL)的DMEM培养基中培养。37 ℃,5% CO2,相对湿度100%。细胞分为空白组、对照组、Gab1组和Gab1+LY294002组。Gab1组和Gab1+LY294002组使用Lipofectamine 2000试剂盒进行瞬时转染,将pCMV6-entry-Gab1重组质粒转染进入AGS细胞中,转染48 h后收集细胞并通过qPCR和Western blot检测转染效率。对照组转染等量的阴性对照质粒。空白组不进行转染。Gab1+LY294002组细胞培养基中加入PI3K/AKT抑制剂LY294002抑制PI3K/AKT通路,LY294002的浓度为5 μmol/L。
1.3.3qPCR检测各组细胞中Gab1 mRNA相对表达水平 通过Trizol获得细胞中总RNA,然后检测RNA的纯度和浓度。使用cDNA试剂盒将1 μg RNA反转录合成cDNA(42 ℃ 60 min,70 ℃ 5 min,4 ℃保存)。使用SYBR Green PCR Master Mix进行qPCR试验(在95 ℃ 10 min,40个循环,94 ℃ 15 s,60 ℃ 1 min, 60 ℃ 1 min,4 ℃保存)。GAPDH作为内参,通过比较循环阈值(ΔΔCt)用于分析Gab1 mRNA相对表达水平。Gab1上游引物:5′-GGT GGT GAA GTG GTC TGC TC-3′;下游引物:5′-TCG GGC TTC TTG CTT TGA CA-3′。GAPDH上游引物:5′-CAA GGT CAT CCA TGA CAA CTT TG-3′;下游引物:5′-GTC CAC CAC CCT GTT GCT GTA G-3′。
1.3.4Western blot检测各组细胞中Gab1蛋白表达水平和AKT蛋白磷酸化水平 在液氮下将细胞研磨并使用RIPA裂解缓冲液裂解,使用BCA蛋白测定试剂盒测量总蛋白水平。使用SDS-PAGE分离等量的总蛋白(120 V下电泳90 min),随后将蛋白转移到PVDF膜上(50 V,120 min),在含有5%脱脂牛奶的封闭溶液中封闭。将PDVF膜与Gab1抗体(1∶500稀释)在4 ℃孵育过夜,然后加入1∶5 000稀释的HRP偶联二抗在室温下孵育1 h。使用ECL试剂盒可视化蛋白条带,并在ImagePD软件中使用GAPDH作为内参对蛋白条带的灰度进行定量。
1.3.5CCK-8法检测细胞活力 将2×104个细胞接种在96孔板(每孔100 μL),在培养第24、48和72 h加入10 μL CCK-8试剂并在37 ℃下培养2 h,通过酶标仪检测450 nm处的吸光度(A)值。
1.3.6细胞划痕实验检测细胞迁移能力 将各组细胞消化后分别接种在6孔板中,每孔1×106个细胞,然后在37 ℃,5% CO2,相对湿度100%条件下培养直至90%汇合。使用200 μL的移液枪头从上至下轻轻划伤细胞,将划掉的细胞洗去。在相同条件下继续培养24 h。在显微镜下测量细胞划痕距离的百分比(两端前缘距离/初始划痕宽度×100%)。
1.3.7Transwell实验检测细胞侵袭能力 将完全培养基加入到Transwell小室的下室,将基质胶加入到上室。将3×104个细胞加入至上室培养。培养24 h后洗去未侵入下室的细胞。将细胞使用20%甲醇固定,并用0.2%结晶紫染色。在倒置显微镜下计数每个视野侵入下室的细胞数目。

2 结 果
2.1Gab1在胃癌中的表达水平及与临床病理参数的关系 Gab1在癌旁组织中表达水平较低,染色强度为(1.38±0.26),但是在胃癌组织中的表达水平较高,染色强度为(5.07±0.82),并且Gab1定位于细胞质,见图1。存在淋巴转移、存在远端转移、T3+T4浸润深度、Ⅲ~Ⅳ期患者较无淋巴转移、无远端转移、T1+T2浸润深度、Ⅰ~Ⅱ期患者Gab1高表达水平所占比例更高(P<0.05),见表1。

注:A、B为免疫组织化学染色检测癌旁组织和胃癌组织中Gab1的表达,C为癌旁组织和胃癌组织中Gab1免疫组化染色评分比较;与癌旁组织比较,*P<0.05。
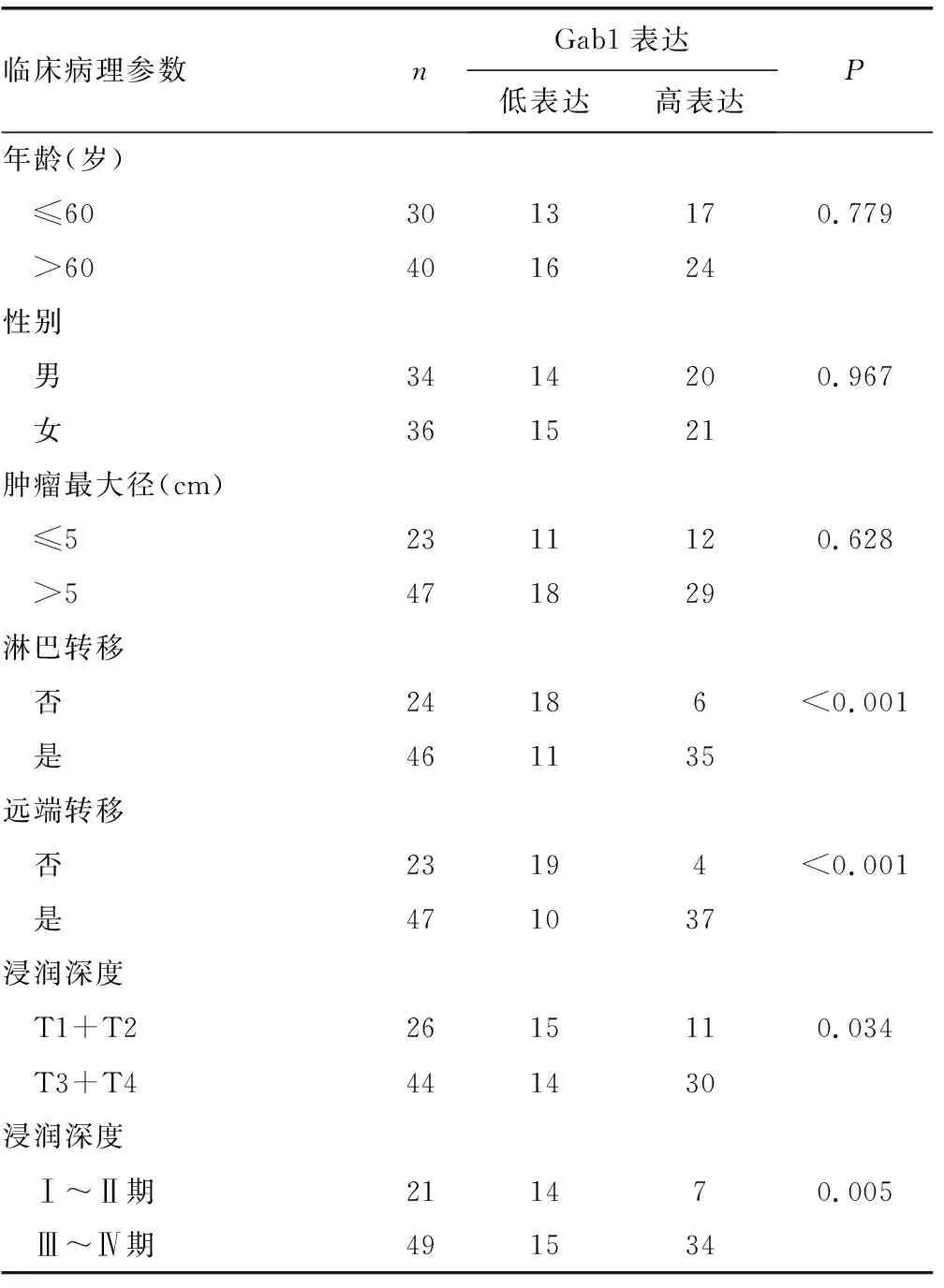
表1 胃癌患者Gab1表达水平与临床病理参数的关系(n)
2.2各组细胞中Gab1 mRNA相对表达水平和蛋白表达水平比较 Gab1组和Gab1+LY294002组细胞中Gab1 mRNA相对表达水平和蛋白表达水平均明显高于空白组和对照组(P<0.05),且LY294002对Gab1 mRNA相对表达水平和蛋白表达水平影响不明显,见图2。
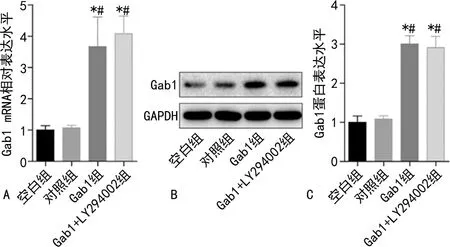
注:A为各组细胞中Gab1 mRNA相对表达水平比较;B为Western blot检测各组中Gab1蛋白表达水平;C为各组细胞中Gab1蛋白表达水平比较;与对照组比较,*P<0.05;与空白组比较,#P<0.05。
2.3各组细胞活力比较 在培养72 h后,Gab1组的A值(0.82±0.06)明显较对照组、空白组和Gab1+LY294002组升高(P<0.05)。LY294002会阻断Gab1对细胞活力的促进作用,见图3。

注:与对照组比较,*P<0.05;与空白组比较,#P<0.05;与Gab1组比较,^P<0.05。
2.4各组细胞迁移和侵袭能力比较 培养24 h后,对照组的划痕宽度为0 h时宽度的(50.37%±0.12%),Gab1+LY294002组为(49.24%±0.13%),与空白组比较差异均无统计学意义(P>0.05)。Gab1组的细胞划痕距离百分比为0 h时的(26.17%±0.09%),明显低于空白组、对照组、Gab1+LY294002组(P<0.05)。见图4。Gab1组侵袭细胞数目明显高于空白组、对照组、Gab1+LY294002组(P<0.05)。见图5。

注:A为细胞划痕实验检测各组细胞的迁移能力;B为各组细胞迁移能力比较;与对照组比较,*P<0.05;与空白组比较,#P<0.05;与Gab1组比较,^P<0.05。

注:A为Transwell实验检测各组细胞的侵袭能力;B为各组细胞的侵袭能力比较;与对照组比较,*P<0.05;与空白组比较,#P<0.05;与Gab1组比较,^P<0.05。
2.5各组细胞AKT蛋白磷酸化水平比较 Gab1组AKT蛋白磷酸化水平明显高于空白组、对照组和Gab1+LY294002组(P<0.05),见图6。

注:p-AKT为磷酸化AKT蛋白;A为Western blot检测各组细胞中AKT和p-AKT蛋白水平;B为各组细胞中p-AKT/AKT蛋白相对表达水平比较;与对照组比较,*P<0.05;与空白组比较,#P<0.05;与Gab1+LY294002组组比较,^P<0.05。
3 讨 论
胃癌是最常见的癌症之一,在中国、日本、韩国等亚洲地区尤为普遍[7]。虽然最近十年胃癌发病率得到一定的控制,但是胃癌的病死率仍居高不下。手术是治疗胃癌的最主要方法,但是大多数胃癌患者在确诊时已经处于晚期或者出现转移,晚期胃癌患者的5年生存率不足20%[8]。肿瘤细胞无限增殖,强大的侵袭和转移能力是导致胃癌患者生存率低的主要原因之一,因此,探索胃癌转移过程中涉及的机制对发现胃癌诊断和治疗的潜在靶点至关重要。
Gab1属于Gab衔接子家族,参与信号的传导,研究已经发现Grb2在胃癌进展中发挥重要作用,Grb2-DENND1A复合物会被表皮细胞生长因子激活,从而诱导胃癌细胞迁移[9],且Grb2通过调节下游的通路参与胃癌的发生[10]。Gab1蛋白是与Grb2结合的蛋白,但是关于Gab1在胃癌中的表达特点和对胃癌细胞的调控作用尚不清楚。过往研究显示,在横纹肌肉瘤和滑膜肉瘤中Gab1的表达水平明显升高,且高临床分期(Ⅲ和Ⅳ期)的肿瘤中Gab1阳性率明显高于低临床分期(Ⅰ和Ⅱ期)的肿瘤,提示在肉瘤中Gab1与不良的预后有关[11]。Kaplan-Meier生存分析和Cox风险分析结果显示,Gab1高表达的卵巢癌患者术后具有更低的生存率,Gab1的高表达与卵巢癌FIGO晚期和淋巴结转移呈正相关,可作为预测预后的独立指标[12]。此外,Gab1也可作为临床预测胶质瘤预后的指标[13]。在本研究结果中,通过免疫组织化学染色发现Gab1在癌旁组织中表达水平较低,而胃癌组织中Gab1在细胞质中广泛表达,并且进一步的研究结果显示,在更高的临床分期、更深的浸润深度及存在远端转移和淋巴转移患者中Gab1高表达水平患者所占比例更高,这提示在胃癌中Gab1可能参与肿瘤的发生和转移,并且可能成为预测胃癌患者预后的标志物,但是关于Gab1与胃癌患者预后的关系还需要扩大样本量进行长期的随访研究。
Gab1通过与Grb2蛋白结合参与信号的传导,Gab蛋白与Grb2结合后,会募集PI3K/AKT等蛋白,PI3K/AKT会通过Gab1中的磷酸酪氨酸基序与Gab1相互作用,从而参与调控细胞内信号通路的传导[14-15]。而PI3K/AKT是胃癌发生和发展中的重要通路,研究显示PI3K/AKT通路的激活会促进一些原癌基因的表达,从而诱导细胞过度增殖并且具有高转移性[16]。因此本研究进一步分析了过表达Gab1对胃癌细胞的迁移和侵袭的影响,以及Gab1是否通过PI3K/AKT通路发挥促癌作用。本研究通过转染 pCMV6-entry-Gab1重组质粒以过表达Gab1,通过qPCR和Western blot验证了转染后Gab1 mRNA相对表达水平和蛋白表达水平明显升高。进一步的细胞生物学实验结果也显示,Gab1过表达时,胃癌AGS细胞的细胞活力、迁移和侵袭能力明显升高,而PI3K/AKT抑制剂LY294002会阻断Gab1对胃癌细胞生长和转移的促进作用。既往有研究发现,提高Gab1的表达水平会促进乳腺癌细胞的转移能力[17]。也有体外研究显示,抑制Gab1表达水平具有抑制肺癌细胞增殖和侵袭的作用[18]。本研究结果还显示,过表达Gab1后会促进PI3K蛋白下游蛋白AKT的磷酸化,并且使用LY294002抑制PI3K/AKT后会阻断Gab1对AKT磷酸化的促进作用。ZHANG等[19]研究显示,Gab1会通过影响PI3K/AKT通路抑制bFGF诱导的生物学活性。本研究结果显示,在胃癌细胞AGS中表达上调的Gab1可能通过激活PI3K/AKT通路促进细胞迁移和侵袭。但是关于Gab1通过PI3K/AKT通路调节胃癌细胞迁移和侵袭的机制仍需要进一步的体内试验验证。
综上所述,Gab1在胃癌组织中高表达,且高表达水平的Gab1与胃癌的恶性表型有关。上调的Gab1表达会通过激活PI3K/AKT通路促进胃癌细胞的细胞迁移和侵袭。这提示Gab1可能成为诊断和治疗胃癌的新靶点,关于Gab1调控胃癌转移的机制值得进一步研究。

