IVC、HA与类风湿性关节炎继发间质性肺病的相关性研究
孙慧莹 刘晓敏 王永福 鲁芙爱
类风湿关节炎 (rheumatoid arthritis, RA) 是一种以关节滑膜炎为主要特征的自身免疫性疾病,间质性肺病(Interstitial lung disease,ILD)是其常见的关节外表现。美国的数据库显示RA-ILD患病率为3.2~6.0/10万,发病率为2.7~3.8/10万[1]。RA患者肺间质性异常发病率高达22%,且进展率较高,主要表现为肺功能进行性恶化、胸膜下网状影增加和/或小叶间隔增厚,确诊后5年死亡率为35.9%[1-5]。早筛查、早诊治对RA-ILD的预后至关重要。血清层粘连蛋白(laminin,LN)、三型前胶原N端肽(procollagen Ⅲ N-terminal peptide,PⅢNP)、四型胶原(type Ⅳ collagen,IVC)、透明质酸(hyaluronic acid,HA)是细胞外基质成分,有文献显示这四项指标在结缔组织病继发ILD中高表达[6]。这四项指标在RA中的研究较少,本研究旨在检测这四者在RA-ILD患者血清中的表达情况,并探究其与RA-ILD各指标的关联性。
资料与方法
一、研究对象
选取2018年3月至2020年10月在我院住院的RA患者105例, 其中RA-ILD患者65例,非RA-ILLD(N-RA-ILD)患者40例。另选取我院体检中心正常体检者40人作为健康对照组。入组患者符合医院医学伦理委员会批准,所有患者均签署知情同意书。纳入标准:① RA患者的诊断符合2010年 ACR/EULAR 的RA 诊断标准[7]。② ILD的诊断符合 2011年ATS/ERS提出的诊断标准[8]。排除标准:① 合并其他结缔组织病。② 合并其他肺部疾病,如慢性支气管炎、肺结核、肺部感染、肺部肿瘤等。③ 合并肝癌及肝硬化等疾病。收集信息包括临床资料、血清学指标、影像学指标等。
二、研究方法
1 临床资料与实验室数据收集 包括两组患者年龄、性别、病程、初诊时病程、目前激素和/或DMARDS药物使用情况、吸烟史、关节肿胀数、关节压痛数、晨僵时间等临床资料。实验室指标:抗 CCP 抗体、RF 、ESR、CRP、IgA、IgM、IgG等。
2 实验方法 抗 CCP 抗体、RF 、ESR、CRP、IgA、IgM、IgG均采用本院常规检测方法。血清LN、PⅢNP、IVC、HA水平测定:每个患者身上取出5毫升静脉血,从全血中分离出至少1 ml血清,保存在-80 ℃冰箱备用。将血清样品在室温下解冻,然后在1 500~2 000×离心15分钟。采用化学发光法检测,所用到的试剂盒购自深圳亚辉龙生物科技股份有限公司。
三、统计学方法
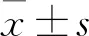
结 果
一、三组患者血清LN、PⅢNP、IVC、HA表达水平
三组患者年龄、性别无明显差异(P>0.05)。三组患者血清LN水平无明显差异(P>0.05)。RA-ILD及N-RA-ILD患者PⅢNP表达无差异(P>0.05),但二者均高于健康对照组(P<0.05)。RA-ILD组IVC、HA水平均高于N-RA-ILD组及健康对照组(P<0.001)。N-RA-ILD患者IVC水平与健康对照组无明显差异(P>0.05),而HA水平高于健康对照组(P<0.05)(见表1)。
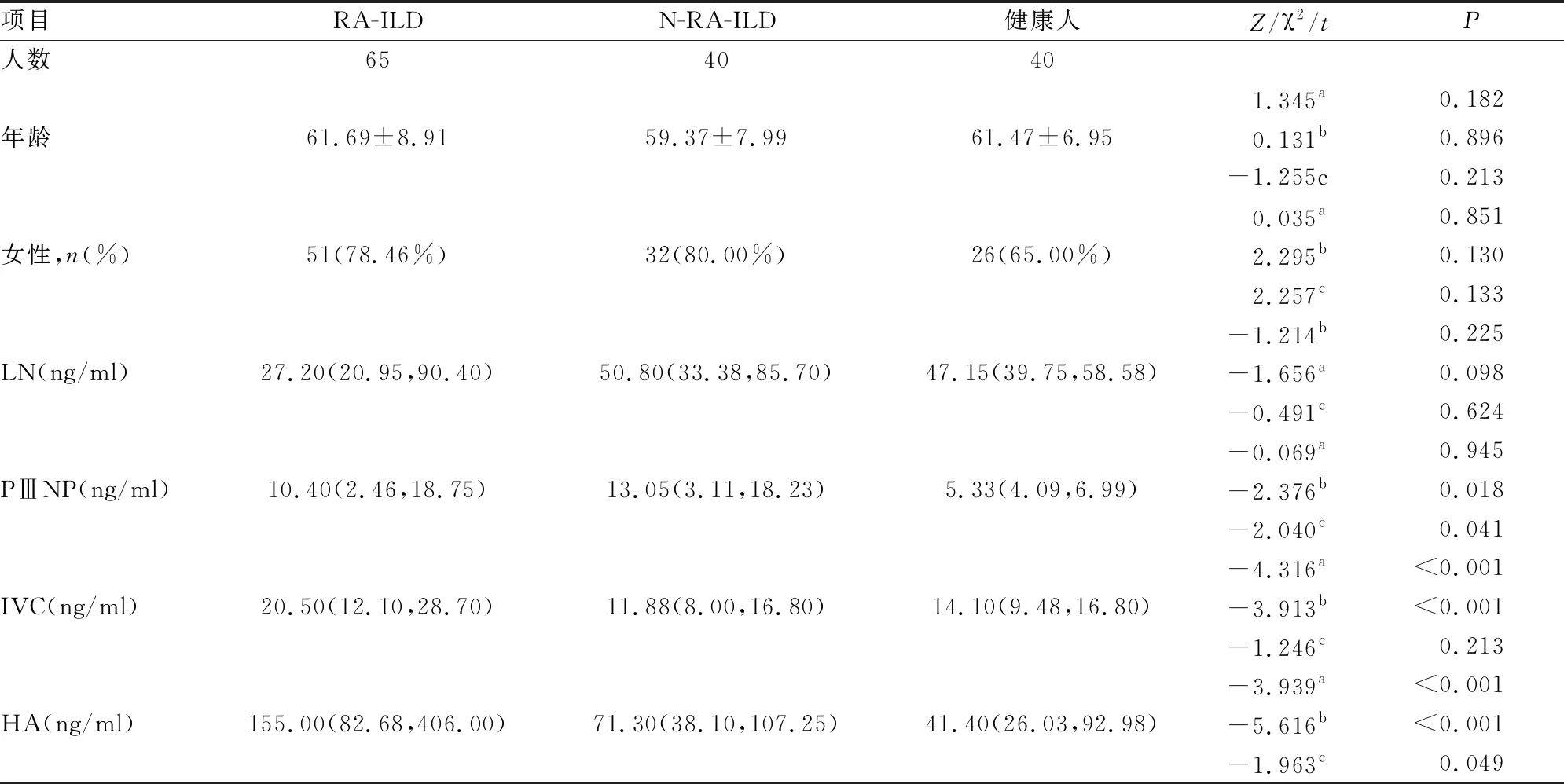
表1 三组患者血清LN、PⅢNP、IVC、HA水平的比较
二、RA-ILD组与N-RA-ILD组患者一般资料与临床特征
RA-ILD组与N-RA-ILD组患者吸烟史、病程、DMARDs药物应用、激素和/或DMARDs应用、关节肿胀数、晨僵时间比较,差异无统计学意义(P>0.05);两组患者初治时的病程、激素应用及关节压痛数、DAS28评分比较,差异有统计学意义(P<0.05), RA-ILD组多于N-RA-ILD组(见表2)。
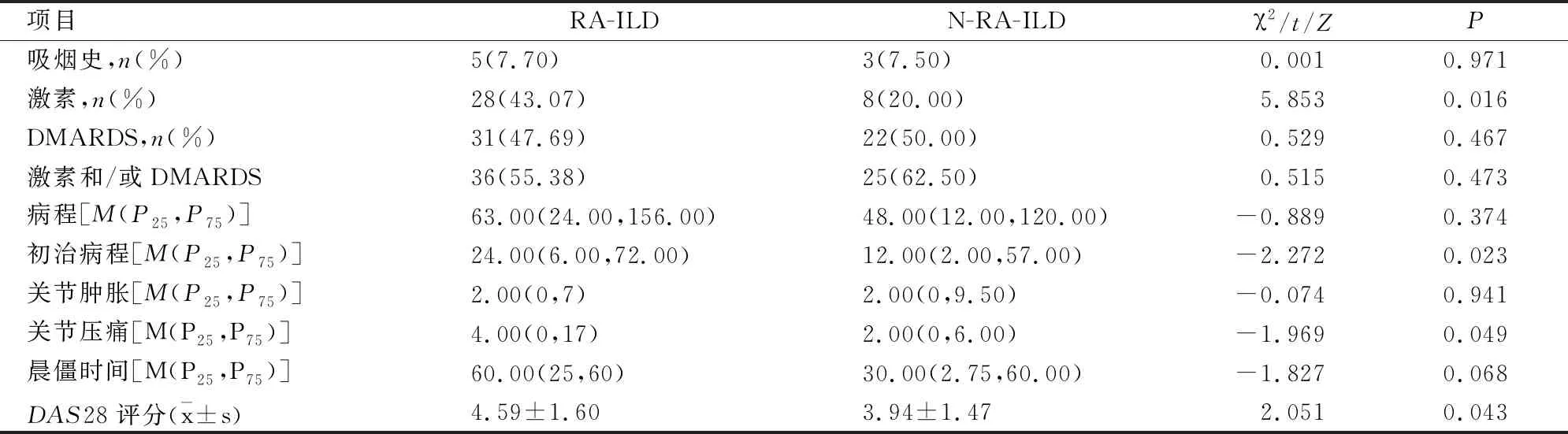
表2 两组患者一般资料与临床特征
三、两组患者免疫学指标比较
RA-ILD组比N-RA-ILD组RF滴度高,差异有统计学意义(P<0.05);两组ESR、CRP、IgA、IgM、IgG比较,差异无统计学意义(P>0.05)(见表3)。
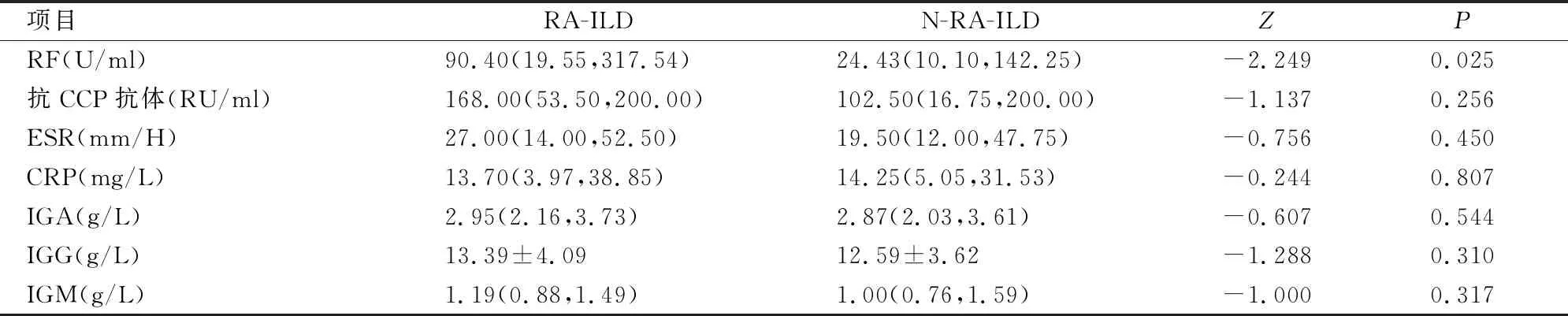
表3 两组患者免疫学指标比较
四、RA-ILD的多因素二元Logistic回归分析
将初治病程、关节压痛数、DAS28评分、RF、IVC、HA等单因素分析中差异有统计学意义的指标做自变量(赋值说明:均为连续变量)。以是否继发ILD为因变量(RA-ILD为1,N-RA-ILD为0)进行多因素二元Logistic回归分析。结果显示,初治病程较长、RF、IVC、HA水平较高是RA-ILD发病的独立风险因素(见表4)。
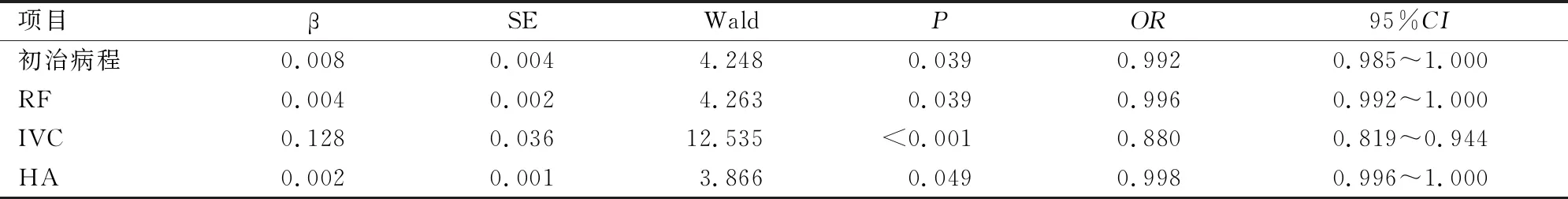
表4 RA-ILD的多因素二元Logistic回归分析
五、RA-ILD患者血清IVC、HA与临床及实验室指标的相关性
RA-ILD患者血清IVC与年龄、IgG呈正相关(P<0.05),与激素、激素和/或DMARDS、DMARDS药物应用负相关(P<0.05),与病程、初治病程、RF、抗CCP抗体、IgA、IgM、ESR、CRP、关节肿胀数、关节触痛数、晨僵时间、DAS28评分均无关(P>0.05)。HA与年龄、CRP、DAS28评分正相关(P<0.05),与病程、初治病程、抗CCP抗体、RF、IgA、IgM、IgG、关节肿胀数、关节触痛数、晨僵时间、激素、激素和/或DMARDS、DMARDS药物应用均无关(P>0.05)(见表5)。
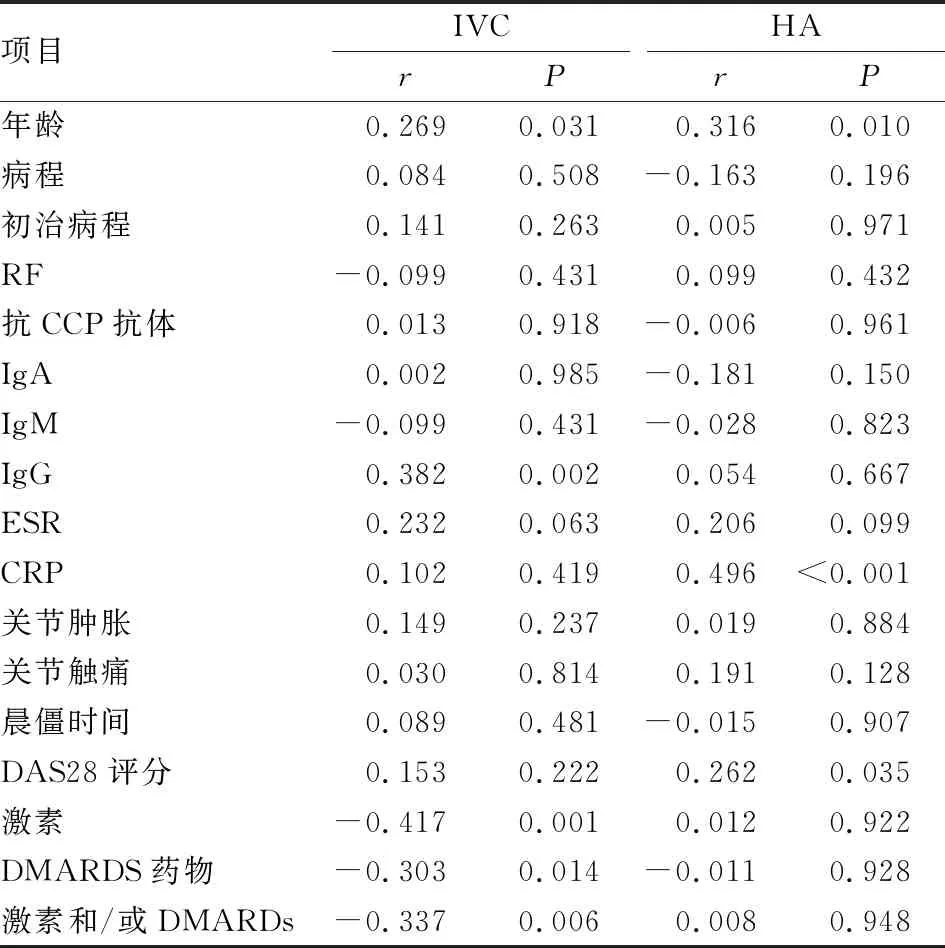
表5 IVC、HA与RA临床及实验室指标相关性分析
讨 论
RA-ILD起病隐匿,早期可无任何症状,造成漏诊延误治疗,发病后进展率较高,预后差,死亡率较高。因此寻找合适的血清学标记物,对RA-ILD早期预防、疾病诊断等都具有重要意义。LN、PⅢNP、IVC、HA是细胞外基质重要组成成分。有研究发现,与健康体检人群对照,CTD-ILD及IPF患者血清中LN、PⅢNP、IVC、HA表达明显增强[6]。本研究着重探究LN、PⅢNP、IVC、HA在RA-ILD的表达水平及其影响因素,发现相较于N-RA-ILD患者及健康体检者,RA-ILD患者血清IVC、HA水平明显增高。研究还表明N-RA-ILD患者PⅢNP、HA水平也高于健康体检者,提示N-RA-ILD患者继发ILD的几率可能仍较正常人高。
在细胞外基质中,LN是含有α,β和γ亚基的糖蛋白,在维持组织完整性和细胞分化、迁移和粘附中起着重要作用[9]。转化生长因子-β1((transforming growth factor-β1,TGF-β1))过表达在体内及体外引起进展性肺纤维化,在TGF-β1诱导的肺纤维化中,可引发LN各亚型表达异常[10]。有研究显示层粘连蛋白α1(Lama)是TGF-β1反应的一个调节因子,在TGF-β1诱导的肺纤维化中起着关键作用[11]。而Lamα3在肺纤维化患者肺纤维化区的正常基底膜组织的丢失是导致其疾病进展的原因之一[12]。这提示尽管LN各亚型表达异常与肺纤维化发病及进展相关,但在ILD中的总表达并不一定是升高的。
PⅢNP主要分布在肺泡间隔和间质增厚处组织细胞外间隙,Ⅲ型胶原单体聚集成大分子纤维,聚集成纤维,为需要抗拉强度的组织提供强有力的支撑结构[13]。PⅢNP在ILD中的表达也是有争议的,Milman等[14]发现ILD患者血清PIIINP水平与健康人相似。而苏等[6]人则发现LN在CTD-ILD及CTD-IPF中高表达。Merl-Pham等[10]则认为PIIINP的表达和分泌增高也并不一定导致其在ECM中沉积更多。因此,PIIINP在RA-ILD疾病中的作用还需更深入研究。
IVC构成肺泡和气道基底膜的大部分,在上皮和血管形成、肺泡间隔成纤维细胞增殖、分化和迁移过程中具有重要作用[15]。与本研究一致,多项研究表明IVC在IPF或ILD患者血清中表达增强[6,10]。IVC可能作为RA-ILD诊断的血清标记物之一。HA是一种广泛表达的糖胺聚糖,其分子量大小不同功能也不同[16];HA在1mg/ml或更高剂量下,抑制炎症细胞趋化、吞噬、弹性蛋白酶释放的作用。小分子HA由LMW HA(<500~700 kDa)和小得多的HA寡糖(8-30二聚体长度)组成,可增加巨噬细胞和肺损伤后肺泡巨噬细胞中促炎趋化因子和iNOS的表达,促进炎症反应。由此可见,HA是一个与炎症密切相关的指标,对肺部的损伤修复都敏感。本研究发现RA-ILD患者血清HA表达显著增强,提示其在ILD发生发展中可能具有重要意义。
本研究还发现,初治时的病程较长、关节压痛数多、DAS28评分高也是RA-ILD发病风险因素,临床上遇到此类患者应当注意。相关性分析显示年龄、CRP、DAS28评分与HA呈正相关,年龄、IgG及与IVC呈正相关,应用激素或DMARDs患者血清IVC较低,提示尽早抑制免疫炎症反应可能会延缓RA-ILD发生及进展。但同时也应注意,激素和/或DMARDS药物也有可能导致药物性ILD的发生[17-18]。因此定期监测RA-ILD患者血清IVC及HA水平,如发现这二者的水平持续增高,提示可能有向ILD进展的可能,采取积极应对措施,可能会避免药物性ILD的发生,改善其预后。
综上所述,IVC及HA水平高的RA患者继发ILD的风险较大,有用于RA-ILD疾病诊断的临床价值。临床上遇到 IVC、HA、RF高、初治病程长的患者,应予以重视,其进展为RA-ILD的可能性较大。IVC及HA具有廉价、无创、易采集等优点,建议临床上对这些高危人群以及确诊RA-ILD的人群定期检测IVC及HA,识别出发病风险高得人群,提高RA-ILD的检出率,进行早预防、早诊断、早治疗、病情追踪等,对改善患者预后将具有重大意义。

