体外微核试验方法的建立及其在医疗器械检测中的应用
伍锡栋 张俊明 朱思睿 周艳艳 林引花 孙英朔
1 江西省医疗器械检测中心检测四室 (江西 南昌 330000)
2 南昌大学药学院 (江西 南昌 330000)
内容提要: 目的:对体外哺乳动物细胞微核试验方法进行探索建立,并对聚氯乙烯(PVC)材质医疗器械的遗传毒性进行检测。方法:依据GB/T16886.3-2019和YY/T0870.6-2019等相关方法对样品进行体外哺乳动物细胞微核试验方法的探索建立,按照GB/T16886.12中规定的浸提比例(0.2g/mL)浸提样品,采用建立的微核试验方法检测样品有代谢性活化体系(3h)和无代谢性活化体系(3h、24h)的微核发生率(%)。结果:显微镜观察100%、50%、25%和12.5%样品浸提液均不超过20%的细胞呈圆缩、疏松贴壁、无胞浆内颗粒或显示形态学方面的改变,偶见细胞溶解,仅观察到轻微的细胞生长抑制现象,判定细胞毒性为1级,MTT结果显示100%、50%、25%和12.5%样品细胞毒性不超过2级。代谢性活化体系(3h)样品微核率为2.30%,与阳性对照微核率(15.70%)具有显著性差异(P<0.01);无代谢性活化体系(3h)样品微核率(0.90%),与阳性对照微核率(8.10%)具有显著性差异(P<0.01);无代谢性活化体系(24h)样品微核率(1.55%),与阳性对照微核率(11.80%)具有显著性差异(P<0.01);CBPI结果表明样品与阴性对照组细胞毒性相当,即细胞毒性为1级,与体外细胞毒性结果相符合。结论:通过上述试验方法建立的代谢性活化体系和无代谢性活化体系体外哺乳细胞微核试验结果稳定、可靠,对样品引起的遗传毒性的风险评价提供可行的检测试验方法。
聚氯乙烯(Polyvinyl Chloride,PVC)是由氯乙烯单体在过氧化物等引发剂或者光热条件下聚合而成的高分子聚合物,是世界上最早实现工业化的合成树脂之一,具有加工方便、可消毒、柔软、耐压等优良特性,被广泛应用于日常生活。根据数据显示,2018年我国医用塑料市场消费中PVC的用量占比高达28%,以PVC为材料的医疗器械普遍使用。PVC材质的医疗器械会与人体接触,所以需要格外注意其生物安全性[1]。微核是一种由于外来有害物质(药物、化学物质、射线等致变因子)作用于间期细胞使染色体断裂或整条染色体从纺锤体脱落,胞浆中出现与主核脱离的核物质。因其大小较主核小,故而称为微核。微核率的增高在细胞水平上提示染色体受损,因此,微核试验是现今广泛应用的检测遗传毒性损伤的常规方法之一[2]。本课题通过对GB/T16886.3-2019和YY/T0870.6-2019的探究,建立体外哺乳细胞微核试验方法,并检测PVC材质医疗器械的体外细胞毒性与遗传毒性,对其可能的细胞毒性风险点进行控制和分析,以提高产品质量和安全性。
1.材料与方法
1.1 一般材料
实验起止时间为:2021年12月~2022年5月。
细胞与试剂:CHL细胞和L929细胞(来源于中国科学院典型培养物保藏委员会细胞库);MEM培养基(Gibco公司,批号:2085588);胎牛血清(Excell公司,批号2261480CP);0.25%胰蛋白酶EDTA消化液(Solarbio公司,批号:20210717);100×青链霉素混合液(Solarbio公司,批号:20210625)等。
仪器设备:恒温培养摇床(KYC-1102C),二氧化碳培养箱(CLM-170B-8-NF),倒置生物显微镜(AE31),电子天平(JY2003),自动细胞计数仪(IC1000),压力蒸汽灭菌器(DSX-280KB24),全自动酶标仪(ELx800),数字病理扫描仪(APERIO CS2),生物显微镜成像系统(ECLIPSE Ci-L)等。
1.2 方法
1.2.1 浸提液制备
体外细胞毒性浸提液制备:无菌操作取样品,剪碎并加入10%胎牛血清培养液,按0.2g:1mL的浸提比例,37˚C放置24h,即得100%试验液。同批浸提介质,37˚C放置24h,作为空白对照液;取高密度聚乙烯,用超纯水洗净晾干,紫外线照射过夜,按0.2g/mL的比例加入同批浸提介质37˚C浸提24h,作为阴性对照液;取0.8mLDMSO加入到7.2mL同批浸提介质中即得10%DMSO,37˚C放置24h,作为阳性对照液。
体外微核试验浸提液制备:无菌操作取样品,加入无血清的1640培养液(浸提比例:0.2g:1mL),(37±1)˚C浸提(72±2)h,即得代谢性活化体系用样品试验液;无菌操作取样品,加入含10%胎牛血清的1640培养液(浸提比例:0.2g:1mL),(37±1)˚C浸提(72±2)h,即得无代谢性活化体系用样品试验液;选用同批号试验样品浸提介质,不加试验样品,(37±1)˚C浸提(72±2)h即得阴性对照液;无外源性代谢活化系统用丝裂霉素C作为阳性对照液,有外源性代谢活化系统用环磷酰胺作为阳性对照液。
1.2.2 体外细胞毒性试验
将已培养48~72h生长旺盛的细胞用消化液消化后加入细胞培养基,吹打混匀计数后将细胞悬液配制成密度l×l05个/mL接种于96孔板。在96孔板试验区外围(如第1列和第7列、第1行和第8行)每孔加入0.1mL无细胞的含10%胎牛血清培养液,剩余中间每孔接种0.1mL上述制备好的细胞悬液。置CO2培养箱培养24h(37˚C,5%CO2)。24h后,弃去加入细胞孔的原培养液,其中12孔加入空白对照液作为空白对照,6孔加入阴性对照液,6孔加入阳性对照液,其余6孔加入供试液,置CO2培养箱继续培养24h。24h后,显微镜下观察,记录细胞形态学改变。然后弃去测试孔培养液,每孔加入50μL 1mg/mL的MTT溶液(用MEM新鲜配置,0.22μm过滤后使用),37˚C孵育2h后弃去所有孔内液体,加入0.1mL异丙醇,置振荡器上振荡10min,在酶标仪上双波长(570nm、630nm)测定吸光度,按公式(1)计算细胞存活率。
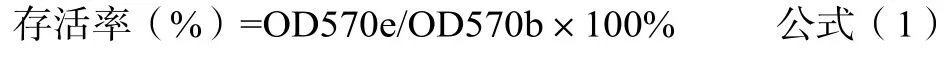
注:OD570e——试样样品浸提液光密度平均值;OD570b——空白光密度平均值。
1.2.3 体外哺乳细胞微核试验
试验分为短期接触组(代谢性活化体系3h和无代谢性活化体系3h)和长期接触组(无代谢性活化体系24h);将浓度为2.5×105的细胞接种于60mm培养皿内,置于5%CO2培养箱内培养24h,保证细胞在收获期处于对数生长状态;吸去培养皿中培养液,在处于对数生长状态的细胞中加入一定浓度受试物、S9混合液(不加S9混合液时,需要培养液补足)以及一定量不含血清的培养液,置于培养箱中处理3h;吸去培养皿中液体,用PBS等渗洗涤3次,换液后,按1%的比例加入3μg/mL细胞松弛素CytoB的新鲜细胞培养液继续培养至24h;染毒培养体系配制方案见表1。

表1.染毒培养体系配制方案(mL)
1.2.3.1 收获细胞与制片
用胰蛋白酶消化细胞,待细胞脱落后加入含血清的细胞培养终止胰蛋白酶作用,混匀,放入离心管200g,5~7min离心弃上清;加入0.075mol/L氯化钾溶液5~7mL,用滴管将细胞轻轻地吹打混匀,放入37˚C水浴中低渗处理10~20min,加入1~2mL固定液(甲醇:冰乙酸=3:1),以200g,离心5~7min,弃上清;加入5~7mL固定液,混匀后固定10~20min,以200g离心5~7min,弃上清,同法固定1~2次,弃上清;加入数滴新鲜固定液,混匀,将混悬液滴于冰水预冷的载玻片上,自然干燥;将滴片用姬姆萨染色液,晾干备用。
1.2.3.2 试验结果观察
每一试验组至少分析计数2000个分散良好的双核细胞;当采用2个平行皿时,将2000个分散良好的双核细胞均一分配。
1.3 数据处理
体外细胞毒性试验以下条件均满足时,试验成立:①空白对照组平均OD≥0.2;②左/右两边空白对照组存活率之差≤15%;③阴性对照组和阳性对照组均出现预期结果。按照GB/T 14233.2-2005细胞毒性试验标准进行分级,标准见表2。

表2.GB/T 14233.2-2005细胞毒性试验标准分级
评价双核细胞的微核发生率,报告对一个或多个微核发生记录,但不强行规定进行统计分析;采用胞质分裂阻断增殖指数(Cytokinesis Block Proliferation Index,CBPI)来评价细胞体系的细胞毒性,计算见公式(2)。
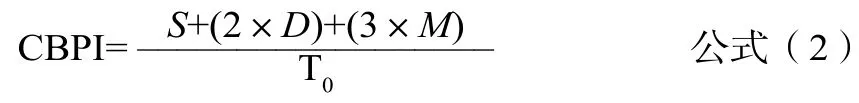
式中:S——单个核细胞数,D——双核细胞数,M——多核细胞数,T0——细胞总数。
2.结果
2.1 体外细胞毒性结果
显微镜观察100%、50%、25%和12.5%样品浸提液均不超过20%的细胞呈圆缩、疏松贴壁、无胞浆内颗粒或显示形态学方面的改变,偶见细胞溶解,仅观察到轻微的细胞生长抑制现象,判定为细胞毒性1级,MTT结果显示100%、50%、25%和12.5%样品细胞毒性均为不超过2级。结果见图1、表2和表3。
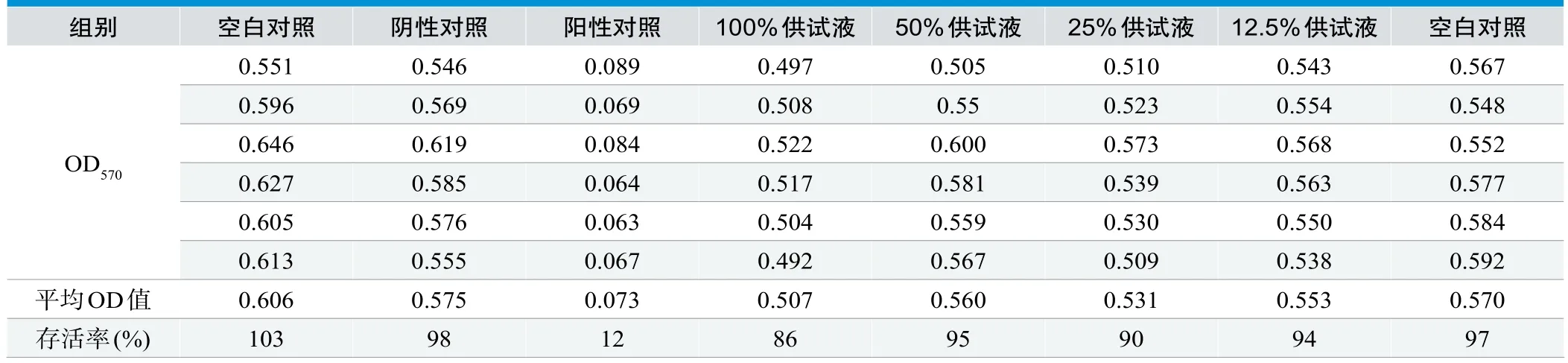
表3.体外细胞毒性试验评价样品对细胞增殖率的影响

图1.体外细胞毒性显微镜观察结果
2.2 体外哺乳细胞微核试验
代谢性活化体系(3h)样品微核率为2.30%,与阳性对照微核率(15.70%)具有显著性差异;无代谢性活化体系(3h)样品微核率(0.90%),与阳性对照微核率(8.10%)具有显著性差异;无代谢性活化体系(24h)样品微核率(1.55%),与阳性对照微核率(11.80%)具有显著性差异;CBPI结果表明样品与阴性对照组细胞毒性相当,即与显微镜观察法判定细胞毒性相符合。试验结果见图2、表4和表5。

表4.有代谢性活化体系和无代谢性活化体系样品微核率

图2.微核鉴别实例图
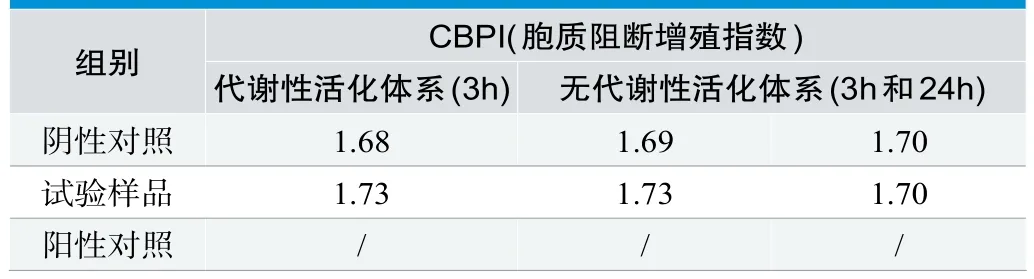
表5.有代谢性活化体系和无代谢性活化体系CBPI
3.讨论
PVC因为性能稳定、价格低廉而广泛应用于医疗器械领域。PVC需要根据使用的需求不同而加入不同比例的增塑剂、热稳定剂、色素等添加剂,但是因为添加剂的使用会造成一定的生物毒性,对人体健康造成危害。在PVC材料加工时增塑剂和热稳定剂的使用量最大。细胞毒性试验是一种在体外借助相关的细胞,模拟细胞生长环境,具有广泛的通用性,在医疗器械的生物学评价中作为常规评价方法之一,是对医疗器械生物学评价的重要指标之一。该方法能在快速检测供试品或其浸提液对细胞的影响,能大批量筛选样品并快速反应毒性物质的敏感性。该方法具有易标准化、可操作性强、结果具有很强的实验室间比对性等特点,能为是否进行下一步生物学评价提供直接的参考依据。然对PVC材质的医疗器械其安全性评价多是零散或者不成体系的,尤其是遗传毒性的评价更是鲜见,而体外微核试验由于其可以简便、快速、准确地检测出断裂剂和非整倍体诱导剂故广泛被应用于化合物遗传毒性筛选及评价[3,4]。
欧洲替代方法验证中心(European Centre for the Validation of Alternative Methods,ECVAM)进行了相关的验证,认为体外微核试验是一种重现性好,精确度高的染色体畸变试验的替代方法,并于2008年发布了体外微核试验可以替代体外染色体畸变试验用于遗传毒性检测的指导原则[5,6]。之后经济合作与发展组(Organization for Economic Cooperation and Development,OECD)和国际协调委员会(International Conference on Harmonization,ICH)也将体外微核试验这一方法列入指导原则TG487和S2R[7]。体外微核试验是以微核作为遗传毒性检测终点,通过加入细胞松弛素B使胞质分裂受阻,形成双核细胞,表明观察的细胞经过一次有丝分裂,如果受试物是染色体断裂剂或非整倍体诱发剂,就可能在双核细胞中出现微核。此方法解决了不同细胞分裂不同步的问题,使微核试验结果灵敏度、准确性更高,并有助于实现微核试验标准化流程的建立[8,9]。本课题通过复现GB/T16886.3-2019和YY/T0870.6-2019等相关标准内容,对PVC材质的医疗器械进行体外细胞毒性初步评价并建立体外哺乳动物细胞微核试验方法。对怀疑有细胞毒性反应的试验样品应进行体外细胞毒性与预试验,目的为了避免最高浓度的试验样品或浸提液产生假阳性结果,如产生过度的细胞毒性、在细胞培养液中处出现沉淀或者pH和渗透压发生显著变化,另在有或无代谢活化的情况下,使用适当的细胞死亡和生长指标来确定细胞毒性,以确保有足够数目的细胞处于有丝分裂状态。本项目对样品体外细胞毒性显微镜观察法中显示100%、50%、25%和12.5%样品浸提液均不超过20%的细胞呈圆缩、疏松贴壁、无胞浆内颗粒或显示形态学方面的改变,偶见细胞溶解,仅观察到轻微的细胞生长抑制现象,判定细胞毒性为1级,且MTT检测结果与此相当,与体外哺乳动物细胞微核试验中的CBPI评价细胞毒性结果相符合。在体外哺乳动物细胞微核试验中代谢性活化体系(3h)样品微核率为2.30%,与阳性对照微核率(15.70%)具有显著性差异(P<0.01);无代谢性活化体系(3h和24h)样品微核率(0.90%和1.55%),与阳性对照微核率(8.10%和11.80%)具有显著性差异(P<0.01)。通过此项目研究建立的代谢性活化体系和无代谢性活化体系体外哺乳细胞微核试验结果稳定、可靠,对样品可能引起的遗传毒性的风险评价可提供检验检测试验依据和方法。

