浅谈医用敷料类产品的分类管理和规范发展
吴志生 赵紫伶 田冬娜
1 泰州医药高新技术产业开发区新药申报中心 (江苏 泰州 225300)
2 苏州工业园区药品管理中心 (江苏 苏州 215000)
内容提要: 近些年医用敷料行业迅猛发展,新材质、新用途的产品不断涌现,却也滋生了一些诸如分类不规范、虚假宣传等行业乱象。基于此,本文总结现阶段医用敷料类产品的分类管理现状,分析医用敷料行业发展中遇到的问题及面临的挑战,并提出医用敷料类产品的监管建议,以期为相关管理部门和从业人员提供参考。
医用敷料类产品广泛使用于医疗卫生领域,是医疗器械行业领域的重要分支。近些年来,随着我国医疗技术的快速发展、医疗设施的加速建设以及人民群众对健康需求的日益提升,医用敷料行业的市场需求不断增长,我国医用敷料行业迎来了快速增长期。然而,行业高速发展的同时,各种疑难问题和行业乱象亦随之而来。现阶段我国医用敷料行业的发展存在着一些不规范问题,例如:非医疗器械注册(或备案)成医疗器械,高类别医疗器械批准(或备案)成低类别的医疗器械,“医美面膜”“械字号面膜”等违规产品在线上平台的大量销售等。因此,医用敷料类产品亟需加强监管,行业的规范发展需引起有关管理部门、相关生产经营企业的高度重视。
1.医用敷料的基本情况
1.1 种类和用途
医用敷料是一种用于覆盖疮、伤口或其他损害的医用卫生材料,属于无源医疗器械,如生活中常见的创口贴、医用纱布等。根据现行法规文件,医用敷料可分为外科敷料、创面敷料、包扎敷料、疤痕敷料等,其用途包括防术后粘连、保护伤口、创面护理、吸收分泌物、止血、包扎、固定等[1]。
1.2 产业现状
随着我国在生物医用材料、组织医学工程等领域的快速发展,医用敷料类产品不断推陈出新,多功能、新材质的医用敷料不断涌现,我国的医用敷料产业的发展态势良好,连续几年高速增长,在2019年的市场规模已经达到73.12亿元[2]。
2.医用敷料的分类界定
分类界定是对产品管理属性和风险程度的评估,也是医疗器械上市前监管的一项重要工作,决定了医疗器械产品的监管层级。
2.1 分类界定工作程序
国家药监局医疗器械标准管理中心(以下简称“标管中心”)、省级药品监督管理部门(以下简称“省局”)是分类界定工作的主要管理部门。其中,境内产品的分类界定向所在地省局申请,省局对管理属性和分类明确的产品直接告知申请单位,对管理属性和分类不明确的产品提出预分类界定意见并上报标管中心进一步界定。标管中心负责对进口及港澳台产品的分类界定申请和省局出具预分类界定意见的分类界定申请组织研究审查,并将界定结果告知申请单位,具体工作程序如图1所示[3]。
2.2 界定依据
我国对医疗器械的分类管理制定了一系列的规范文件,以帮助企业和有关管理部门判定产品的属性和分类,涉及医用敷料类产品的分类界定文件如表1所示。在产品申请注册(或进行备案)前,申请人应当依据表1的分类界定文件,经综合分析,准确判定产品的管理属性和管理类别;对实在难以确定管理属性和管理类别的产品,申请人可按照分类界定工作程序(图1)向有关部门提出分类界定申请。需要注意的是,分类界定工作文件对于同类产品的界定出现不一致的时候,一般以时间最晚发布的文件为准。此外,由于一类、二类产品在各省备案、注册的标准不尽相同,加上《医疗器械分类目录》(以下简称《分类目录》)的动态调整,已上市的同类产品仅作为判定的参考,一般不作为主要依据。
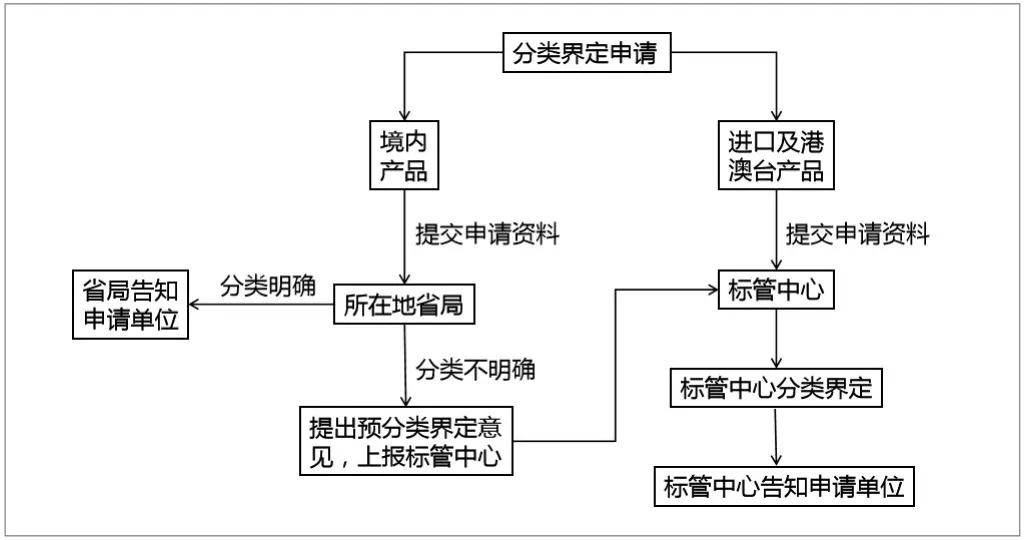
图1.医疗器械分类界定工作流程

表1.医用敷料分类界定依据(现行)
2.3 分类界定要点
根据上述分类界定文件,判定医用敷料的管理属性和管理类别主要有以下几个关注点:①提供形式。非无菌提供的医用敷料与无菌提供的医用敷料在分类上一般不同,医用敷料若以无菌形式提供,管理类别为第二类或第三类[4]。②组成成分。医用敷料产品所含成分可被人体全部或部分吸收,管理类别为第三类;所含成分不可被人体吸收,管理类别为第一类或第二类;以重组胶原蛋白为主要成分的医用敷料,管理类别不低于第二类[4,5]。③作用机制。医疗器械主要通过物理的方式发挥作用,假如医用敷料产品含有药理学作用的组分,并通过医疗器械的物理作用和药理学作用共同实现预期用途,按照药械组合产品管理,药械组合产品若以医疗器械的作用为主,管理类别为第三类[4]。④预期用途。不同用途的医用敷料的管理类别通常不一样。医用敷料如果有以下情形,按照第三类医疗器械管理,包括:预期具有防组织或器官粘连功能,作为人工皮肤,接触真皮深层或其以下组织受损的创面,用于慢性创面[4]。
2.4 涉及医用敷料的目录调整
现行的《分类目录》于2017年9月发布,设置了22个子目录,医用敷料归属于《分类目录》中的“14注输、护理和防护器械”。现行《第一类医疗器械产品目录》[6](以下简称《一类目录》)于2021年12月发布,在涉及医用敷料类产品上,相较于过去删除了非无菌提供的“液体、膏状敷料”。2022年3月22日,国家局对《分类目录》的部门内容进行调整,决定对非无菌提供的“液体、膏状敷料”的管理类别由第一类调整为第二类。至此,无菌提供与非无菌提供的“液体、膏状敷料”的管理类别均不低于第二类,现行《一类目录》[6]里按照第一类医疗器械管理的医用敷料只剩非无菌提供的“14-10-02创口贴”“14-11-01绷带”“14-11-02胶带”。
2.5 常见热门敷料的管理
2.5.1 透明质酸敷料
透明质酸(又称玻尿酸)是一种葡聚糖醛酸,通常以钠盐形式存在(即透明质酸钠),广泛存在于人体胎盘、皮肤真皮层等组织。目前的法规文件中,按照医疗器械管理的含透明质酸(或透明质酸钠)的医用敷料(简称“透明质酸敷料”),仅限于《分类目录》中管理类别为第三类的“透明质酸钠凝胶(分类编码:14-08-02)”,用于防术后粘连[1,7]。近些年,不少企业和研究机构开发了透明质酸钠敷贴、透明质酸钠液体敷料等皮肤修复产品,并声称用于面部激光、光子嫩肤等术后皮肤或浅表性创面的保护、护理。但这类产品在标管中心公示的分类界定结果里(2018-2020年)通常界定为非医疗器械。然而,随着新技术的发展以及各界对透明质酸钠认识的加深,目前科研界普遍认为当透明质酸钠应用于医用敷料时,其作用原理主要为物理作用。为此,国家局对2009年发布的《关于医用透明质酸钠产品管理类别的公告》(2009年第81号)进行了修订,于2022年5月发布《关于医用透明质酸钠产品管理类别的公告》(修订草案征求意见稿),对医用透明质酸钠产品的管理进行了完善,并提出医用透明质酸钠产品作为医用敷料(主要为创面敷料)应用时,管理类别为第二类或第三类。可见,随着认知的提升,未来透明质酸(或透明质酸钠)或将可应用于创面敷料。
2.5.2 含抗菌成分的医用敷料
随着科学研究和技术创新的发展,为进一步满足临床需求,不少企业和科研机构开始将抗菌物质与医疗器械结合,开发了一类含抗菌成分(如茶树油、多肽、水杨酸、银离子等)的医用敷料,如已列入《分类目录》的“14-10-13含银敷料”[1]。对尚未列入《分类目录》的含抗菌成分的产品,若产品仅通过抗菌作用(即药理学作用)实现预期用途,不具有医疗器械作用的,不作为医疗器械管理;若含抗菌成分的产品兼具医疗器械作用和药品作用,按照药械组合产品管理,药械组合产品应进一步判定管理属性:若产品主要以抗菌作用为主,医疗器械作用为辅,按照药品注册申报要求申请注册;若产品主要通过医疗器械作用(如提供愈合环境、保护伤口等)实现其预期用途,抗菌为辅助作用,按照第三类医疗器械注册申报要求申请注册。需要注意的是,壳聚糖能够发挥抗菌作用,除列入《分类目录》的“含壳聚糖敷贴”“含壳聚糖纤维敷料”“壳聚糖止血海绵”“壳聚糖防粘连液”“壳聚糖防粘连膜”等产品外,其他医用敷料类产品若添加了壳聚糖,在判定时候需考虑是否发挥抗菌作用[1]。
2.5.3 胶原蛋白敷料
胶原蛋白是人体内固有的一种功能性蛋白。近些年,胶原蛋白成为研究的热门分子,不少企业和研究机构开始将胶原蛋白应用于医用敷料。目前,已列入《分类目录》的含胶原蛋白的敷料(简称“胶原蛋白敷料”)包括:“14-08-01可吸收外科止血材料”中含胶原蛋白成分的产品,例如,胶原蛋白海绵、微纤维止血胶原(海绵)、医用胶原膜;“14-10-10生物敷料”“14-10-14胶原贴敷料”中的产品[1]。同时,《分类目录》内的胶原蛋白敷料产品的管理类别均为第三类。在制备方法上,胶原蛋白主要由动物组织及同种异体组织制备,或利用DNA重组技术制备(即重组胶原蛋白)。近几年重组胶原蛋白类产品不断涌现,为适应产业发展和监管工作需要,国家局发布了《重组胶原蛋白类医疗产品分类界定原则》[5]。其中,作为止血和防粘连材料、医用敷料应用时,根据所含成分是否被人体吸收、使用部位,判定为第三类或第二类。
2.6 关于“械字号面膜”
随着医疗美容行业的持续走红,在美容市场上出了一类叫“医美面膜”“械字号面膜”的产品,并在线上平台上销售。然而,这类产品本质上是按照医疗器械管理的医用敷料,具有医疗器械注册证,与按照化妆品管理的面膜产品不同,两者在功效上的区别较大,只是在结构组成上的相似度较高。一些商家宣称“医美面膜”“械字号面膜”的护肤功效比生活中常见的普通面膜更加优越并无相关的临床依据。关于这类产品,国家局已在官网发布科普,指出“械字号面膜”是伪概念。因此,“医美面膜”“械字号面膜”等商品名称均是不规范的,属于虚假宣传。商家售卖的这些“面膜”属于医疗器械,而在超市、电商平台售卖的普通面膜属于化妆品,两者的管理属性不同。
3.面临的问题和挑战
3.1 产品分类的不规范现象突出
不同类别的医疗器械产品,其上市的行政管理部门不同,而不同管理部门的监管手段、力度、方式以及监管人员的知识水平不尽相同,导致在我国存在着相同的医疗器械产品而分类不同、非医疗器械产品作为医疗器械管理等不规范现象。尤其是医用敷料,由于所含成分对产品的分类界定影响较大,企业私自添加违规成分以及一类产品在备案过程中结构组成(或组成成分)表述不清等情况较多,导致这类产品分类不规范的现象更加突出。
3.2 分类界定的文件体系不完善
过去,我国为规范医疗器械的分类管理制定了一些分类界定文件,但是这些文件在指导医用敷料类产品分类界定过程中存在着一些不足,例如:目录相关产品为无菌(或非无菌)提供,而申请界定的同类产品为非无菌(或无菌)提供,对于由提供形式的变化引起的管理类别变化该如何判定缺少相关规定,有些省份进行降类(或升类),有些省份保持类别不变;防腐剂一般具有抑菌作用,但现有法规文件对于医用敷料添加防腐剂未作明确的规定,仅《分类目录》中“14-10-14胶原贴敷料”在产品描述上涉及防腐剂[1]。
3.3 网络销售监管的效能不足
随着互联网、计算机行业的兴起,医疗器械的网络销售亦逐渐兴起,并开始走进人们的生活。然而,新兴的商业模式也给监管工作带来新的挑战。相较于传统线下实体销售,医疗器械的网络销售横跨了互联网、医疗器械、电子信息等行业,使得监管更加复杂,难度也较高,加上过去我国医疗器械监管队伍缺乏对网络销售的监管经验,导致我国医疗器械的网络销售的监管相对滞后,监管的效能明显不足,进而滋生了网络销售不规范的现象。
4.监管建议
4.1 注重监管人员的知识培训
医用敷料涉及化学、药学、生物学、医学、材料学、组织工程学等多学科知识,随着产品技术的持续更新以及法律法规、技术标准的多次修订,医疗器械行业亟需更高从业素质的监管人员,既要掌握新法规的知识,又要研判新产品的属性、分类以及把握检查执法尺度。因此,建议相关部门应当注重监管人员的知识、业务培训,提升产品分类判定能力、技术审评能力和行政监管能力。
4.2 开展医用敷料类产品的清理规范工作
对医用敷料类产品分类不规范现象,建议相关部门应定期开展清理规范工作。应当对已备案、已注册的医用敷料类产品定期开展审核,统一备案、注册标准,重点检查是否存在非医疗器械作为医疗器械注册(或备案)、高类别医疗器械批准(或备案)成低类别医疗器械、产品的结构组成(或组成成分)表述不清等情况,对存在上述情况的产品进行整治和清理。
4.3 完善产品分类界定文件体系
定期对分类界定的法规文件进行更新,以适应分类界定和基层监督执法的工作需要,例如:可参照化妆品原料目录管理方式,设置医用敷料的原材料目录,以便让基层监管人员办理变更、备案等事项时有更加充分的依据;对产品由提供形式的变化引起的类别变化、医用敷料添加防腐剂的要求,出台相应的文件进行规范。
4.4 提升经营环节的监管效能
加强经营环节的监督抽查,重点检查经营企业是否按照要求进行运输和贮存;加强网络销售的监管,对“医美面膜”“械字号面膜”等违规产品进行清网行动,对网络销售的违法、违规行为进行严厉打击。必要时,监管部门可组织相关企业进行座谈,严格规范企业的销售推广行为,营造良好的医疗器械网络销售环境。
5.小结
新材料、新技术、新工艺的飞速发展为医用敷料行业带来发展机遇,新型高端医用敷料不断涌现,特别是为满足临床需求的新型药械组合敷料产品亦应运而生。随着我国对医用敷料类产品的监管趋于科学化和精细化,加上监管方和企业方的共同努力,医用敷料行业的发展将逐渐规范化,行业的生态环境也将进一步改善。

