血清IL-15 AAG水平与肺结核化疗患者预后的相关性
张天蔚, 彭 婷, 李永武, 王艳波, 钟业腾
(海南医学院第二附属医院检验科, 海南 海口 570311)
肺结核由结核分枝杆菌感染肺部而致,发病与病情进展均与促炎及炎性因子存在密切关系。目前,临床仍待探讨新型指标,以为肺结核患者预后评估提供指导。有研究指出,蛋白质参与机体物质交换、代谢、免疫等多种生理功能,对肺结核发病、治疗时药物靶点均有影响[1]。提示蛋白质可能与肺结核患者预后存在密切关系。此外,肺结核可诱发炎症级联反应,患者多项细胞因子水平出现变化。基于此,本研究选取急性时相反应蛋白α1-酸性糖蛋白(α1-Acid Glycoprotein,AAG)结合炎症因子白细胞介素-15(Inter Leukin-15,IL-15)作为研究指标,进一步探讨两者与肺结核化疗患者预后的关系,旨在指导临床合理评估肺结核化疗患者预后。
1 资料与方法
1.1一般资料:选择医院2017年2月至2019年2月收治221例肺结核患者,年龄22~46岁,平均(34.61±5.48)岁;男142例,女79例;病程2~6d,平均(4.72±1.14)d;吸烟史137例,饮酒史161例;合并气管支气管结核42例。本院伦理委员会批准研究的实施,患者及家属对研究的内容知情同意。
1.2入选标准:纳入标准:①均为活动性肺结核,符合有关诊断标准;②入组时尚未开始抗结核治疗;③行痰涂片镜检可见结核分枝杆菌或抗酸杆菌阳性,重复测量2~3次;④行胸部X线检查可见局限性或侵犯多肺段病变,呈增殖、渗出、纤维及干酪样病变,可伴钙化、空洞、支气管播散灶;⑤患者有咳嗽、咯血、低热等症状。排除标准:①近3个月服用过免疫调节剂的患者;②合并肺部肿瘤的患者;③合并肺纤维化、肺结节的患者;④合并免疫系统疾病的患者;⑤合并心、肝、肾功能等其他重要脏器相关疾病的患者。
1.3方法:基线资料及化疗治疗:采用自制调查表收集患者基线资料,包括年龄、性别、病程、吸烟史、饮酒史、合并气管支气管结核。气管支气管结核诊断:行支气管镜检查可见气管支气管病变,行痰涂片镜检可见结核分枝杆菌或抗酸杆菌阳性,行结核菌素试验呈现为阳性,支气管灌洗液支气管刷片阳性或抗酸染色阳性。患者均接受化疗治疗,前两个月实施强化期治疗,给予利福平、异烟肼、吡嗪酰胺、注射用链霉素进行化疗,强化期结束时,行痰涂片镜检,若仍为阳性,增加一个月强化期治疗。若阴性,进入巩固期治疗,持续六个月,给予利福平、异烟肼进行化疗。细胞因子水平检测:治疗2个月,采集患者空腹静脉血5mL,以3000r/min的速度离心10min,取血清,采用武汉华美CUSABIO公司提供的酶联免疫吸附试剂盒检测干扰素-γ(Interferon-γ,IFN-γ)、肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)、巨噬细胞移动抑制因子(Mi-Gration Inhibitory Factor,MIF)及IL-15水平。AAG水平:治疗2个月,采集患者空腹静脉血5mL,以3000r/min的速度离心10min,取血清,采用上海费玛生物科技有限公司提供的α1酸性糖蛋白诊断试剂盒检测血清AAG水平,检测方法为免疫比浊法。预后评估:记录患者治疗8个月后痰涂片镜检转阴状况,结合胸部X线检查评估患者预后,若痰涂片镜检转阴,再行胸部X线检查,若患者病灶吸收≥原病灶1/2,则可判定为预后良好,不满足则判定为预后不良。
1.4统计学方法:采用SPSS24.0处理数据。全部计量资料均经Shapiro-Wilk正态性检验,符合正态分布以表示,组间用独立样本t检验;百分比表示计数资料,用χ2检验;采用回归分析检验肺结核化疗患者细胞因子水平、AAG水平与预后的关系;绘制受试者工作曲线(Receiver Operating Curve,ROC),得到曲线下面积(Area Under Curve,AUC),检验肺结核化疗患者细胞因子水平、AAG水平对预后的预测价值,AUC值>0.9表示预测性能高,0.71~0.90表示有一定的预测性能,0.5~0.7表示预测性能较差;P<0.05为差异有统计学意义。
2 结 果
2.1肺结核化疗预后良好组与预后不良组基线资料、细胞因子水平、AAG水平比较:221例肺结核患者治疗8个月时,有152例(68.78%)病灶吸收≥原病灶1/2,为预后良好,有69例(31.22%)预后不良。肺结核化疗预后不良组治疗2个月IFN-γ、TNF-α、MIF、IL-15均高于预后良好组,治疗2个月AAG均低于预后良好组,见表1。
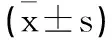
表1 肺结核化疗预后良好组与预后不良组基线资料细胞因子水平AAG水平比较
2.2回归分析检验各主要因子与肺结核化疗患者预后的关系:将肺结核化疗患者治疗2个月的各细胞因子水平、AAG水平作为自变量,将患者预后作为因变量(1=预后较差,0=预后良好),建立多元Logistic回归模型,结果显示,肺结核化疗患者治疗2个月IFN-γ、TNF-α、MIF、IL-15过表达,AAG表达下调均是患者预后不良的风险因子(OR>1,P<0.05),见表2。
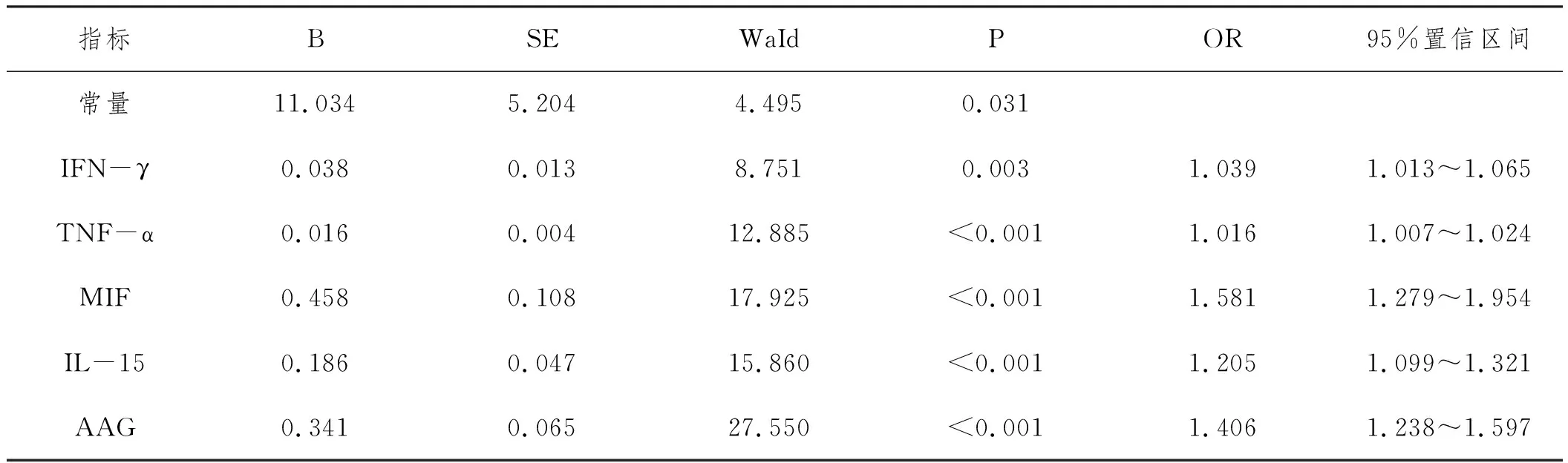
表2 回归分析检验各主要因子与肺结核化疗患者预后的关系
2.3肺结核化疗患者治疗2个月细胞因子水平、AAG水平预测预后风险的ROC结果:将肺结核化疗患者治疗2个月细胞因子水平、AAG水平作为检验变量,将患者预后作为状态变量(1=预后不良,0=预后良好),绘制ROC曲线(见图1~2)发现,肺结核患者治疗2个月IFN-γ、TNF-α、MIF、IL-15、AAG水平预测预后不良风险的AUC分别为:0.760、0.719、0.726、0.788、0.838,均>0.71,均有一定预测价值,且以AAG预测AUC最高,检验相关参数详见表3。
表3 治疗2个月细胞因子水平AAG水平预测肺结核化疗预后不良风险的ROC检验结果
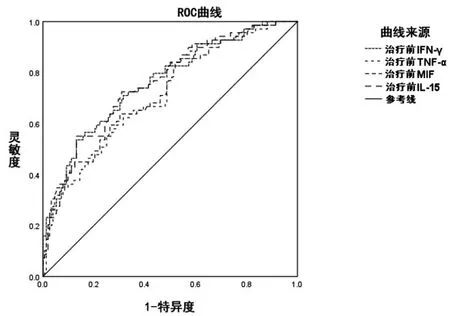
图1 治疗2个月细胞因子水平预测肺结核化疗预后不良风险的ROC曲线图
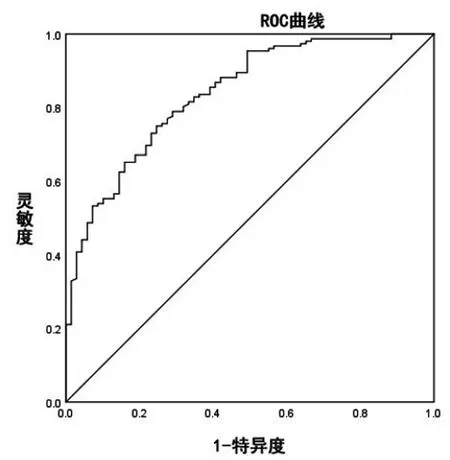
图2 治疗2个月AAG水平预测肺结核化疗预后不良风险的ROC曲线图
3 讨 论
刘杰等[2]研究显示,肺结核患者行常规化疗后,痰转阴率仅有75.0%,病灶吸收率仅有67.5%。本研究结果显示,肺结核患者病灶吸收率达68.78%。提示肺结核患者行化疗治疗的获益仍不理想,对预后相关指标进行研究尤为必要。
本研究结果显示,治疗2个月IFN-γ、TNF-α、MIF、IL-15过表达,AAG表达下调可增加肺结核化疗患者预后风险。分析原因:TNF-α可激活细胞免疫应答反应,发挥抗感染,抑制病原菌增殖的功能[3]。IFN-γ具有细胞毒性,可杀灭细胞内结核分枝杆菌;并通过激活巨噬细胞,产生活性氮、活性氧等物质,杀灭细胞内结核分枝杆菌[4]。MIF可活化外周血单核细胞,增加炎症介质产生,加速炎症反应,影响肺通气功能,促进肺结核病情进展[5]。在肺结核患者中,TNF-α、IFN-γ、MIF表达说明患者结核分枝杆菌增殖能力较强,患者病灶吸收慢,预后风险高。
IL-15可活化T淋巴细胞,与TNF-α共同作用,促进局部T淋巴细胞聚集,并增加IFN-γ分泌,进而溶解靶细胞,攻击细胞内结核分枝杆菌[6]。IL-15可活化B淋巴细胞,B淋巴细胞为抗原提呈细胞,可提呈细胞、产生抗体,并可刺激T淋巴细胞增殖、生长,发挥抗结核效果。IL-15表达水平越高,说明患者机体结核分枝杆菌越活跃,肺结核病情越严重,经治疗后,患者预后风险仍较高。AAG是急性时相蛋白,正常情况下在外周血中含量低,在感染、炎症等病理状态下,肝脏合成急性时相蛋白增多,血清中AAG表达上调[7]。而在肺结核患者中,AAG含量表现为显著降低,与合并肝损伤有关。因肺结核患者需接受化疗,选用药物较多,治疗时间较长,随疗程进展,可导致药物性肝功能损伤,肝脏分泌AAG能力降低。此外,化疗药物可产生免疫抑制,可造成肝脏合成AAG减少[8]。因此AAG表达下调时,患者对化疗的耐受性较差,结核分枝杆菌耐药性强,病灶吸收速度慢,患者预后风险较高。
绘制ROC发现,AAG及IL-15水平对肺结核患者化疗预后有更高预测价值。临床应在肺结核治疗期间定期检测AAG及IL-15水平,实施保肝、抗炎治疗。但因本研究观察时间尚短、纳入资料不够全面,结论尚有局限,还应在未来增加其他相关指标,延长观察时间,进一步分析肺结核患者预后的相关指标。

